0 引言
生物土壤结皮(Biological Soil Crusts, BSCs)是由隐花植物如蓝藻、绿藻、地衣、藓类和微生物及相关的其他生物体通过菌丝体、假根和分泌物等与表层土壤颗粒“胶结”而形成的具有独特结构和功能的地表生物覆盖体,是荒漠系统中联结生物与非生物因素的“生态系统工程师”,它的存在被认为是健康生态系统的重要标志[1]。目前,BSCs约占陆地面积的12%,主要分布在植被稀疏的干旱半干旱区[2]。BSCs在不同生物气候区的荒漠景观过程[3]、土壤生态过程[4]、土壤水文过程[5]、土壤生物过程和地球化学循环过程[6-7],以及干旱半干旱地区生态修复过程中发挥着重要作用[8]。因此,BSCs的研究是地学和生物学学科交叉的前沿研究领域,已成为国际干旱区地表过程研究的重要核心科学问题。
蓝藻是BSCs的先锋拓殖生物,譬如Microcoleus、裂须藻属(Schizothrix)和Coleofasciculus等属的丝状蓝藻与细菌不同,它们可以通过光能将CO2合成为自身需要的有机物,它们还可以向体外分泌以多糖为主的物质,从而黏结土壤颗粒和沙粒,形成早期的BSCs[9-11]。BSCs成熟期的伪枝藻属(Scytonema)、单歧藻属(Tolypothrix)和念珠藻属(Nostoc)除有固氮能力外,还可以产生色素和胞外多糖抵御荒漠区的强辐射,从而提高BSCs的生存能力和促进其发育进程[2,12-13]。随着分子生物技术快速的发展,利用非培养的扩增子和宏基因组技术可以更深入地揭示BSCs中蓝藻群落结构特征[14-15],培养BSCs中的蓝藻群落也成为研究其生物学功能和获得人工蓝藻结皮构建中藻种组合的首要任务。本研究通过培养玛曲、民勤和盐池藻结皮中丝状蓝藻群落,旨在揭示不同气候生物区可培养丝状蓝藻的群落结构差异,同时也为荒漠化治理提供不同生境的藻种。
1 研究区与方法
1.1 研究区状况
表1 采样地概况
Table 1
| 样地 | 气候类型 | 经纬度 | 海拔 /m | 年降 水量 /mm | 年蒸 发量 /mm | 年均 气温 /℃ | 土壤 类型 | 主要植被 |
|---|---|---|---|---|---|---|---|---|
| 民勤 | 大陆性荒漠气候 | 38°35′01″N,102°58′16″E | 1 391 | 117 | 2 352 | 7.7 | 黏沙土 | 红砂、白刺、油蒿;猪毛菜、盐生草、五星蒿、画眉草 |
| 盐池 | 中温带大陆性气候 | 37°42′31″N,107°13′37″E | 1 530 | 292 | 2 024 | 8.3 | 风沙土 | 油蒿、杨柴、沙柳、花棒;赖草、白草、沙生针茅 |
| 玛曲 | 高原大陆性气候 | 34°00′39″N,102°09′30″E | 3 446 | 616 | 1 353 | 1.1 | 沙质土 | 褐鳞苔草、粗壮嵩草、赖草、垂穗披碱草 |
图1
1.2 样品采集
样品的采集于2017年8月进行。选取BSCs发育主要是藻阶段的样地,在样地内用无菌铲将藻结皮层从土壤表面剥离装入无菌的封口袋,尽快运回实验室进行分离培养。
1.3 藻种的分离培养
将采集的藻结皮约5 g左右放入盛有30 mL BG11液体培养基的50 mL锥形瓶中,放置在摇床中震荡45 min后静置30 min,然后在超净工作台上吸取100 uL上清液涂布于BG11和BG110固体平板培养基上,将平板放置于温度为28 ℃、光照3 000 lux的光照培养箱中12 h照/12 h暗进行培养。待培养大约2个月后,固体培养基上呈现出形态不相同的藻落, 然后用BG11和BG110固体培养基将各个藻落进行分离纯化。将纯化的藻落制片在显微镜(Olympus,CX31)40倍或100倍视野下对藻丝进行照相和进行后续的分子鉴定。
1.4 DNA提取
将分离纯化的藻株刮取收集到已灭菌的研钵中,加入一定量的液氮研磨,将研磨碎的蓝藻加入到细菌基因组DNA提取试剂盒的离心管中,按照试剂盒的提取步骤进行提取。
1.5 PCR扩增与测序
PCR引物为8-27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1507-1492r(5′-CGGTTACCTTGTTACGACTT-3′)。扩增体系:1×PCR缓冲液(MBI),2.5 mM MgCl2(MBI),正反向引物各0.2 μM,0.2 mM dNTP,1U Taq DNA 聚合酶(MBI),1 μL上述细胞裂解液用作DNA模板,总反应体系25 μL。同时用无菌去离子水代替DNA模板用作PCR反应的阴性对照。扩增条件:94 ℃下预变性1 min;94 ℃下变性1 min,复性温度58 ℃下1 min,72 ℃下延伸1.5 min,共30个循环;72 ℃下延伸10 min。PCR产物用1.0%(wt/vol)琼脂糖凝胶电泳检测。
将扩增片段送往上海美吉测序公司测序,将测序所获得的序列与Genbank NCBI Blast(
2 结果与分析
2.1 蓝藻的形态学特征
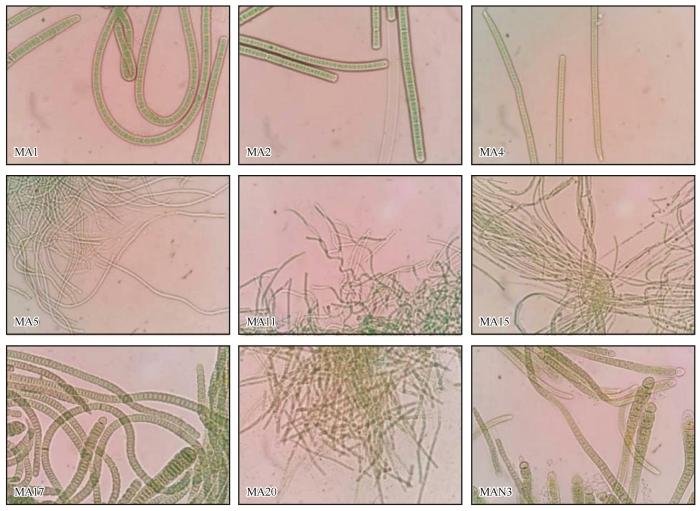
图2
图2
玛曲BSCs蓝藻藻丝显微图
Fig.2
Microscopic picture of cyanobacterial filaments from BSCs in Maqu
表2 玛曲BSCs可培养蓝藻群落组成
Table 2
| 藻株 编号 | 所属蓝藻目 | 藻丝形态 | 相似藻(登录号) | 相似度 /% | 相似藻 来源 |
|---|---|---|---|---|---|
| MA2 | 颤藻目 (Oscillatoriales) | 藻丝体较宽,成束,鞘厚,细胞圆柱形,横壁不收缢,末端细胞扁圆柱形 | Ancylothrix terrestris(NR_149292) | 99.5 | 土壤 |
| MA4 | 藻丝较宽,成束,鞘厚,细胞近方形,横壁不收缢;具帽状体 | Microcoleus vaginatus(EF654078) | 99.8 | 土壤 | |
| MA15 | 藻丝较细,弯曲缠绕,鞘薄,细胞圆柱形,横壁不收缢,末端不渐细 | Phormidium sp. SAG (EU624415) | 99.1 | 土壤 | |
| MA5 | 聚球藻目 (Synechococcales) | 藻丝较细,群聚成簇,鞘薄,横壁收缢,末端不渐细 | Leptolyngbya margaretheana(FR798934) | 98.5 | 生物膜 |
| MA11 | 藻丝较细,群集成簇,部分成螺旋状,具有结节,鞘薄,横壁收缢,末端细胞头状 | Nodosilinea sp. ACSSI (MT425934) | 99.6 | 黑钙土 | |
| MA20 | 藻丝较细,弯曲,群集成簇,鞘薄,细胞圆柱形,横壁收缢,末端不渐细 | Uncultured cyanobacterium clone (HQ189074) | 99.2 | 高山土壤 | |
| MA1 | 念珠藻目 (Nostocales) | 藻丝体较宽,弯曲缠绕,鞘厚,细胞圆柱形,横壁不收缢,末端渐细 | Nostoc sp. FI5-VF5 clone (MH427695) | 96.3 | 土壤 |
| MA17 | 藻丝宽,较长,群集成簇,不分枝,鞘薄,横壁收缢,异形胞基生,呈半球形 | Calothrix desertica(AF132779) | 99.3 | 沙粒 | |
| MAN3 | 藻丝较宽,较短,群集成簇,不分枝,鞘薄,横壁收缢,异形胞基生,呈半球形 | Calothrix desertica(AF132779) | 98.8 | 沙粒 |
图3
图3
民勤BSCs蓝藻藻丝显微图
Fig.3
Microscopic picture of cyanobacterial filaments from BSCs in Minqin
表3 民勤BSCs可培养蓝藻群落组成
Table 3
| 藻株编号 | 所属蓝藻目 | 藻丝形态 | 相似藻(登录号) | 相似度/% | 相似藻来源 |
|---|---|---|---|---|---|
| MIN1 | 颤藻目 (Oscillatoriales) | 藻丝较宽,成束,鞘厚,细胞近方形,横壁不收缢,具帽状体 | Microcoleus vaginatus(MW403933) | 99.9 | BSCs |
| MIN2 | 藻丝较宽,扭曲成团,鞘薄,细胞短柱形,横壁不收缢,末端渐细 | Oscillatoria sp. WY04 (MG874712) | 99.1 | 水稻 | |
| MIN3 | 藻丝较宽,成束,鞘厚,细胞短圆柱形,横壁不收缢,末端细胞钝圆锥形 | Microcoleus sp. PCC 7113 (CP003632) | 98.2 | 土壤 | |
| MIN6 | 藻丝较宽,弯曲,鞘厚,细胞近方形,横壁不收缢,有颗粒,末端细胞多样 | Tychonema sp. SAG (KM019964) | 99.4 | 土壤 | |
| MIN8 | 藻丝较宽,成束,鞘厚,细胞短圆柱形,横壁不收缢,有颗粒,末端细胞渐细 | Microcoleus steenstrupii(MG641920) | 99.3 | BSCs | |
| MIN9 | 藻丝较宽,弯曲缠绕,鞘厚,细胞圆柱形,横壁不收缢,末端细胞圆锥形 | Uncultured bacterium clone (FJ230813) | 97.6 | 矿泥 | |
| MIN18 | 藻丝较细,群集成簇,鞘薄,细胞圆柱形,横壁不收缢,末端不渐细 | Microcoleus sp. LSB13 clone (MW403938) | 99.1 | BSCs | |
| MIN23 | 藻丝较宽,群集成簇,鞘厚,细胞近方形,横壁不收缢,端不渐细 | Phormidesmis sp. ACSSI (KY283068) | 98.9 | 土壤 | |
| MIN4 | 聚球藻目 (Synechococcales) | 藻丝较细,弯曲成簇,鞘薄,细胞圆柱形,横壁不收缢,末端细胞头状 | Oculatella atacamensis(MK248001) | 99.4 | BSCs |
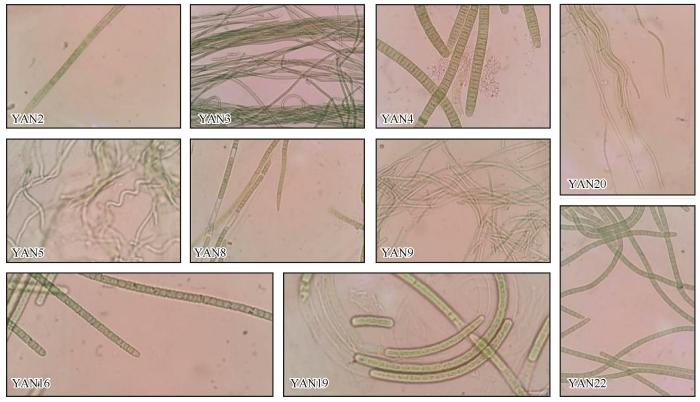
图4
图4
盐池BSCs蓝藻藻丝显微图
Fig.4
Microscopic picture of cyanobacterial filaments from BSCs in Yanchi
表4 盐池BSCs可培养蓝藻群落组成
Table 4
| 藻株 编号 | 所属蓝藻目 | 藻丝形态 | 相似藻(登录号) | 相似度 /% | 相似藻 来源 |
|---|---|---|---|---|---|
| YAN2 | 颤藻目 (Oscillatoriales) | 藻丝较宽,成束,鞘厚,细胞圆柱形,横壁不收缢,有颗粒,具帽状体 | Microcoleus sp. LSB13 clone (MW403938) | 99.6 | BSCs |
| YAN3 | 藻丝较宽,扭曲成绳状,鞘厚,细胞短圆柱形,横壁不收缢,具帽状体 | Microcoleus cf. vaginatus (MH688845) | 99.6 | BSCs | |
| YAN4 | 藻丝宽,弯曲,鞘薄,细胞短圆柱形,横壁不收缢,有颗粒,末端不渐细 | Coleofasciculus chthonoplastes(KC463190) | 98.9 | BSCs | |
| YAN16 | 藻丝宽,弯曲,鞘薄,细胞短圆柱形,横壁不收缢,末端不渐细 | Oscillatoria sp. WY04 (MG874712) | 99.3 | 水稻 | |
| YAN19 | 藻丝较宽,弯曲缠绕,鞘厚,细胞圆柱形,横壁收缢,末端不渐细 | Microcoleus sp. ACSSI (MT425931) | 99.4 | 黑钙土 | |
| YAN22 | 藻丝较宽,群集成团,鞘薄,细胞圆柱形,横壁不收缢,末端细胞圆锥形 | Oscillatoriales cyanobacterium (MT664819) | 99.9 | BSCs | |
| YAN5 | 聚球藻目 (Synechococcales) | 藻丝较细,群集成团,部分螺旋状,鞘薄,细胞短圆柱形,横壁不收缢,末端细胞头状 | Uncultured cyanobacterium clone (EU255707) | 97.2 | 微生 物垫 |
| YAN8 | 藻丝较宽,弯曲缠绕,鞘厚,细胞圆柱形,横壁收缢,末端细胞钝圆锥形 | Nodosilinea epilithica(KY283051) | 99.3 | 土壤 | |
| YAN9 | 藻丝较细,群集成团,鞘薄,细胞圆柱形,横壁收缢,末端细胞头状 | Pseudophormidium sp. WJT61-NPBG13 (KJ939055) | 99.4 | 荒漠土 | |
| YAN20 | 藻丝较细,呈波浪形弯曲,鞘薄,细胞圆柱形,横壁收缢,末端细胞头状 | Nodosilinea sp. ACSSI (MT425934) | 99.6 | 黑钙土 |
2.2 蓝藻的16S rRNA系统发育
对纯化出的67株丝状蓝藻进行16s rRNA分子鉴定,它们为隶属于颤藻目(Oscillatoriales),聚球目(Synechococcales)和念珠藻目(Nostocales)的28种蓝藻。
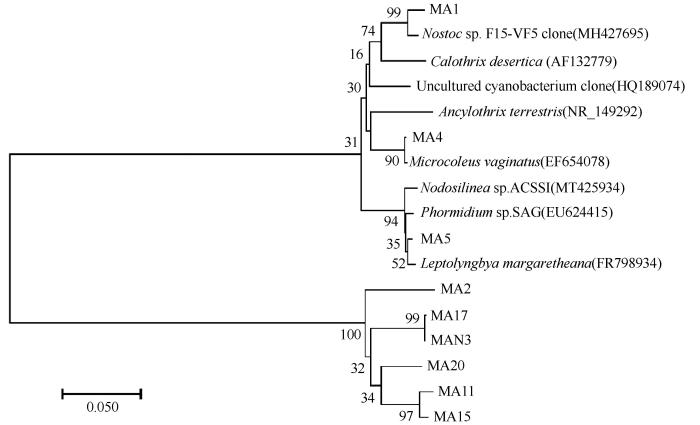
在高寒区玛曲藻结皮中分离到的9种丝状蓝藻的系统发育树显示(表2、图5),其中3种与Oscillatoriales中的Microcoleus,Ancylothrix和Phormidium(席藻属)的蓝藻相似度均在99%以上;2种与Synechococcales中Leptolyngbya(瘦鞘丝藻属)和Nodosilinea的蓝藻相似度在98%以上;MA20与最相似蓝藻克隆的相似度在99%以上,其次与Synechococcales中Leptolyngbya的蓝藻相似仅96%,MA1与Nostoc的蓝藻克隆的相似度仅有96%,因此,MA20和MA1很可能是未鉴定分类的新藻种。同时,在含氮BG11和无氮BG110平板上都培养分离到具有异形胞的固氮眉藻(Calothrix desertica),但它们的丝体形态各异,相对BG110平板上培养出的眉藻,BG11上的丝状体体积更大。9种丝状蓝藻中接近90%的与源于土壤的蓝藻相似。
图5
图5
玛曲BSCs蓝藻16S rDNA系统发育树
Fig.5
Phylogenetic tree of cyanobacteria from BSCs in Maqu based on 16S rDNA sequences
图6
图6
民勤BSCs蓝藻16S rDNA系统发育树
Fig.6
Phylogenetic tree of cyanobacteria from BSCs in Minqin based on 16S rDNA sequences
图7
图7
盐池BSCs蓝藻16S rDNA系统发育树
Fig.7
Phylogenetic tree of cyanobacteria from BSCs in Yanchi based on 16S rDNA sequences
2.3 不同气候区生物结皮蓝藻物种组成特征
在3个不同生物气候区培养分离到的丝状蓝藻种类数接近,但群落组成存在差异(图8)。其中,Microcoleus vaginatus是玛曲、民勤和盐池藻结皮中的共有蓝藻;未分离到只属于玛曲和民勤藻结皮共有蓝藻属;Microcoleus和Oscillatoria是只属于民勤和盐池藻结皮的共有蓝藻属,Nodosilinea是只属于玛曲和盐池藻结皮的共有蓝藻属。同时,Ancylothrix terrestris、C. desertica、Leptolyngbya margareth-eana、Phormidium sp.相似藻和2种未分类藻是玛曲藻结皮独有藻;O. atacamensis、Microcoleus steenstrupii、Tychonema sp.、Phormidesmis sp.相似藻和1种未分类藻是民勤藻结皮独有藻;Coleofasciculus chthonoplastes、Pseudophormidium sp.、Oscillatoriales相似藻和1种未分类藻是盐池藻结皮独有藻。我们只有在玛曲分离到了固氮蓝藻(C. desertica),而在其他2个区未分离到。
图8
图8
3个生物气候区丝状蓝藻的韦恩图
Fig.8
Venn of filamentous cyanobacteria in three bioclimatic regions
3 结论与讨论
Microcoleus是3个不同生物气候区共有的蓝藻属。Zhou等[17]利用扩增子测序发现Microcoleus是毛乌素沙地藻结皮中的关键蓝藻属,本研究同样利用扩增子测序发现Microcoleus也是沙坡头不同恢复年代BSCs中蓝藻群落的优势属(未发表)。Microcoleus属蓝藻之所以分布广[18-19],很可能由于面对荒漠区的强辐射,Microcoleus属蓝藻群落可以移动到地面以下隐藏,当地面足够潮湿时再返回地表进行光合作用[20-21],它们还可以利用多糖鞘抵御干旱[22]。Garcia-Pichel等[23]发现M.vaginatus适应低温,而M. steenstrupii适应气温相对较高的生境。而Hagemann等[24]发现M. vaginatus相似藻适应比较高温和干旱的生境。在玛曲、民勤和盐池藻结皮中都分离到M. vaginatus,而只在民勤分离到了M. steenstrupii,这很可能是前者的生态位比后者宽的缘故。
在玛曲藻结皮中分离到了固氮蓝藻(C. desertica),而在其他2个生物气候区未分离到固氮蓝藻。正如Weber等[14]的研究结果,固氮蓝藻主要分布在BSCs的成熟阶段(地衣阶段和苔藓阶段),而我们只在藻结皮中进行了培养和分离。目前就固氮蓝藻,对于Scytonema和Nostoc(念珠藻属)的报道较多,它们主要分布干旱区,在潮湿的高山地区未发现[25-26],这是由于它们对于水分受限具有抵御能力,而对于高海拔的低温没有耐受性[27],我们不但在玛曲分离到C. desertica,而且在青海沙珠玉植被恢复的BSCs中也分离到C. desertica(未发表),这说明它很可能是高寒区BSCs中的关键固氮藻。
3个不同生物气候区藻结皮分离到的蓝藻主要隶属于Oscillatoriales和Synechococcales,这与Pushkareva等[28]利用扩增子测序对北极蓝藻结皮中蓝藻群落的研究结果一致。除了Microcoleus以外,Leptolyngbya和Phormidesmis属蓝藻分布较广[29-30],这很可能与它们具有较高的抗旱和耐高温能力有关[24]。我们不但在干旱区和高寒区都分离到这2个属的蓝藻,Pushkareva等[28]在北极也恢复出Leptolyngbya和Phormidesmis的蓝藻,说明这2个属的蓝藻还具有耐低温的抗逆性。Perkerson等[31]在分子水平将Nodosilinea从Leptolyngbya分离出来,因此,它们的藻丝形态十分相似。在目前利用人工藻结皮抵御荒漠化的过程中,除了选用M. vaginatus和Scytonema javanicum作为藻种以外,还考虑选用Leptolyngbya和Phormidesmis属的蓝藻种。
参考文献
Effect of microbiotic soil surface crusts on emergence of vascular plants
[J].
Photoautotrophic organisms control microbial abundance,diversity and physiology in different types of biological soil crusts
[J].
Understanding dryland landscape dynamics:Do biological crusts hold the key?
[J].
Biological soil crusts development affects physicochemical characteristics of soil surface in semiarid ecosystem
[J].
Diversity and patch-size distributions of biological soil crusts regulate dryland ecosystem multifunctionality
[J].
Patterns and controls on nitrogen cycling of biological soil crusts
[M]//Weber B,Büdel B,Belnap J.
Complex role of the polymeric matrix in biological soil crusts
[J].
Extracellular polysaccharides from cyanobacterial soil crusts:a review of their role in dryland soil processes
[J].
Contribution of cryptogamic covers to the global cycles of carbon and nitrogen
[J].
Changes in functional gene structure and metabolic potential of the microbial community in biological soil crusts along a revegetation chronosequence in the Tengger Desert
[J].
Network analysis reveals the strengthening of microbial interaction in biological soil crust development in the Mu Us Sandy Land,northwestern China
[J].
Genotypic and phenotypic diversity of cyanobacteria in biological soil crusts of the Succulent Karoo and Nama Karoo of southern Africa
[J].
Community succession of bacteria and eukaryotes in dune ecosystems of Gurbantünggüt Desert,Northwest China
[J].
The world at your feet:desert biological soil crusts
[J].
Small-scale environments and distribution of biological soil crusts
[M]//
Biological crusts
[M]//Lal R.
Temperature drives the continental-scale distribution of key microbes in topsoil communities
[J].
Cyanobacterial diversity in biological soil crusts along a precipitation gradient,northwest Negev Desert,Israel
[J].
Some like it high! phylogenetic diversity of high-elevation cyanobacterial community from biological soil crusts of Western Himalaya
[J].
Diversity,molecular phylogeny,and metabolic activity of cyanobacteria in biological soil crusts from Santiniketan (India)
[J].
Survival of diazotrophic cyanobacteria in soil
[J].
Cyanobacterial community composition in Arctic soil crusts at different stages of development
[J].
Diazotrophic community structure and function in two successional stages of biological soil crusts from the Colorado Plateau and Chihuahuan Desert
[J].
Seven new species of Oculatella
A unique Pseudanabaenalean (Cyanobacteria) genus Nodosilinea gen.nov.based on morphological and molecular data
[J].









 甘公网安备 62010202000688号
甘公网安备 62010202000688号