两种荒漠蓝藻生长特征及其对培养水体微环境的影响
王楠 , 1 , 2 , 赵燕翘 1 , 2 , 许文文 1 , 2 , 孙靖尧 1 , 李承义 1 , 2 , 赵洋 , 1
1.中国科学院西北生态环境资源研究院 沙坡头沙漠研究试验站,甘肃 兰州 730000
2.中国科学院大学,北京 100049
Growth characteristics of two desert cyanobacteria and their influence on culture solution microenvironment
Wang Nan , 1 , 2 , Zhao Yanqiao 1 , 2 , Xu Wenwen 1 , 2 , Sun Jingyao 1 , Li Chengyi 1 , 2 , Zhao Yang , 1
1.Shapotou Desert Research and Experiment Station,Northwest Institute of Eco-Environment and Resources,Chinese Academy of Sciences,Lanzhou 730000
2.University of Chinese Academy of Sciences,Beijing 100049
通讯作者: 赵洋(E-mail: zhaoyang66@126.com )
收稿日期: 2022-04-08
修回日期: 2022-05-30
基金资助:
国家自然科学基金项目 . 32171630 中国科学院“西部之光”重点项目
Received: 2022-04-08
Revised: 2022-05-30
摘要
人工生物土壤结皮是近年来新兴的绿色环保固沙材料,是目前沙区生态恢复研究的前沿和热点,用于人工生物土壤结皮培养的荒漠蓝藻等生物体的产量是该技术大规模应用的限制因素。为了解荒漠蓝藻的生长特征及其影响因子,以分离于腾格里沙漠蓝藻结皮中的优势荒漠蓝藻——具鞘微鞘藻(Microcolus vaginatus )和念珠藻(Nostoc carneum )为对象,探索了实验室条件下接种密度对荒漠蓝藻生长和培养水体pH及电导率的影响。结果显示:随着接种密度的增加,具鞘微鞘藻和念珠藻生长进入稳定期的时间提前。在生长初期,具鞘微鞘藻在0.35、0.95 mg·L-1 密度下的干重显著高于2.13、6.59、13.42 mg·L-1 密度下的干重,生长后期则相反。在生长前期和后期,念珠藻在0.04~0.32 mg·L-1 密度下的干重和总质量均显著高于0.86~2.59 mg·L-1 密度下;具鞘微鞘藻在6.59~13.42 mg·L-1 密度下的总质量显著高于0.35~2.13 mg·L-1 密度下;在相同接种密度条件时,具鞘微鞘藻的总质量显著高于念珠藻(P <0.05)。两种蓝藻的生长均提高了培养水体pH,但降低了电导率。具鞘微鞘藻和念珠藻的总质量与接种密度呈幂相关和二项式相关,培养水体pH与两种蓝藻的干重均呈线性相关。接种密度显著影响具鞘微鞘藻和念珠藻生长,两种蓝藻的大量繁殖是水体pH升高和电导率下降的主要因素。建议在进行大规模培养时两种荒漠蓝藻的接种密度范围分别为6.59~13.42 mg·L-1 和0.04~0.32 mg·L-1 。
关键词:
生物土壤结皮 荒漠蓝藻 具鞘微鞘藻(Microcolus vaginatus ) 念珠藻(Nostoc carneum ) 接种密度
Abstract
In recent years, the artificial biological soil crusts applied in land desertification has been developed to be a technology of new and green in the environment protection particular in fixing moving sand and the study of ecological restoration of desert areas. However, the yield of desert cyanobacteria and other organisms used for the cultivation of artificial biological soil crusts is a bottleneck that limits the large-scale application of this technology. Thereby, to explore the growth characteristics of desert cyanobacteria and their effect factors, seven predominated species isolating from Tengger Desert cyanobacteria crusts, including Microcolus vaginatus and Nostoc carneum , were selected as subjects. In the condition of laboratory test, the influence of inoculum density on its growth characteristics and the changes of pH and conductivity of water environment during growth are explored. Results showed that, with the increase of the inoculum density, the growth time to enter stationary phase of M. vaginatus and N. carneum was advanced. In the early stage of growth, the dry weight of M. vaginatus was significantly higher at densities of 0.35 and 0.95 mg·L-1 than at densities of 2.13, 6.59 and 13.42 mg·L-1 , and the opposite was true in the later stages of growth. In the early and late stages of growth, the dry weight of N. carneum in the density of 0.04-0.32 mg·L-1 was significantly higher than that of the density of 0.86-2.59 mg·L-1 ;the total mass of M. vaginatus at the density of 6.59-13.42 mg·L-1 was significantly higher than 0.35-2.13 mg·L-1 ,the total mass of Nostoc spp. was significantly higher at the density of 0.04-0.32 mg·L-1 than 0.86-2.59 mg·L-1 ,the total mass of M. vaginatus was significantly higher than Nostoc spp. under the same inoculum density. The growth of both M. vaginatus and N. carneum can increase the pH of water environment, but decrease the electrical conductivity significantly. The total mass of M. vaginatus and N. carneum showed a significant power and binomial relationship with inoculum density respectively, the pH of water environment with the dry weights of M. vaginatus and N. carneum was significantly positively correlated, and the electrical conductivity had a negative correlation with the dry weight of N. carneum . The inoculum density is an important factor affecting the growth of M. vaginatus and N. carneum . The proliferation of two species of cyanobacteria is one of the main causes of the high pH and the decrease of the electrical conductivity of water environment. Therefore, this study suggests that the inoculum density of the two desert cyanobacteria are 6.59-13.42 mg·L-1 and 0.04-0.32 mg·L-1 during large-scale cultivation, respectively.
Keywords:
biological soil crust desert cyanobacteria Microcolus vaginatus Nostoc carneum initial densities
本文引用格式
王楠, 赵燕翘, 许文文, 孙靖尧, 李承义, 赵洋. 两种荒漠蓝藻生长特征及其对培养水体微环境的影响 . 中国沙漠 [J], 2023, 43(1): 66-74 doi:10.7522/j.issn.1000-694X.2022.00085
Wang Nan, Zhao Yanqiao, Xu Wenwen, Sun Jingyao, Li Chengyi, Zhao Yang. Growth characteristics of two desert cyanobacteria and their influence on culture solution microenvironment . Journal of Desert Research
0 引言
生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] 。作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] 。然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] 。因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提。然而,自然条件下BSCs的形成往往需要几十年。近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] 。荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] 。此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] 。
光照、温度、pH、电导率和密度是影响荒漠蓝藻生物量的主要因素。已有学者对少数几种荒漠蓝藻进行了研究,得出了荒漠蓝藻生长的最佳光照强度[2 ,11 -12 ] 。Rossi等[13 ] 综合分析已有文献报道,发现具鞘微鞘藻(Microcoleus vaginatus )生长的适宜温度为20~30 ℃。接种密度是荒漠蓝藻接种必须考虑的因素。谢作明等[14 ] 发现具鞘微鞘藻的生物量和生长速度会因接种密度而表现出差异。张雅涵[15 ] 证实当初始接种量从0.25 μg·cm-2 增加到1 μg·cm-2 时(浓度以叶绿素a计),具鞘微鞘藻的生物量同步增加。目前,对荒漠蓝藻生长的研究主要通过细胞密度或叶绿素a含量设置接种密度,而这些方法在大规模培养时操作难度大,且不利于推广使用[14 -15 ] 。因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究。此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道。因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义。
具鞘微鞘藻和念珠藻(Nostoc carneum )是蓝藻结皮中的优势蓝藻,在人工BSCs培育中应用广泛[9 ] 。因此,本研究以上述2种荒漠蓝藻为对象,在实验室条件下比较了不同接种密度下它们的生长规律,探讨接种密度对其生长特征的影响和2种蓝藻在生长过程中对培养水体pH和电导率的影响,以及水体变化对2种蓝藻生长的影响。研究结果将为荒漠蓝藻规模化培养提供理论依据,促进人工培育BSCs技术大规模推广和应用。
1 材料和方法
1.1 材料
本研究所用的具鞘微鞘藻和念珠藻从位于腾格里沙漠东南缘(37°27′N,105°00′E)发育良好的蓝藻结皮中分离、纯化得到[16 -17 ] 。
1.2 试验设计
研究于2020年8—10月在中国科学院沙坡头沙漠研究试验站BSCs实验室进行。共设置5种接种密度,分别为0.5、1、2、5、12 mg·L-1 。由于蓝藻体积小,为了操作方便,采用对应的体积法进行吸取。根据预试验结果,从具鞘微鞘藻和念珠藻蓝藻液中分别吸取0.5、1、2、5、10 mL作为对应的接种密度。为准确知道蓝藻的实际质量,测定了不同蓝藻液体积对应的干重,具鞘微鞘藻5种体积对应的实际密度分别为0.35±0.01、0.95±0.05、2.13±0.13、6.59±0.27、13.42±0.43 mg·L-1 ,念珠藻5种体积对应的实际密度分别为0.04±0.02、0.32±0.04、0.86±0.07、2.59±0.14、4.86±0.40 mg·L-1 ,每个处理设置3次重复。
1.3 试验方法
将低温保存的具鞘微鞘藻和念珠藻在超净工作台进行接种,在无菌水中培养24~48 h,使其恢复活性。然后吸取无菌水中的具鞘微鞘藻和念珠藻藻液接种于BG·11培养液里培养,培养一周左右备用。试验第0 天时先将具鞘微鞘藻和念珠藻藻液静置2 h,静置后倒掉每个瓶中大约2/3的上清液。然后分别从摇匀的蓝藻液中吸取0.5、1、2、5、10 mL蓝藻液分别置于500 mL三角瓶中,加入无菌BG·11培养液,使每个三角瓶中的液体体积为300 mL。
为消除三角瓶摆放位置对试验结果的影响,培养时将三角瓶随机摆放在摇床上。蓝藻培养时的温度为25±2 ℃,光照强度为4 000 lux,转速为140 r·min-1 ,光暗比为12 h∶12 h,培养周期为15 d。培养水体起始pH和电导率分别为7.52±0.02和165.58±0.48 μS·s-1 。试验过程中所用三角瓶及所有玻璃仪器均经过清水冲洗,并在稀盐酸中浸泡30 min后以无菌水冲洗干净,烘干后使用。试验所用的BG·11培养液均在120 ℃的高压灭菌锅(仪器型号:LDZF-50KB-3,中国上海申安医疗器械有限公司)中进行2 h灭菌处理。
1.4 样品采集与指标测定
从培养第0天开始,每隔2 d从三角瓶中分3次均匀吸取藻液5 mL,共吸取15 mL。其中5 mL用于测定干重,在80 ℃烘箱中烘干至恒重,取出后用十万分之一电子天平称重;将另外10 mL蓝藻液置于离心管中静置,用水质测试针(仪器型号:86505,中国台湾衡欣科技股份有限公司)测上清液的pH和电导率。为保证液体体积保持一致,每次取样后均向三角瓶中补充15 mL的BG·11培养液。培养结束后(第15天),将所有蓝藻液放入80 ℃烘箱中烘干至恒重,取出后称重。
1.5 数据处理及统计分析
数据整理、统计分析和绘图分别采用Excel 2016、SPSS 21.0和Origin 2018软件。
2 结果
2.1 接种密度对两种荒漠蓝藻日生长的影响
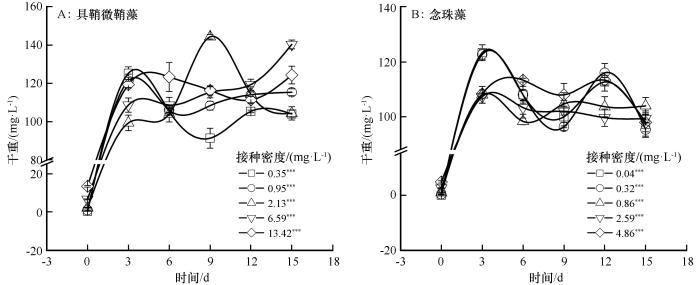
培养期间,具鞘微鞘藻和念珠藻的干重均呈现先快速增加、后缓慢增加、最后稳定的趋势(图1 )。具鞘微鞘藻在0.35、0.95 mg·L-1 密度下干重均在第3天达到最大值,分别在第12天和第9天达到稳定期;在2.13 mg·L-1 密度下干重在第9天达到最大值后逐渐下降;在6.59 mg·L-1 密度下,干重在整个培养周期中持续增长,在第15天达到最大值;在13.42 mg·L-1 密度下干重在第3天达到稳定期。在5种接种密度下念珠藻均在0~3 d迅速生长,其中在0.04、0.32 mg·L-1 密度下干重均在第3天达到最大值,随后呈波动状态;在0.86、2.59、4.86 mg·L-1 密度下干重均在第3天达到最大值后逐渐趋于稳定。具鞘微鞘藻在第3天时在2.13、6.59 mg·L-1 密度下,干重显著低于0.35、0.95 mg·L-1 密度,但在第15天时在6.59 mg·L-1 密度下,干重显著高于其他4种密度(P <0.05)。念珠藻在第3、12天时,在0.04、0.32 mg·L-1 密度下,干重显著高于0.86、2.59 mg·L-1 密度(P <0.05)。
图1
图1
不同接种密度下具鞘微鞘藻和念珠藻干重变化特征 (平均值±标准误。差异显著性:***,P <0.001)
Fig.1
The dry weight change characteristics of the Microcoleus vaginatus and Nostoc carneum in different initial densities
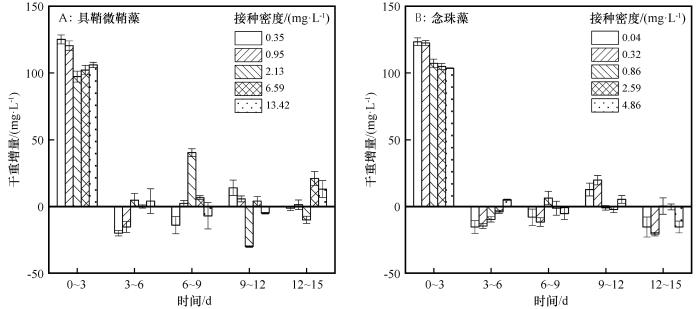
具鞘微鞘藻和念珠藻在5种接种密度下的干重增量均在0~3 d达到最大值,随后干重增量随时间变化均降低(图2 )。在0~3 d,具鞘微鞘藻在0.35、0.95 mg·L-1 密度下的干重增量120~125 mg·L-1 ,显著高于2.13~13.42 mg·L-1 密度的干重增量95~105 mg·L-1 (P <0.05)。在12~15 d时,具鞘微鞘藻在6.59、13.42 mg·L-1 密度下的干重增量显著高于其他3种密度(P <0.05)。在0~3 d,念珠藻在0.04、0.32 mg·L-1 密度下干重增量122~124 mg·L-1 ,显著高于0.86~4.86 mg·L-1 密度的干重增量103~108 mg·L-1 (P <0.05)。在9~12 d,念珠藻在0.04、0.32、4.86 mg·L-1 密度下干重增量显著高于0.86、2.59 mg·L-1 密度(P <0.05)。
图2
图2
不同接种密度下具鞘微鞘藻和念珠藻的干重增量
Fig.2
The dry weight increments of Microcoleus vaginatus and Nostoc carneum in different initial densities
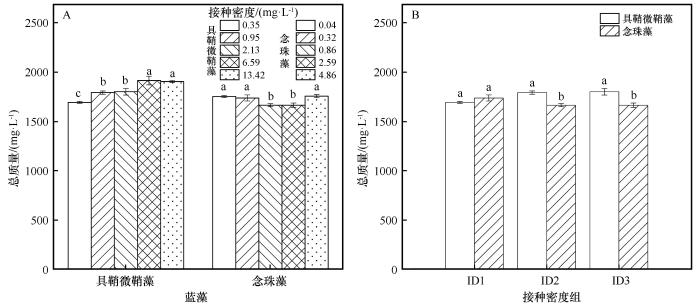
2.2 接种密度对两种荒漠蓝藻总质量的影响
具鞘微鞘藻在6.59、13.42 mg·L-1 接种密度下,总质量(干重)1 914.78、1 905.11 mg·L-1 显著高于0.35、0.95、2.13 mg·L-1 密度的总质量1 692.89、1 792.77、1 801.22 mg·L-1 ;念珠藻在0.04、0.32、4.86 mg·L-1 接种密度的总质量1 752.89、1 738.33、1 756.33 mg·L-1 ,显著高于0.86、2.59 mg·L-1 密度的总质量1 664.89、1 665.00 mg·L-1 。对相近接种密度时,具鞘微鞘藻和念珠藻接种密度0.35 mg·L-1 ∶0.32 mg·L-1 组时总质量之间没有显著差异,而在0.95 mg·L-1 ∶0.86 mg·L-1 和2.13 mg·L-1 ∶2.59 mg·L-1 组时具鞘微鞘藻的总质量显著高于念珠藻(P <0.05,图3 )。
图3
图3
不同接种密度下具鞘微鞘藻和念珠藻的总质量(干重)
不同字母表示差异显著,P <0.05。ID1:具鞘微鞘藻∶念珠藻=0.35 mg·L-1 ∶0.32 mg·L-1 ;ID2:具鞘微鞘藻∶念珠藻=0.95 mg·L-1 ∶0.86 mg·L-1 ;ID3:具鞘微鞘藻∶念珠藻=2.13 mg·L-1 ∶2.59 mg·L-1
Fig.3
The total mass of the Microcoleus vaginatus and Nostoc carneum in different initial densities
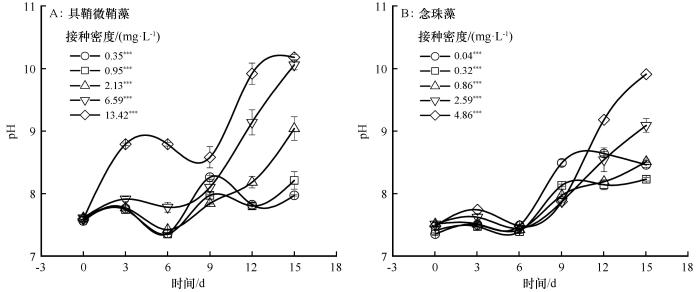
2.3 两种荒漠蓝藻培养水体pH 和电导率变化特征
具鞘微鞘藻和念珠藻培养水体pH呈现先上升、后下降、再上升的趋势,在培养结束时均显著提高了水体pH(P <0.001,图4 )。具鞘微鞘藻在培养水体pH最大值分别出现在第9、15天,而念珠藻水体pH最大值分别出现在第12、15天。具鞘微鞘藻在第3、6、9、12天时,在13.42 mg·L-1 密度下水体pH显著高于0.35~6.59 mg·L-1 密度(P <0.01);第15天时,在6.59、13.42 mg·L-1 密度下pH显著高于0.35~2.13 mg·L-1 (P <0.001)。念珠藻在第3天时,在4.86 mg·L-1 密度下pH显著高于0.04~0.86 mg·L-1 (P <0.01);在第15天时,在2.59~4.86 mg·L-1 密度下pH显著高于0.04~0.32 mg·L-1 (P <0.01)。
图4
图4
不同接种密度下具鞘微鞘藻和念珠藻水体pH变化特征(平均值±标准误。差异显著性:***,P <0.001)
Fig.4
The pH change characteristics of the Microcoleus vaginatus and Nostoc carneum in different initial densities
具鞘微鞘藻的水体电导率在0.35、0.95 mg·L-1 和2.13~13.42 mg·L-1 密度下随时间变化分别呈上升和下降趋势(图5 )。具鞘微鞘藻在0.35、0.95 mg·L-1 密度下电导率均在第6天达到最大值165.17、165.67 μS·s-1 ;在2.13、6.59、13.42 mg·L-1 密度下电导率分别在第15、12、9天达到最低值154.17、156.73、161.6 μS·s-1 。念珠藻在5种接种密度下电导率随时间变化均呈下降趋势。念珠藻在0.04~4.86 mg·L-1 密度下电导率分别在第9、9、15、15、12天达到最低值166.43、166.00、164.3、161.4、158.77 μS·s-1 。第12天,具鞘微鞘藻在6.59 mg·L-1 密度下电导率显著低于其他4种密度(P <0.05);在第15天时,在2.13~6.59 mg·L-1 密度下电导率显著低于其他3种密度(P <0.01)。念珠藻在第12天时,在2.59、4.86 mg·L-1 密度下电导率显著低于其他3种密度(P <0.01)。
图5
图5
不同接种密度下具鞘微鞘藻和念珠藻电导率变化特征(平均值±标准误,差异显著性:*,P < 0.05;***,P <0.001;NS,P >0.05)
Fig.5
The conductivity change characteristics of the Microcoleus vaginatus and Nostoc carneum in different initial densities
2.4 两种荒漠蓝藻总质量/ 干重与接种密度、pH 和电导率的关系
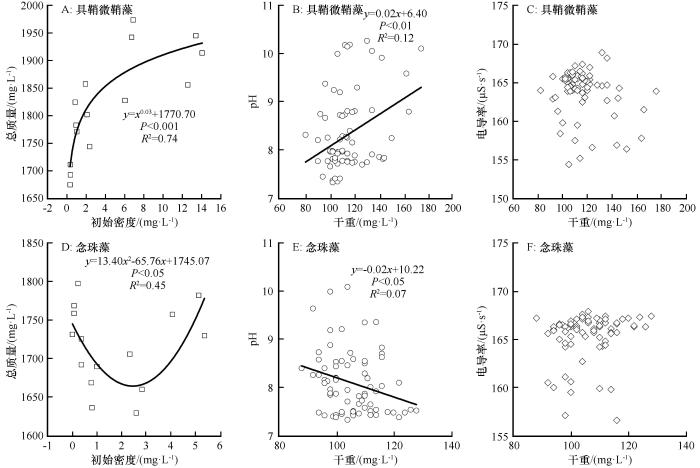
具鞘微鞘藻和念珠藻的总质量与5种接种密度分别呈幂相关(y =x 0.03 +1770.70,P <0.001,R 2 =0.74)和二项式相关(y =13.40x 2 -65.76x +1745.07,P <0.05,R 2 =0.45,图6 )。具鞘微鞘藻培养的水体pH和干重呈线性正相关(y =0.02x +6.40,P <0.01,R 2 =0.12),而念珠藻培养的水体pH和干重成线性负相关(y =-0.02x +10.22,P <0.05,R 2 =0.07)。
图6
图6
具鞘微鞘藻和念珠藻的总质量与接种密度、pH和电导率的回归关系
Fig. 6
Relationships between inoculum density, pH and conductivity and the total mass of Microcoleus vaginatus (A, B, C)and Nostoc carneum (D, E, F)
3 讨论
3.1 接种密度对具鞘微鞘藻和念珠藻生长特征的影响
密度是蓝藻生长和增殖的重要影响因素,显著影响蓝藻在生长过程中的生长周期、日生长特征和总质量等[18 ] 。本研究表明,随着接种密度的增加,具鞘微鞘藻和念珠藻生长进入稳定期的时间提前。原因可能是在培养初期,两种蓝藻对光照强度、营养物质等资源竞争压力较小,出现迅速增加的现象,而接种密度越高,藻体之间相互遮挡光源的可能性越大,导致光合作用降低,因此2种荒漠蓝藻在培养初期较低接种密度下的干重增量较大且长势较好[18 -19 ] 。
具鞘微鞘藻随接种密度的增加,干重达到最大值的时间较晚,而念珠藻没有表现出这种现象。这可能是由异形胞具鞘微鞘藻和非异形胞念珠藻自身的生长和繁殖特性所决定的[11 ] 。接种密度对蓝藻总质量的影响可归因于培养过程中单个蓝藻的光有效利用性的影响。由于蓝藻在培养过程中会相互遮挡,形成光暗循环,光暗循环的频率和单个蓝藻在一定光照强度下的光周期总长度取决于接种密度,接种密度越高,光暗周期的频率也会越高,单个蓝藻从每个光暗周期下接受的光照强度时间越短[20 ] 。在本研究中接种密度显著影响具鞘微鞘藻和念珠藻的生长。具鞘微鞘藻在6.59、13.42 mg·L-1 密度下培养后的总质量最高,这可能由于接种密度越高,光暗周期越频繁,单个蓝藻接受的光照强度时间越短,因此减小了光氧化引起的蓝藻损伤或死亡[21 ] 。念珠藻在0.04、0.32 mg·L-1 密度下培养的总质量最高,表明在此密度下达到了最佳的光暗循环频率和光照时间。然而接种密度的进一步增加可能造成更长的光暗周期频率和接受更长的光照时间,从而导致总质量减少[20 ] 。
3.2 具鞘微鞘藻和念珠藻生长对水环境pH 和电导率的影响
水环境pH与水体中碳酸盐平衡系统有关,水体中CO2 含量是影响碳酸盐平衡系统的主要因子,其中水生生物代谢活动以及有机质的分解对CO2 的含量影响最为显著[22 -23 ] 。在本研究中,具鞘微鞘藻和念珠藻在培养前3天均促使培养水体pH升高,可能由于蓝藻在培养初期进行光合作用消耗大量溶解于水体中的CO2 ,破坏水体中H2 CO3 原有的平衡,从而促使水环境pH的上升[24 -25 ] 。具鞘微鞘藻和念珠藻水体pH在3~9 d出现过下降的现象,此时水体中CO2 浓度很低,碳酸氢盐成为水体中的主要碳源[26 ] 。具鞘微鞘藻和念珠藻水体pH在9~15 d再次升高,可能是由于H C O 3 - 2 和OH- ,或者通过阴离子交换机制使H C O 3 - - ,完成H C O 3 - [22 ] 。支彦丽等[26 ] 利用pH漂移技术,从碳酸氢盐的利用角度将藻类分为3类,第一类是不能利用碳酸氢盐的藻类,漂移试验中pH终值很少超过9;第二类是具有利用碳酸氢盐能力的藻类,其pH可以漂移至9;第三类是强碳酸氢盐利用的藻类,pH不但会升高至9以上,还会出现第二次提升。本研究中具鞘微鞘藻和念珠藻在生长末期pH均能达到9以上,可见这2种蓝藻均可能是强H C O 3 -
蓝藻在生长过程中培养水体微环境的变化会影响蓝藻的生物量、营养盐的吸收及初级和次级代谢产物的产生[22 ,27 ] 。本研究发现水体pH的上升与具鞘微鞘藻和念珠藻的生长量分别呈正线性和负线性相关关系。在本研究中,具鞘微鞘藻在试验前3 d干重变化明显,水体pH也在短时间显著上升,到试验的第15天,具鞘微鞘藻在6.59~13.42 mg·L-1 密度下水体pH达到9.0以上,此时具鞘微鞘藻干重增量依旧增加且继续表现出生长态势,pH处在9.75~10.50时具鞘微鞘藻获得最高总质量,说明具鞘微鞘藻在6.59~13.42 mg·L-1 密度下对水体pH具有较强的调节能力,且在此pH(9.75~10.50)下其抗氧化的能力较强还能有效保护细胞膜的完整性,较高的pH条件更有利于其生长繁殖[27 ] 。而念珠藻在第15天,在0.04、0.32 mg·L-1 密度下获得较高的生物量,此时水体pH为8.2~8.5,显著低于2.59~4.86 mg·L-1 密度下水体的pH(9.0~10.0),念珠藻促使水体pH上升的幅度相对较小,但其生长同样偏好碱性环境。这与郑云普等[28 -29 ] 研究表明pH为8~11时有利于具鞘微鞘藻和念珠藻的生长,在碱性水体中具有较高的藻类生产力的结论一致。
水体电导率是用来衡量水携带电子的能力,与水体中的离子浓度和种类有关,主要反映水体中无机盐含量[30 ] 。Chamizo等[31 ] 研究发现念珠藻、爪哇伪枝藻和席藻在培养9 d后3种蓝藻细胞内蛋白质含量均显著提高且分别占干重的55%、53% 和34%。在本研究中,具鞘微鞘藻和念珠藻的电导率整体呈下降的趋势,其原因可能是在BG·11培养液中NO3 - H P O 4 2 - S O 4 2 - [32 -34 ] 。
4 结论
具鞘微鞘藻和念珠藻随着接种密度的增加生长进入稳定期的时间提前。生长初期具鞘微鞘藻在0.35、0.95 mg·L-1 密度下的长势好于2.13、6.59、13.42 mg·L-1 密度,生长后期则相反。念珠藻在0.04~0.32 mg·L-1 密度下相较于0.86~2.56 mg·L-1 密度表现出较好的生长态势。在6.59~13.42 mg·L-1 和0.04~0.32 mg·L-1 接种密度下,具鞘微鞘藻和念珠藻具有较高的总质量,而在相同接种密度下具鞘微鞘藻的总质量显著高于念珠藻。综上所述,接种密度显著影响具鞘微鞘藻和念珠藻的生长和总质量,本研究建议在进行大规模培养时,2种荒漠蓝藻的接种密度分别为6.59~13.42 mg·L-1 和0.04~0.32 mg·L-1 。
参考文献
View Option
[1]
Belnap J Lange O L Biological Soil Crusts:Structure,Function,and Management [M].Berlin,Germany :Springer ,2003 :12 -13 .
[本文引用: 1]
[2]
李新荣 ,回嵘 ,赵洋 中国荒漠生物土壤结皮生态生理学研究 [M].北京 :高等教育出版社 ,2016 :20 -21 .
[本文引用: 3]
[3]
Li X R Hui R Tan H J et al Biocrust research in China:recent progress and application in land degradation control
[J].Frontiers in Plant Science ,2021 ,12 :751521 .
[本文引用: 1]
[4]
Rodriguez-Caballero E Belnap J Budel B et al Dryland photoautotrophic soil surface communities endangered by global change
[J].Nature Geoscience ,2018 ,11 (3 ):185 -189 .
[本文引用: 1]
[5]
Antoninka A Bowker M A Barger N N et al Addressing barriers to improve biocrust colonization and establishment in dryland restoration
[J].Restoration Ecology ,2019 ,20 (28 ):150 -159 .
[本文引用: 1]
[6]
赵洋 ,潘颜霞 ,苏洁琼 ,等 中国干旱区沙化土地绿色环保治理技术综述
[J].中国沙漠 ,2021 ,41 (1 ):195 -202 .
[本文引用: 1]
[7]
周晓兵 ,张丙昌 ,张元明 生物土壤结皮固沙理论与实践
[J].中国沙漠 ,2021 ,41 (1 ):164 -173 .
[8]
Zhao Y Xu W W Wang N Effects of covering sand with different soil substrates on the formation and development of artificial biocrusts in a natural desert environment
[J].Soil and Tillage Research ,2021 ,213 :105081 .
[本文引用: 1]
[9]
Zhao Y Wang N Zhang Z S et al Accelerating the development of artificial biocrusts using covers for restoration of degraded land in dryland ecosystems
[J].Land Degradation and Development ,2020 ,32 (1 ):1 -11 .
[本文引用: 2]
[10]
Román J R Chamizo S Ramos R B et al Overcoming field barriers to restore dryland soils by cyanobacteria inoculation
[J].Soil and Tillage Research ,2020 ,207 (6 ):1 -17 .
[本文引用: 2]
[11]
Giraldo-silva A Nelson C Barger N N et al Nursing biocrusts:isolation,cultivation,and fitness test of indigenous cyanobacteria
[J].Restoration Ecology ,2019 ,27 (4 ):793 -803 .
[本文引用: 2]
[12]
D′acqui L P Use of indigenous cyanobacteria for sustainable improvement of biogeochemical and physical fertility of marginal soils in semiarid tropics
[C]//Arora N K,Mehnaz S,Balestrini R.Bioformulations:For Sustainable Agriculture .India :Springer ,2016 :213 -232 .
[本文引用: 1]
[13]
Rossi F Li H Liu Y D et al Cyanobacterial inoculation(cyanobacterisation):perspectives for the development of a standardized multifunctional technology for soil fertilization and desertification reversal
[J].Earth Science Reviews ,2017 ,171 (10 ):28 -43 .
[本文引用: 1]
[14]
谢作明 ,刘永定 ,陈兰洲 ,等 不同培养条件对具鞘微鞘藻生物量和多糖产量的影响
[J].水生生物学报 ,2008 ,32 (2 ):272 -275 .
[本文引用: 2]
[15]
张雅涵 具鞘微鞘藻室内培养及产胞外多糖条件的优化
[D].兰州 :兰州理工大学 ,2014 .
[本文引用: 2]
[16]
Taton A Stana G Brambilla E et al Cyanobacterial diversity in natural and artificial microbial mats of Lake Fryxell (McMurdo Dry Valleys,Antarctica):a morphological and molecular approach
[J].Applied and Environmental Microbiology ,2003 ,69 (9 ):5157 -5169 .
[本文引用: 1]
[17]
Park C H Li X R Jia R L et al Effects of superabsorbent polymer on cyanobacterial biological soil crust formation in laboratory
[J].Arid Soil Research and Rehabilitation ,2014 ,29 (1 ):55 -71 .
[本文引用: 1]
[18]
Dunn R M Manoylov K M The effects of initial cell density on the growth and proliferation of the potentially toxic cyanobacterium Microcystis aeruginosa
[J].Journal of Environmental Protection ,2016 ,7 (9 ):1210 -1220 .
[本文引用: 2]
[19]
Matsudo M C Bezerra R P Sato S et al Repeated fed-batch cultivation of Arthrospira(Spirulina ) platensis using urea as nitrogen source
[J].Biochemistry Engineer Journal ,2009 ,43 (1 ):52 -57 .
[本文引用: 1]
[20]
Wang J Han D Sommerfeld M R et al Effect of initial biomass density on growth and astaxanthin production of Haematococcus pluvialis in an outdoor photobioreactor
[J].Journal of Applied Phycology ,2013 ,25 (1 ):253 -260 .
[本文引用: 2]
[21]
Li F Cai M G Lin M W et al Enhanced biomass and astaxanthin production of Haematococcus pluvialis by a cell transformation strategy with optimized initial biomass density
[J].Marine Drugs ,2020 ,18 (7 ):1 -10 .
[本文引用: 1]
[22]
Taraldsvik M Myklestad S M The effect of pH on growth rate,biochemical composition and extracellular carbohydrate production of the marine diatom Skeletonema costatum
[J].British Phycological Bulletin ,2000 ,35 (2 ):189 -194 .
[本文引用: 3]
[23]
刘健康 高级水生生物学 [M].北京 :科学出版社 ,1999 :146 -147 .
[本文引用: 1]
[24]
Brewer P G Goldman J C Alkalinity changes generated by phytoplankton growth
[J].Limnol Oceanogr ,1976 ,21 (1 ):108 -117 .
[本文引用: 1]
[25]
Lόpez-archilla A I Moreira D Lόpez-garcia P et al Phytoplankton diversity and cyanobacterial dominance in a hypereutrophic shallow lake with biologically produced alkaline pH
[J].Extremophiles ,2004 ,8 (2 ):109 -115 .
[本文引用: 1]
[26]
支彦丽 ,储昭升 ,钟远 ,等 铜绿微囊藻和四尾栅藻光合利用碳酸氢盐探讨
[J].湖泊科学 ,2008 ,20 (4 ):443 -449 .
[本文引用: 2]
[27]
苏发文 ,高鹏程 ,来琦芳 ,等 铜绿微囊藻和小球藻对水环境pH的影响
[J].中国水产科学 ,2016 ,23 (6 ):1380 -1388 .
[本文引用: 2]
[28]
郑云普 ,张丙昌 ,赵建成 ,等 不同理化因子对分离于荒漠生物结皮中念珠藻生长的影响
[J].河北师范大学学报(自然科学版) ,2009 ,33 (4 ):531 -537 .
[本文引用: 1]
[29]
郑云普 ,赵建成 ,张丙昌 ,等 不同理化因子对荒漠生物结皮中三种蓝藻生长的影响
[J].干旱地区农业研究 ,2010 ,28 (1 ):206 -211 .
[本文引用: 1]
[30]
Iyasele J U Idiata D J D J Investigation of relationship between electrical conductivity and total dissolve solids for mono-valent,divalent and trivalent metal compounds
[J].International Journal of Engineering Research and Reviews ,2015 ,3 (1 ):40 -48 .
[本文引用: 1]
[31]
Chamizo S Adessi A Torzillo G et al Exopolysaccharide features influence growth success in biocrust-forming cyanobacteria,moving from liquid culture to sand microcosms
[J].Frontiers in Microbiology ,2020 ,11 (6 ):1 -16 .
[本文引用: 1]
[32]
鲍亦璐 ,杨鹏波 ,王倩 ,等 螺旋藻培养过程中的营养盐监测与消耗
[J].食品科技 ,2011 ,36 (3 ):98 -102 .
[本文引用: 1]
[33]
闫阁 ,付亮 ,谢雨彤 ,等 铜绿微囊藻生长代谢的密度依赖性特征及分子机制
[J].环境科学学报 ,2020 ,40 (10 ):3757 -3763 .
[34]
文新宇 ,张虎才 ,常凤琴 ,等 泸沽湖水体垂直断面季节性分层
[J].地球科学进展 ,2016 ,31 (8 ):858 -869 .
[本文引用: 1]
1
2003
... 生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] .作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] .然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] .因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提.然而,自然条件下BSCs的形成往往需要几十年.近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] .荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] .此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
3
2016
... 生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] .作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] .然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] .因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提.然而,自然条件下BSCs的形成往往需要几十年.近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] .荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] .此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
... [2 ].此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
... 光照、温度、pH、电导率和密度是影响荒漠蓝藻生物量的主要因素.已有学者对少数几种荒漠蓝藻进行了研究,得出了荒漠蓝藻生长的最佳光照强度[2 ,11 -12 ] .Rossi等[13 ] 综合分析已有文献报道,发现具鞘微鞘藻(Microcoleus vaginatus )生长的适宜温度为20~30 ℃.接种密度是荒漠蓝藻接种必须考虑的因素.谢作明等[14 ] 发现具鞘微鞘藻的生物量和生长速度会因接种密度而表现出差异.张雅涵[15 ] 证实当初始接种量从0.25 μg·cm-2 增加到1 μg·cm-2 时(浓度以叶绿素a计),具鞘微鞘藻的生物量同步增加.目前,对荒漠蓝藻生长的研究主要通过细胞密度或叶绿素a含量设置接种密度,而这些方法在大规模培养时操作难度大,且不利于推广使用[14 -15 ] .因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究.此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道.因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义. ...
Biocrust research in China:recent progress and application in land degradation control
1
2021
... 生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] .作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] .然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] .因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提.然而,自然条件下BSCs的形成往往需要几十年.近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] .荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] .此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
Dryland photoautotrophic soil surface communities endangered by global change
1
2018
... 生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] .作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] .然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] .因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提.然而,自然条件下BSCs的形成往往需要几十年.近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] .荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] .此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
Addressing barriers to improve biocrust colonization and establishment in dryland restoration
1
2019
... 生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] .作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] .然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] .因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提.然而,自然条件下BSCs的形成往往需要几十年.近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] .荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] .此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
中国干旱区沙化土地绿色环保治理技术综述
1
2021
... 生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] .作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] .然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] .因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提.然而,自然条件下BSCs的形成往往需要几十年.近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] .荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] .此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
Effects of covering sand with different soil substrates on the formation and development of artificial biocrusts in a natural desert environment
1
2021
... 生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] .作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] .然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] .因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提.然而,自然条件下BSCs的形成往往需要几十年.近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] .荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] .此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
Accelerating the development of artificial biocrusts using covers for restoration of degraded land in dryland ecosystems
2
2020
... 生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] .作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] .然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] .因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提.然而,自然条件下BSCs的形成往往需要几十年.近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] .荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] .此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
... 具鞘微鞘藻和念珠藻(Nostoc carneum )是蓝藻结皮中的优势蓝藻,在人工BSCs培育中应用广泛[9 ] .因此,本研究以上述2种荒漠蓝藻为对象,在实验室条件下比较了不同接种密度下它们的生长规律,探讨接种密度对其生长特征的影响和2种蓝藻在生长过程中对培养水体pH和电导率的影响,以及水体变化对2种蓝藻生长的影响.研究结果将为荒漠蓝藻规模化培养提供理论依据,促进人工培育BSCs技术大规模推广和应用. ...
Overcoming field barriers to restore dryland soils by cyanobacteria inoculation
2
2020
... 生物土壤结皮(Biological Soil Crusts,BSCs)是由蓝藻、绿藻、地衣、藓类和异养微生物以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体,约占地表活体覆盖面积的40%以上[1 -2 ] .作为“荒漠生态系统工程师”,BSCs在荒漠土壤生态水文等过程以及沙区生态修复过程中发挥着重要作用[3 ] .然而,BSCs的这些重要功能会随着环境的改变发生显著变化,如Rodriguez-Caballero等[4 ] 预测截至2070年,气候变化和人类活动将导致BSCs面积减少27%~39%,这会引起土壤沙尘增加和碳氮固定减少[5 ] .因此,修复受损BSCs并维持它们的稳定是保证其生态功能发挥的重要前提.然而,自然条件下BSCs的形成往往需要几十年.近年来,人工培育技术成功缩短了BSCs形成时间,使荒漠土壤生境得到了迅速改善[6 -8 ] .荒漠蓝藻作为BSCs形成的先锋物种,能在干旱、强紫外辐射、营养贫瘠的环境中生存繁衍[2 ] .此外,相比BSCs中的地衣和藓类,荒漠蓝藻更容易在恶劣的自然条件下培养,因此成为人工培育BSCs的理想材料[9 -10 ] . ...
... 光照、温度、pH、电导率和密度是影响荒漠蓝藻生物量的主要因素.已有学者对少数几种荒漠蓝藻进行了研究,得出了荒漠蓝藻生长的最佳光照强度[2 ,11 -12 ] .Rossi等[13 ] 综合分析已有文献报道,发现具鞘微鞘藻(Microcoleus vaginatus )生长的适宜温度为20~30 ℃.接种密度是荒漠蓝藻接种必须考虑的因素.谢作明等[14 ] 发现具鞘微鞘藻的生物量和生长速度会因接种密度而表现出差异.张雅涵[15 ] 证实当初始接种量从0.25 μg·cm-2 增加到1 μg·cm-2 时(浓度以叶绿素a计),具鞘微鞘藻的生物量同步增加.目前,对荒漠蓝藻生长的研究主要通过细胞密度或叶绿素a含量设置接种密度,而这些方法在大规模培养时操作难度大,且不利于推广使用[14 -15 ] .因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究.此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道.因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义. ...
Nursing biocrusts:isolation,cultivation,and fitness test of indigenous cyanobacteria
2
2019
... 光照、温度、pH、电导率和密度是影响荒漠蓝藻生物量的主要因素.已有学者对少数几种荒漠蓝藻进行了研究,得出了荒漠蓝藻生长的最佳光照强度[2 ,11 -12 ] .Rossi等[13 ] 综合分析已有文献报道,发现具鞘微鞘藻(Microcoleus vaginatus )生长的适宜温度为20~30 ℃.接种密度是荒漠蓝藻接种必须考虑的因素.谢作明等[14 ] 发现具鞘微鞘藻的生物量和生长速度会因接种密度而表现出差异.张雅涵[15 ] 证实当初始接种量从0.25 μg·cm-2 增加到1 μg·cm-2 时(浓度以叶绿素a计),具鞘微鞘藻的生物量同步增加.目前,对荒漠蓝藻生长的研究主要通过细胞密度或叶绿素a含量设置接种密度,而这些方法在大规模培养时操作难度大,且不利于推广使用[14 -15 ] .因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究.此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道.因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义. ...
... 具鞘微鞘藻随接种密度的增加,干重达到最大值的时间较晚,而念珠藻没有表现出这种现象.这可能是由异形胞具鞘微鞘藻和非异形胞念珠藻自身的生长和繁殖特性所决定的[11 ] .接种密度对蓝藻总质量的影响可归因于培养过程中单个蓝藻的光有效利用性的影响.由于蓝藻在培养过程中会相互遮挡,形成光暗循环,光暗循环的频率和单个蓝藻在一定光照强度下的光周期总长度取决于接种密度,接种密度越高,光暗周期的频率也会越高,单个蓝藻从每个光暗周期下接受的光照强度时间越短[20 ] .在本研究中接种密度显著影响具鞘微鞘藻和念珠藻的生长.具鞘微鞘藻在6.59、13.42 mg·L-1 密度下培养后的总质量最高,这可能由于接种密度越高,光暗周期越频繁,单个蓝藻接受的光照强度时间越短,因此减小了光氧化引起的蓝藻损伤或死亡[21 ] .念珠藻在0.04、0.32 mg·L-1 密度下培养的总质量最高,表明在此密度下达到了最佳的光暗循环频率和光照时间.然而接种密度的进一步增加可能造成更长的光暗周期频率和接受更长的光照时间,从而导致总质量减少[20 ] . ...
Use of indigenous cyanobacteria for sustainable improvement of biogeochemical and physical fertility of marginal soils in semiarid tropics
1
2016
... 光照、温度、pH、电导率和密度是影响荒漠蓝藻生物量的主要因素.已有学者对少数几种荒漠蓝藻进行了研究,得出了荒漠蓝藻生长的最佳光照强度[2 ,11 -12 ] .Rossi等[13 ] 综合分析已有文献报道,发现具鞘微鞘藻(Microcoleus vaginatus )生长的适宜温度为20~30 ℃.接种密度是荒漠蓝藻接种必须考虑的因素.谢作明等[14 ] 发现具鞘微鞘藻的生物量和生长速度会因接种密度而表现出差异.张雅涵[15 ] 证实当初始接种量从0.25 μg·cm-2 增加到1 μg·cm-2 时(浓度以叶绿素a计),具鞘微鞘藻的生物量同步增加.目前,对荒漠蓝藻生长的研究主要通过细胞密度或叶绿素a含量设置接种密度,而这些方法在大规模培养时操作难度大,且不利于推广使用[14 -15 ] .因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究.此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道.因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义. ...
Cyanobacterial inoculation(cyanobacterisation):perspectives for the development of a standardized multifunctional technology for soil fertilization and desertification reversal
1
2017
... 光照、温度、pH、电导率和密度是影响荒漠蓝藻生物量的主要因素.已有学者对少数几种荒漠蓝藻进行了研究,得出了荒漠蓝藻生长的最佳光照强度[2 ,11 -12 ] .Rossi等[13 ] 综合分析已有文献报道,发现具鞘微鞘藻(Microcoleus vaginatus )生长的适宜温度为20~30 ℃.接种密度是荒漠蓝藻接种必须考虑的因素.谢作明等[14 ] 发现具鞘微鞘藻的生物量和生长速度会因接种密度而表现出差异.张雅涵[15 ] 证实当初始接种量从0.25 μg·cm-2 增加到1 μg·cm-2 时(浓度以叶绿素a计),具鞘微鞘藻的生物量同步增加.目前,对荒漠蓝藻生长的研究主要通过细胞密度或叶绿素a含量设置接种密度,而这些方法在大规模培养时操作难度大,且不利于推广使用[14 -15 ] .因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究.此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道.因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义. ...
不同培养条件对具鞘微鞘藻生物量和多糖产量的影响
2
2008
... 光照、温度、pH、电导率和密度是影响荒漠蓝藻生物量的主要因素.已有学者对少数几种荒漠蓝藻进行了研究,得出了荒漠蓝藻生长的最佳光照强度[2 ,11 -12 ] .Rossi等[13 ] 综合分析已有文献报道,发现具鞘微鞘藻(Microcoleus vaginatus )生长的适宜温度为20~30 ℃.接种密度是荒漠蓝藻接种必须考虑的因素.谢作明等[14 ] 发现具鞘微鞘藻的生物量和生长速度会因接种密度而表现出差异.张雅涵[15 ] 证实当初始接种量从0.25 μg·cm-2 增加到1 μg·cm-2 时(浓度以叶绿素a计),具鞘微鞘藻的生物量同步增加.目前,对荒漠蓝藻生长的研究主要通过细胞密度或叶绿素a含量设置接种密度,而这些方法在大规模培养时操作难度大,且不利于推广使用[14 -15 ] .因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究.此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道.因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义. ...
... [14 -15 ].因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究.此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道.因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义. ...
具鞘微鞘藻室内培养及产胞外多糖条件的优化
2
2014
... 光照、温度、pH、电导率和密度是影响荒漠蓝藻生物量的主要因素.已有学者对少数几种荒漠蓝藻进行了研究,得出了荒漠蓝藻生长的最佳光照强度[2 ,11 -12 ] .Rossi等[13 ] 综合分析已有文献报道,发现具鞘微鞘藻(Microcoleus vaginatus )生长的适宜温度为20~30 ℃.接种密度是荒漠蓝藻接种必须考虑的因素.谢作明等[14 ] 发现具鞘微鞘藻的生物量和生长速度会因接种密度而表现出差异.张雅涵[15 ] 证实当初始接种量从0.25 μg·cm-2 增加到1 μg·cm-2 时(浓度以叶绿素a计),具鞘微鞘藻的生物量同步增加.目前,对荒漠蓝藻生长的研究主要通过细胞密度或叶绿素a含量设置接种密度,而这些方法在大规模培养时操作难度大,且不利于推广使用[14 -15 ] .因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究.此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道.因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义. ...
... -15 ].因此,有必要开展以荒漠蓝藻质量作为接种密度对荒漠蓝藻生长和产量影响的研究.此外,大多数研究关注的是非生物因子如温度和光照强度对荒漠蓝藻生长的影响[10 ] ,而荒漠蓝藻在培养过程中是否会引起培养水体微环境(pH和电导率)的变化,pH和电导率的变化是否反过来影响荒漠蓝藻的生长,仍鲜见报道.因此查明不同荒漠蓝藻在不同接种密度下的生长特征,得出不同荒漠蓝藻适宜生长的接种密度范围,及其对培养水体pH和电导率的影响,对揭示荒漠蓝藻最适生长条件具有重要的科学意义. ...
Cyanobacterial diversity in natural and artificial microbial mats of Lake Fryxell (McMurdo Dry Valleys,Antarctica):a morphological and molecular approach
1
2003
... 本研究所用的具鞘微鞘藻和念珠藻从位于腾格里沙漠东南缘(37°27′N,105°00′E)发育良好的蓝藻结皮中分离、纯化得到[16 -17 ] . ...
Effects of superabsorbent polymer on cyanobacterial biological soil crust formation in laboratory
1
2014
... 本研究所用的具鞘微鞘藻和念珠藻从位于腾格里沙漠东南缘(37°27′N,105°00′E)发育良好的蓝藻结皮中分离、纯化得到[16 -17 ] . ...
The effects of initial cell density on the growth and proliferation of the potentially toxic cyanobacterium Microcystis aeruginosa
2
2016
... 密度是蓝藻生长和增殖的重要影响因素,显著影响蓝藻在生长过程中的生长周期、日生长特征和总质量等[18 ] .本研究表明,随着接种密度的增加,具鞘微鞘藻和念珠藻生长进入稳定期的时间提前.原因可能是在培养初期,两种蓝藻对光照强度、营养物质等资源竞争压力较小,出现迅速增加的现象,而接种密度越高,藻体之间相互遮挡光源的可能性越大,导致光合作用降低,因此2种荒漠蓝藻在培养初期较低接种密度下的干重增量较大且长势较好[18 -19 ] . ...
... [18 -19 ]. ...
Repeated fed-batch cultivation of Arthrospira(Spirulina ) platensis using urea as nitrogen source
1
2009
... 密度是蓝藻生长和增殖的重要影响因素,显著影响蓝藻在生长过程中的生长周期、日生长特征和总质量等[18 ] .本研究表明,随着接种密度的增加,具鞘微鞘藻和念珠藻生长进入稳定期的时间提前.原因可能是在培养初期,两种蓝藻对光照强度、营养物质等资源竞争压力较小,出现迅速增加的现象,而接种密度越高,藻体之间相互遮挡光源的可能性越大,导致光合作用降低,因此2种荒漠蓝藻在培养初期较低接种密度下的干重增量较大且长势较好[18 -19 ] . ...
Effect of initial biomass density on growth and astaxanthin production of Haematococcus pluvialis in an outdoor photobioreactor
2
2013
... 具鞘微鞘藻随接种密度的增加,干重达到最大值的时间较晚,而念珠藻没有表现出这种现象.这可能是由异形胞具鞘微鞘藻和非异形胞念珠藻自身的生长和繁殖特性所决定的[11 ] .接种密度对蓝藻总质量的影响可归因于培养过程中单个蓝藻的光有效利用性的影响.由于蓝藻在培养过程中会相互遮挡,形成光暗循环,光暗循环的频率和单个蓝藻在一定光照强度下的光周期总长度取决于接种密度,接种密度越高,光暗周期的频率也会越高,单个蓝藻从每个光暗周期下接受的光照强度时间越短[20 ] .在本研究中接种密度显著影响具鞘微鞘藻和念珠藻的生长.具鞘微鞘藻在6.59、13.42 mg·L-1 密度下培养后的总质量最高,这可能由于接种密度越高,光暗周期越频繁,单个蓝藻接受的光照强度时间越短,因此减小了光氧化引起的蓝藻损伤或死亡[21 ] .念珠藻在0.04、0.32 mg·L-1 密度下培养的总质量最高,表明在此密度下达到了最佳的光暗循环频率和光照时间.然而接种密度的进一步增加可能造成更长的光暗周期频率和接受更长的光照时间,从而导致总质量减少[20 ] . ...
... [20 ]. ...
Enhanced biomass and astaxanthin production of Haematococcus pluvialis by a cell transformation strategy with optimized initial biomass density
1
2020
... 具鞘微鞘藻随接种密度的增加,干重达到最大值的时间较晚,而念珠藻没有表现出这种现象.这可能是由异形胞具鞘微鞘藻和非异形胞念珠藻自身的生长和繁殖特性所决定的[11 ] .接种密度对蓝藻总质量的影响可归因于培养过程中单个蓝藻的光有效利用性的影响.由于蓝藻在培养过程中会相互遮挡,形成光暗循环,光暗循环的频率和单个蓝藻在一定光照强度下的光周期总长度取决于接种密度,接种密度越高,光暗周期的频率也会越高,单个蓝藻从每个光暗周期下接受的光照强度时间越短[20 ] .在本研究中接种密度显著影响具鞘微鞘藻和念珠藻的生长.具鞘微鞘藻在6.59、13.42 mg·L-1 密度下培养后的总质量最高,这可能由于接种密度越高,光暗周期越频繁,单个蓝藻接受的光照强度时间越短,因此减小了光氧化引起的蓝藻损伤或死亡[21 ] .念珠藻在0.04、0.32 mg·L-1 密度下培养的总质量最高,表明在此密度下达到了最佳的光暗循环频率和光照时间.然而接种密度的进一步增加可能造成更长的光暗周期频率和接受更长的光照时间,从而导致总质量减少[20 ] . ...
The effect of pH on growth rate,biochemical composition and extracellular carbohydrate production of the marine diatom Skeletonema costatum
3
2000
... 水环境pH与水体中碳酸盐平衡系统有关,水体中CO2 含量是影响碳酸盐平衡系统的主要因子,其中水生生物代谢活动以及有机质的分解对CO2 的含量影响最为显著[22 -23 ] .在本研究中,具鞘微鞘藻和念珠藻在培养前3天均促使培养水体pH升高,可能由于蓝藻在培养初期进行光合作用消耗大量溶解于水体中的CO2 ,破坏水体中H2 CO3 原有的平衡,从而促使水环境pH的上升[24 -25 ] .具鞘微鞘藻和念珠藻水体pH在3~9 d出现过下降的现象,此时水体中CO2 浓度很低,碳酸氢盐成为水体中的主要碳源[26 ] .具鞘微鞘藻和念珠藻水体pH在9~15 d再次升高,可能是由于H C O 3 - 2 和OH- ,或者通过阴离子交换机制使H C O 3 - - ,完成H C O 3 - [22 ] .支彦丽等[26 ] 利用pH漂移技术,从碳酸氢盐的利用角度将藻类分为3类,第一类是不能利用碳酸氢盐的藻类,漂移试验中pH终值很少超过9;第二类是具有利用碳酸氢盐能力的藻类,其pH可以漂移至9;第三类是强碳酸氢盐利用的藻类,pH不但会升高至9以上,还会出现第二次提升.本研究中具鞘微鞘藻和念珠藻在生长末期pH均能达到9以上,可见这2种蓝藻均可能是强H C O 3 -
... [22 ].支彦丽等[26 ] 利用pH漂移技术,从碳酸氢盐的利用角度将藻类分为3类,第一类是不能利用碳酸氢盐的藻类,漂移试验中pH终值很少超过9;第二类是具有利用碳酸氢盐能力的藻类,其pH可以漂移至9;第三类是强碳酸氢盐利用的藻类,pH不但会升高至9以上,还会出现第二次提升.本研究中具鞘微鞘藻和念珠藻在生长末期pH均能达到9以上,可见这2种蓝藻均可能是强H C O 3 -
... 蓝藻在生长过程中培养水体微环境的变化会影响蓝藻的生物量、营养盐的吸收及初级和次级代谢产物的产生[22 ,27 ] .本研究发现水体pH的上升与具鞘微鞘藻和念珠藻的生长量分别呈正线性和负线性相关关系.在本研究中,具鞘微鞘藻在试验前3 d干重变化明显,水体pH也在短时间显著上升,到试验的第15天,具鞘微鞘藻在6.59~13.42 mg·L-1 密度下水体pH达到9.0以上,此时具鞘微鞘藻干重增量依旧增加且继续表现出生长态势,pH处在9.75~10.50时具鞘微鞘藻获得最高总质量,说明具鞘微鞘藻在6.59~13.42 mg·L-1 密度下对水体pH具有较强的调节能力,且在此pH(9.75~10.50)下其抗氧化的能力较强还能有效保护细胞膜的完整性,较高的pH条件更有利于其生长繁殖[27 ] .而念珠藻在第15天,在0.04、0.32 mg·L-1 密度下获得较高的生物量,此时水体pH为8.2~8.5,显著低于2.59~4.86 mg·L-1 密度下水体的pH(9.0~10.0),念珠藻促使水体pH上升的幅度相对较小,但其生长同样偏好碱性环境.这与郑云普等[28 -29 ] 研究表明pH为8~11时有利于具鞘微鞘藻和念珠藻的生长,在碱性水体中具有较高的藻类生产力的结论一致. ...
1
1999
... 水环境pH与水体中碳酸盐平衡系统有关,水体中CO2 含量是影响碳酸盐平衡系统的主要因子,其中水生生物代谢活动以及有机质的分解对CO2 的含量影响最为显著[22 -23 ] .在本研究中,具鞘微鞘藻和念珠藻在培养前3天均促使培养水体pH升高,可能由于蓝藻在培养初期进行光合作用消耗大量溶解于水体中的CO2 ,破坏水体中H2 CO3 原有的平衡,从而促使水环境pH的上升[24 -25 ] .具鞘微鞘藻和念珠藻水体pH在3~9 d出现过下降的现象,此时水体中CO2 浓度很低,碳酸氢盐成为水体中的主要碳源[26 ] .具鞘微鞘藻和念珠藻水体pH在9~15 d再次升高,可能是由于H C O 3 - 2 和OH- ,或者通过阴离子交换机制使H C O 3 - - ,完成H C O 3 - [22 ] .支彦丽等[26 ] 利用pH漂移技术,从碳酸氢盐的利用角度将藻类分为3类,第一类是不能利用碳酸氢盐的藻类,漂移试验中pH终值很少超过9;第二类是具有利用碳酸氢盐能力的藻类,其pH可以漂移至9;第三类是强碳酸氢盐利用的藻类,pH不但会升高至9以上,还会出现第二次提升.本研究中具鞘微鞘藻和念珠藻在生长末期pH均能达到9以上,可见这2种蓝藻均可能是强H C O 3 -
Alkalinity changes generated by phytoplankton growth
1
1976
... 水环境pH与水体中碳酸盐平衡系统有关,水体中CO2 含量是影响碳酸盐平衡系统的主要因子,其中水生生物代谢活动以及有机质的分解对CO2 的含量影响最为显著[22 -23 ] .在本研究中,具鞘微鞘藻和念珠藻在培养前3天均促使培养水体pH升高,可能由于蓝藻在培养初期进行光合作用消耗大量溶解于水体中的CO2 ,破坏水体中H2 CO3 原有的平衡,从而促使水环境pH的上升[24 -25 ] .具鞘微鞘藻和念珠藻水体pH在3~9 d出现过下降的现象,此时水体中CO2 浓度很低,碳酸氢盐成为水体中的主要碳源[26 ] .具鞘微鞘藻和念珠藻水体pH在9~15 d再次升高,可能是由于H C O 3 - 2 和OH- ,或者通过阴离子交换机制使H C O 3 - - ,完成H C O 3 - [22 ] .支彦丽等[26 ] 利用pH漂移技术,从碳酸氢盐的利用角度将藻类分为3类,第一类是不能利用碳酸氢盐的藻类,漂移试验中pH终值很少超过9;第二类是具有利用碳酸氢盐能力的藻类,其pH可以漂移至9;第三类是强碳酸氢盐利用的藻类,pH不但会升高至9以上,还会出现第二次提升.本研究中具鞘微鞘藻和念珠藻在生长末期pH均能达到9以上,可见这2种蓝藻均可能是强H C O 3 -
Phytoplankton diversity and cyanobacterial dominance in a hypereutrophic shallow lake with biologically produced alkaline pH
1
2004
... 水环境pH与水体中碳酸盐平衡系统有关,水体中CO2 含量是影响碳酸盐平衡系统的主要因子,其中水生生物代谢活动以及有机质的分解对CO2 的含量影响最为显著[22 -23 ] .在本研究中,具鞘微鞘藻和念珠藻在培养前3天均促使培养水体pH升高,可能由于蓝藻在培养初期进行光合作用消耗大量溶解于水体中的CO2 ,破坏水体中H2 CO3 原有的平衡,从而促使水环境pH的上升[24 -25 ] .具鞘微鞘藻和念珠藻水体pH在3~9 d出现过下降的现象,此时水体中CO2 浓度很低,碳酸氢盐成为水体中的主要碳源[26 ] .具鞘微鞘藻和念珠藻水体pH在9~15 d再次升高,可能是由于H C O 3 - 2 和OH- ,或者通过阴离子交换机制使H C O 3 - - ,完成H C O 3 - [22 ] .支彦丽等[26 ] 利用pH漂移技术,从碳酸氢盐的利用角度将藻类分为3类,第一类是不能利用碳酸氢盐的藻类,漂移试验中pH终值很少超过9;第二类是具有利用碳酸氢盐能力的藻类,其pH可以漂移至9;第三类是强碳酸氢盐利用的藻类,pH不但会升高至9以上,还会出现第二次提升.本研究中具鞘微鞘藻和念珠藻在生长末期pH均能达到9以上,可见这2种蓝藻均可能是强H C O 3 -
铜绿微囊藻和四尾栅藻光合利用碳酸氢盐探讨
2
2008
... 水环境pH与水体中碳酸盐平衡系统有关,水体中CO2 含量是影响碳酸盐平衡系统的主要因子,其中水生生物代谢活动以及有机质的分解对CO2 的含量影响最为显著[22 -23 ] .在本研究中,具鞘微鞘藻和念珠藻在培养前3天均促使培养水体pH升高,可能由于蓝藻在培养初期进行光合作用消耗大量溶解于水体中的CO2 ,破坏水体中H2 CO3 原有的平衡,从而促使水环境pH的上升[24 -25 ] .具鞘微鞘藻和念珠藻水体pH在3~9 d出现过下降的现象,此时水体中CO2 浓度很低,碳酸氢盐成为水体中的主要碳源[26 ] .具鞘微鞘藻和念珠藻水体pH在9~15 d再次升高,可能是由于H C O 3 - 2 和OH- ,或者通过阴离子交换机制使H C O 3 - - ,完成H C O 3 - [22 ] .支彦丽等[26 ] 利用pH漂移技术,从碳酸氢盐的利用角度将藻类分为3类,第一类是不能利用碳酸氢盐的藻类,漂移试验中pH终值很少超过9;第二类是具有利用碳酸氢盐能力的藻类,其pH可以漂移至9;第三类是强碳酸氢盐利用的藻类,pH不但会升高至9以上,还会出现第二次提升.本研究中具鞘微鞘藻和念珠藻在生长末期pH均能达到9以上,可见这2种蓝藻均可能是强H C O 3 -
... [26 ]利用pH漂移技术,从碳酸氢盐的利用角度将藻类分为3类,第一类是不能利用碳酸氢盐的藻类,漂移试验中pH终值很少超过9;第二类是具有利用碳酸氢盐能力的藻类,其pH可以漂移至9;第三类是强碳酸氢盐利用的藻类,pH不但会升高至9以上,还会出现第二次提升.本研究中具鞘微鞘藻和念珠藻在生长末期pH均能达到9以上,可见这2种蓝藻均可能是强H C O 3 -
铜绿微囊藻和小球藻对水环境pH的影响
2
2016
... 蓝藻在生长过程中培养水体微环境的变化会影响蓝藻的生物量、营养盐的吸收及初级和次级代谢产物的产生[22 ,27 ] .本研究发现水体pH的上升与具鞘微鞘藻和念珠藻的生长量分别呈正线性和负线性相关关系.在本研究中,具鞘微鞘藻在试验前3 d干重变化明显,水体pH也在短时间显著上升,到试验的第15天,具鞘微鞘藻在6.59~13.42 mg·L-1 密度下水体pH达到9.0以上,此时具鞘微鞘藻干重增量依旧增加且继续表现出生长态势,pH处在9.75~10.50时具鞘微鞘藻获得最高总质量,说明具鞘微鞘藻在6.59~13.42 mg·L-1 密度下对水体pH具有较强的调节能力,且在此pH(9.75~10.50)下其抗氧化的能力较强还能有效保护细胞膜的完整性,较高的pH条件更有利于其生长繁殖[27 ] .而念珠藻在第15天,在0.04、0.32 mg·L-1 密度下获得较高的生物量,此时水体pH为8.2~8.5,显著低于2.59~4.86 mg·L-1 密度下水体的pH(9.0~10.0),念珠藻促使水体pH上升的幅度相对较小,但其生长同样偏好碱性环境.这与郑云普等[28 -29 ] 研究表明pH为8~11时有利于具鞘微鞘藻和念珠藻的生长,在碱性水体中具有较高的藻类生产力的结论一致. ...
... [27 ].而念珠藻在第15天,在0.04、0.32 mg·L-1 密度下获得较高的生物量,此时水体pH为8.2~8.5,显著低于2.59~4.86 mg·L-1 密度下水体的pH(9.0~10.0),念珠藻促使水体pH上升的幅度相对较小,但其生长同样偏好碱性环境.这与郑云普等[28 -29 ] 研究表明pH为8~11时有利于具鞘微鞘藻和念珠藻的生长,在碱性水体中具有较高的藻类生产力的结论一致. ...
不同理化因子对分离于荒漠生物结皮中念珠藻生长的影响
1
2009
... 蓝藻在生长过程中培养水体微环境的变化会影响蓝藻的生物量、营养盐的吸收及初级和次级代谢产物的产生[22 ,27 ] .本研究发现水体pH的上升与具鞘微鞘藻和念珠藻的生长量分别呈正线性和负线性相关关系.在本研究中,具鞘微鞘藻在试验前3 d干重变化明显,水体pH也在短时间显著上升,到试验的第15天,具鞘微鞘藻在6.59~13.42 mg·L-1 密度下水体pH达到9.0以上,此时具鞘微鞘藻干重增量依旧增加且继续表现出生长态势,pH处在9.75~10.50时具鞘微鞘藻获得最高总质量,说明具鞘微鞘藻在6.59~13.42 mg·L-1 密度下对水体pH具有较强的调节能力,且在此pH(9.75~10.50)下其抗氧化的能力较强还能有效保护细胞膜的完整性,较高的pH条件更有利于其生长繁殖[27 ] .而念珠藻在第15天,在0.04、0.32 mg·L-1 密度下获得较高的生物量,此时水体pH为8.2~8.5,显著低于2.59~4.86 mg·L-1 密度下水体的pH(9.0~10.0),念珠藻促使水体pH上升的幅度相对较小,但其生长同样偏好碱性环境.这与郑云普等[28 -29 ] 研究表明pH为8~11时有利于具鞘微鞘藻和念珠藻的生长,在碱性水体中具有较高的藻类生产力的结论一致. ...
不同理化因子对荒漠生物结皮中三种蓝藻生长的影响
1
2010
... 蓝藻在生长过程中培养水体微环境的变化会影响蓝藻的生物量、营养盐的吸收及初级和次级代谢产物的产生[22 ,27 ] .本研究发现水体pH的上升与具鞘微鞘藻和念珠藻的生长量分别呈正线性和负线性相关关系.在本研究中,具鞘微鞘藻在试验前3 d干重变化明显,水体pH也在短时间显著上升,到试验的第15天,具鞘微鞘藻在6.59~13.42 mg·L-1 密度下水体pH达到9.0以上,此时具鞘微鞘藻干重增量依旧增加且继续表现出生长态势,pH处在9.75~10.50时具鞘微鞘藻获得最高总质量,说明具鞘微鞘藻在6.59~13.42 mg·L-1 密度下对水体pH具有较强的调节能力,且在此pH(9.75~10.50)下其抗氧化的能力较强还能有效保护细胞膜的完整性,较高的pH条件更有利于其生长繁殖[27 ] .而念珠藻在第15天,在0.04、0.32 mg·L-1 密度下获得较高的生物量,此时水体pH为8.2~8.5,显著低于2.59~4.86 mg·L-1 密度下水体的pH(9.0~10.0),念珠藻促使水体pH上升的幅度相对较小,但其生长同样偏好碱性环境.这与郑云普等[28 -29 ] 研究表明pH为8~11时有利于具鞘微鞘藻和念珠藻的生长,在碱性水体中具有较高的藻类生产力的结论一致. ...
Investigation of relationship between electrical conductivity and total dissolve solids for mono-valent,divalent and trivalent metal compounds
1
2015
... 水体电导率是用来衡量水携带电子的能力,与水体中的离子浓度和种类有关,主要反映水体中无机盐含量[30 ] .Chamizo等[31 ] 研究发现念珠藻、爪哇伪枝藻和席藻在培养9 d后3种蓝藻细胞内蛋白质含量均显著提高且分别占干重的55%、53% 和34%.在本研究中,具鞘微鞘藻和念珠藻的电导率整体呈下降的趋势,其原因可能是在BG·11培养液中NO3 - H P O 4 2 - S O 4 2 - [32 -34 ] . ...
Exopolysaccharide features influence growth success in biocrust-forming cyanobacteria,moving from liquid culture to sand microcosms
1
2020
... 水体电导率是用来衡量水携带电子的能力,与水体中的离子浓度和种类有关,主要反映水体中无机盐含量[30 ] .Chamizo等[31 ] 研究发现念珠藻、爪哇伪枝藻和席藻在培养9 d后3种蓝藻细胞内蛋白质含量均显著提高且分别占干重的55%、53% 和34%.在本研究中,具鞘微鞘藻和念珠藻的电导率整体呈下降的趋势,其原因可能是在BG·11培养液中NO3 - H P O 4 2 - S O 4 2 - [32 -34 ] . ...
螺旋藻培养过程中的营养盐监测与消耗
1
2011
... 水体电导率是用来衡量水携带电子的能力,与水体中的离子浓度和种类有关,主要反映水体中无机盐含量[30 ] .Chamizo等[31 ] 研究发现念珠藻、爪哇伪枝藻和席藻在培养9 d后3种蓝藻细胞内蛋白质含量均显著提高且分别占干重的55%、53% 和34%.在本研究中,具鞘微鞘藻和念珠藻的电导率整体呈下降的趋势,其原因可能是在BG·11培养液中NO3 - H P O 4 2 - S O 4 2 - [32 -34 ] . ...
铜绿微囊藻生长代谢的密度依赖性特征及分子机制
0
2020
泸沽湖水体垂直断面季节性分层
1
2016
... 水体电导率是用来衡量水携带电子的能力,与水体中的离子浓度和种类有关,主要反映水体中无机盐含量[30 ] .Chamizo等[31 ] 研究发现念珠藻、爪哇伪枝藻和席藻在培养9 d后3种蓝藻细胞内蛋白质含量均显著提高且分别占干重的55%、53% 和34%.在本研究中,具鞘微鞘藻和念珠藻的电导率整体呈下降的趋势,其原因可能是在BG·11培养液中NO3 - H P O 4 2 - S O 4 2 - [32 -34 ] . ...





 甘公网安备 62010202000688号
甘公网安备 62010202000688号