植物对非生物胁迫的响应机制研究
1
2018
... 近年来,经济发展、人口膨胀及环境污染等造成土壤干旱及土壤盐渍化现象日趋严重[1],干旱、高盐及高温等非生物胁迫会严重影响植物的生长和发育,降低农作物产量[2].新疆属于典型的干旱半干旱区,地形和气候复杂,也是中国沙漠化面积最大的区域[3],生态环境脆弱,沙漠化问题严重影响着农业生产和人们的生产生活[4].新疆特色沙漠固沙先锋植物羽毛针禾(Stipagrostis pennata)的根具有沙套结构,沙套对根系具有保水等作用,进而能够很好地适应沙漠的高温、干旱等非生物胁迫环境[5]. ...
棉花非生物胁迫响应基因GhWRKY6的功能验证及调控机制的研究
1
2019
... 近年来,经济发展、人口膨胀及环境污染等造成土壤干旱及土壤盐渍化现象日趋严重[1],干旱、高盐及高温等非生物胁迫会严重影响植物的生长和发育,降低农作物产量[2].新疆属于典型的干旱半干旱区,地形和气候复杂,也是中国沙漠化面积最大的区域[3],生态环境脆弱,沙漠化问题严重影响着农业生产和人们的生产生活[4].新疆特色沙漠固沙先锋植物羽毛针禾(Stipagrostis pennata)的根具有沙套结构,沙套对根系具有保水等作用,进而能够很好地适应沙漠的高温、干旱等非生物胁迫环境[5]. ...
2001-2020年新疆风沙环境致灾潜力特征
1
2023
... 近年来,经济发展、人口膨胀及环境污染等造成土壤干旱及土壤盐渍化现象日趋严重[1],干旱、高盐及高温等非生物胁迫会严重影响植物的生长和发育,降低农作物产量[2].新疆属于典型的干旱半干旱区,地形和气候复杂,也是中国沙漠化面积最大的区域[3],生态环境脆弱,沙漠化问题严重影响着农业生产和人们的生产生活[4].新疆特色沙漠固沙先锋植物羽毛针禾(Stipagrostis pennata)的根具有沙套结构,沙套对根系具有保水等作用,进而能够很好地适应沙漠的高温、干旱等非生物胁迫环境[5]. ...
古尔班通古特沙漠羽毛针禾(Stipagrostis pennata)种群种子雨特征
1
2014
... 近年来,经济发展、人口膨胀及环境污染等造成土壤干旱及土壤盐渍化现象日趋严重[1],干旱、高盐及高温等非生物胁迫会严重影响植物的生长和发育,降低农作物产量[2].新疆属于典型的干旱半干旱区,地形和气候复杂,也是中国沙漠化面积最大的区域[3],生态环境脆弱,沙漠化问题严重影响着农业生产和人们的生产生活[4].新疆特色沙漠固沙先锋植物羽毛针禾(Stipagrostis pennata)的根具有沙套结构,沙套对根系具有保水等作用,进而能够很好地适应沙漠的高温、干旱等非生物胁迫环境[5]. ...
羽毛针禾(Stipagrostis pennata)根鞘中可培养细菌多样性
1
2016
... 近年来,经济发展、人口膨胀及环境污染等造成土壤干旱及土壤盐渍化现象日趋严重[1],干旱、高盐及高温等非生物胁迫会严重影响植物的生长和发育,降低农作物产量[2].新疆属于典型的干旱半干旱区,地形和气候复杂,也是中国沙漠化面积最大的区域[3],生态环境脆弱,沙漠化问题严重影响着农业生产和人们的生产生活[4].新疆特色沙漠固沙先锋植物羽毛针禾(Stipagrostis pennata)的根具有沙套结构,沙套对根系具有保水等作用,进而能够很好地适应沙漠的高温、干旱等非生物胁迫环境[5]. ...
Emerging roles of SWEET sugar transporters in plant development and abiotic stress responses
1
2022
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
Molecular control of cold acclimation in trees
1
2010
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
水稻糖基转移酶基因UGT2和UGT3参与非生物胁迫响应的机理研究
1
2022
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
Plant stress adaptations:making metabolism move
1
1998
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
Biochemical and structural characterization of thermostable gh159 glycoside hydrolases exhibiting α-l-arabinofuranosidase activity
1
2022
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
Response of the leaf cell wall to desiccation in the resurrection plant Myrothamnus flabellifolius
1
2006
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
Arabinose-rich polymers as an evolutionary strategy to plasticize resurrection plant cell walls against desiccation
1
2013
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
AtBXL1 encodes a bifunctional β-d-xylosidase/α-l-arabinofuranosidase required for pectic arabinan modification in Arabidopsis mucilage secretory cells
1
2009
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
一种黑曲霉α-L-阿拉伯呋喃糖苷酶克隆表达、性质分析和果汁澄清效果
1
2022
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
Production and properties of alpha-L-Arabinofuranosidase from Corticium rolfsii
2
1969
... 在逆境胁迫条件下,植物的一些关键基因、蛋白、糖类、抗氧化酶类和次生代谢物酶类在胁迫响应中发挥着重要作用[6].可溶性糖可作为渗透调节物质或者信号分子,提高植物在抗逆方面的作用[7],其含量与植物抗逆能力正相关,它的积累可提高细胞渗透浓度、降低水势,从而增强细胞的保水能力[8].非生物胁迫会影响细胞的稳定性,不同种类的糖可以直接作用在膜脂,还可以清除活性氧、保护细胞膜、降低细胞膜通透性[9],从而维持植物在胁迫条件下的正常生长.植物沙套的形成与多糖组分的黏液有关[10].Moore等[11]认为植物干旱响应可能与植物细胞壁中阿拉伯糖含量有关,富含阿拉伯糖的细胞壁更容易适应干旱环境.在干旱环境中,植物细胞壁发挥降低蒸腾作用、防止水分散失、调节细胞渗透压等作用.阿拉伯胶被认为是“增塑剂”,有助于保持植物细胞壁的柔韧性[12].单糖L‐阿拉伯糖是植物细胞壁中各种结构多糖元素和糖蛋白的组成部分,阿拉伯糖-阿拉伯糖和阿拉伯糖-纤维素相互作用的合力可能是细胞壁完整性的一个促成因素[13].阿拉伯呋喃糖苷酶(Alpha-L-Arabinofuranosidase ARAF)能够将未经还原的阿拉呋喃残基催化水解为果胶、半纤维素的同源阿拉伯聚糖、阿拉伯半乳糖、阿拉伯木聚糖等[14].ARAF可以催化提高从富含多糖的细胞壁基质中释放L-阿拉伯糖[15].在非生物胁迫下,ARAF表达量上调,从而提高细胞壁转化效率,促进糖的生成,从而维持植物在非生物胁迫下的生长. ...
... 选择处理后的羽毛针禾根为材料,提取总RNA及反转录cDNA,以羽毛针禾GAPDH、ELF、APR6作为内参基因.利用软件Premier 5.0设计SpARAF1引物(表1),引用内参基因GAPDH、ELF、APR6[15],参考SuperReal荧光定量预混试剂(SYBR Green)说明书,采用罗氏LightCycler 480实时荧光定量PCR仪扩增,体系10 μL:2×SuperReal PreMix Plus 5 μL、正向引物0.2 μL,反向引物0.2 μL,cDNA模板2.5 μL、RNase-free ddH2O 2.1 μL,扩增程序:95 ℃下预变性15 min,95 ℃下变性10 s,52 ℃下退火20 s,72 ℃下延伸20 s,循环40次,每个样3个重复,根据2-ΔΔCt方法[25]计算目的基因的相对表达量. ...
Two alpha-L-arabinofuranosidase genes in Arabidopsis thaliana are differentially expressed during vegetative growth and flower development
3
2003
... ARAF在植物应对逆境胁迫响应过程中发挥着重要作用,但相关的机制研究少有报道.目前对于羽毛针禾的研究主要在种群特性、生态适应性及根部微生物等方面[16],羽毛针禾的固沙作用可以有效地提高沙丘的稳定性,帮助更多的植物定居,增加植物多样性[17].在沙漠极端环境中羽毛针禾进化出多种适应沙漠环境的机制[18],根系和沙套结构的发达可提高水分吸收效率从而维持植物生长所需要的水分及微量元素[19].羽毛针禾具有抗旱能力强、耐高低温等优良性状,是极端环境中一种极好的抗旱基因的资源.沙套在植物对非生物胁迫的耐受性中起着关键作用,受到干旱胁迫的禾本科植物的沙套更厚、更稳定,可提高水分吸收效率[20-21].但从植物自身发育的角度解析沙套发育机制的相关研究较少.在前期工作基础上,本研究对SpARAF1的全长开放读码框序列进行克隆,并对其组织特异性表达和响应非生物胁迫的表达特征进行分析,为进一步解析SpARAF1在羽毛针禾沙套发育的功能及适应极端环境的机制提供参考. ...
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
... [16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
The effect of drought and heat stress on reproductive processes in cereals
1
2010
... ARAF在植物应对逆境胁迫响应过程中发挥着重要作用,但相关的机制研究少有报道.目前对于羽毛针禾的研究主要在种群特性、生态适应性及根部微生物等方面[16],羽毛针禾的固沙作用可以有效地提高沙丘的稳定性,帮助更多的植物定居,增加植物多样性[17].在沙漠极端环境中羽毛针禾进化出多种适应沙漠环境的机制[18],根系和沙套结构的发达可提高水分吸收效率从而维持植物生长所需要的水分及微量元素[19].羽毛针禾具有抗旱能力强、耐高低温等优良性状,是极端环境中一种极好的抗旱基因的资源.沙套在植物对非生物胁迫的耐受性中起着关键作用,受到干旱胁迫的禾本科植物的沙套更厚、更稳定,可提高水分吸收效率[20-21].但从植物自身发育的角度解析沙套发育机制的相关研究较少.在前期工作基础上,本研究对SpARAF1的全长开放读码框序列进行克隆,并对其组织特异性表达和响应非生物胁迫的表达特征进行分析,为进一步解析SpARAF1在羽毛针禾沙套发育的功能及适应极端环境的机制提供参考. ...
Rapidly evolving genetic features for desert adaptations in Stipagrostis pennata
1
2021
... ARAF在植物应对逆境胁迫响应过程中发挥着重要作用,但相关的机制研究少有报道.目前对于羽毛针禾的研究主要在种群特性、生态适应性及根部微生物等方面[16],羽毛针禾的固沙作用可以有效地提高沙丘的稳定性,帮助更多的植物定居,增加植物多样性[17].在沙漠极端环境中羽毛针禾进化出多种适应沙漠环境的机制[18],根系和沙套结构的发达可提高水分吸收效率从而维持植物生长所需要的水分及微量元素[19].羽毛针禾具有抗旱能力强、耐高低温等优良性状,是极端环境中一种极好的抗旱基因的资源.沙套在植物对非生物胁迫的耐受性中起着关键作用,受到干旱胁迫的禾本科植物的沙套更厚、更稳定,可提高水分吸收效率[20-21].但从植物自身发育的角度解析沙套发育机制的相关研究较少.在前期工作基础上,本研究对SpARAF1的全长开放读码框序列进行克隆,并对其组织特异性表达和响应非生物胁迫的表达特征进行分析,为进一步解析SpARAF1在羽毛针禾沙套发育的功能及适应极端环境的机制提供参考. ...
Plant tolerance to drought and salinity: stress regulating transcription factors and their functional significance in the cellular transcriptional network
1
2011
... ARAF在植物应对逆境胁迫响应过程中发挥着重要作用,但相关的机制研究少有报道.目前对于羽毛针禾的研究主要在种群特性、生态适应性及根部微生物等方面[16],羽毛针禾的固沙作用可以有效地提高沙丘的稳定性,帮助更多的植物定居,增加植物多样性[17].在沙漠极端环境中羽毛针禾进化出多种适应沙漠环境的机制[18],根系和沙套结构的发达可提高水分吸收效率从而维持植物生长所需要的水分及微量元素[19].羽毛针禾具有抗旱能力强、耐高低温等优良性状,是极端环境中一种极好的抗旱基因的资源.沙套在植物对非生物胁迫的耐受性中起着关键作用,受到干旱胁迫的禾本科植物的沙套更厚、更稳定,可提高水分吸收效率[20-21].但从植物自身发育的角度解析沙套发育机制的相关研究较少.在前期工作基础上,本研究对SpARAF1的全长开放读码框序列进行克隆,并对其组织特异性表达和响应非生物胁迫的表达特征进行分析,为进一步解析SpARAF1在羽毛针禾沙套发育的功能及适应极端环境的机制提供参考. ...
Plant roots redesign the rhizosphere to alter the three‐dimensional physical architecture and water dynamics
1
2018
... ARAF在植物应对逆境胁迫响应过程中发挥着重要作用,但相关的机制研究少有报道.目前对于羽毛针禾的研究主要在种群特性、生态适应性及根部微生物等方面[16],羽毛针禾的固沙作用可以有效地提高沙丘的稳定性,帮助更多的植物定居,增加植物多样性[17].在沙漠极端环境中羽毛针禾进化出多种适应沙漠环境的机制[18],根系和沙套结构的发达可提高水分吸收效率从而维持植物生长所需要的水分及微量元素[19].羽毛针禾具有抗旱能力强、耐高低温等优良性状,是极端环境中一种极好的抗旱基因的资源.沙套在植物对非生物胁迫的耐受性中起着关键作用,受到干旱胁迫的禾本科植物的沙套更厚、更稳定,可提高水分吸收效率[20-21].但从植物自身发育的角度解析沙套发育机制的相关研究较少.在前期工作基础上,本研究对SpARAF1的全长开放读码框序列进行克隆,并对其组织特异性表达和响应非生物胁迫的表达特征进行分析,为进一步解析SpARAF1在羽毛针禾沙套发育的功能及适应极端环境的机制提供参考. ...
Formation and stabilization of rhizosheaths of Zea mays L.(Effect of soil water content)
1
1994
... ARAF在植物应对逆境胁迫响应过程中发挥着重要作用,但相关的机制研究少有报道.目前对于羽毛针禾的研究主要在种群特性、生态适应性及根部微生物等方面[16],羽毛针禾的固沙作用可以有效地提高沙丘的稳定性,帮助更多的植物定居,增加植物多样性[17].在沙漠极端环境中羽毛针禾进化出多种适应沙漠环境的机制[18],根系和沙套结构的发达可提高水分吸收效率从而维持植物生长所需要的水分及微量元素[19].羽毛针禾具有抗旱能力强、耐高低温等优良性状,是极端环境中一种极好的抗旱基因的资源.沙套在植物对非生物胁迫的耐受性中起着关键作用,受到干旱胁迫的禾本科植物的沙套更厚、更稳定,可提高水分吸收效率[20-21].但从植物自身发育的角度解析沙套发育机制的相关研究较少.在前期工作基础上,本研究对SpARAF1的全长开放读码框序列进行克隆,并对其组织特异性表达和响应非生物胁迫的表达特征进行分析,为进一步解析SpARAF1在羽毛针禾沙套发育的功能及适应极端环境的机制提供参考. ...
沙漠植物羽毛针禾(Stipagrostis pennata)糖转运蛋白基因SpSWEET3的克隆与表达
1
2023
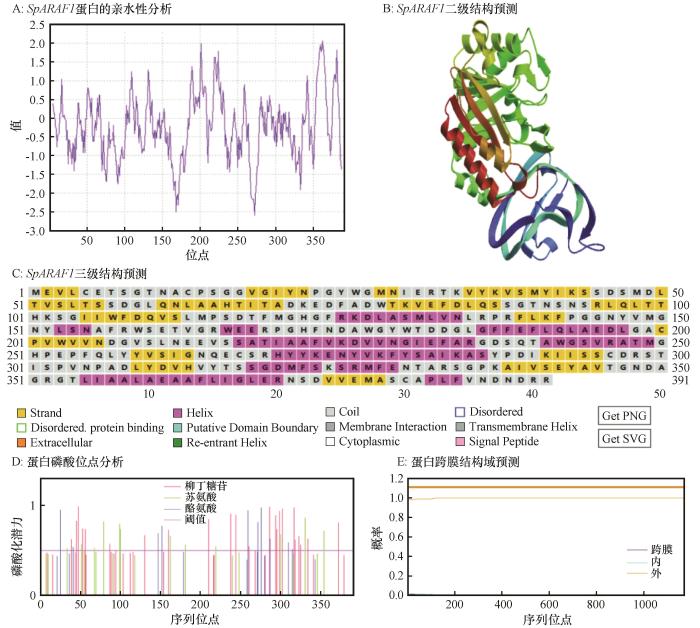
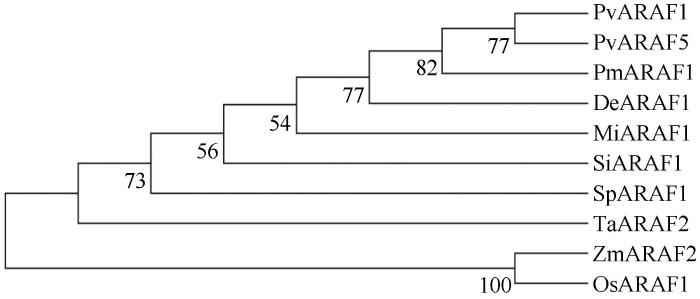
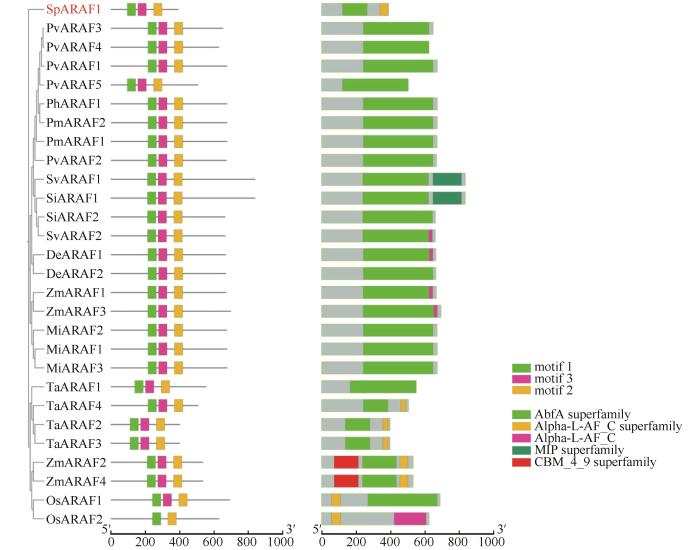
... 应用NCBI 的在线ORF finder工具对SpARAF1基因进行蛋白翻译后,推导氨基酸序列.运用ExPSAy在线服务器中的ProtParam (http://web.expasy.org/protparam)软件分析SpARAF1编码蛋白质的理化性质;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat. plpage=npsa_sopma.html)在线软件分析预测蛋白质二级结构;使用SWISS-MODEL(https:// swissmodel.expasy.org/interactive)在线预测蛋白质三级结构;应用ProtScale (http://web.expasy.org/prots-cale/)对该蛋白的亲水性进行预测分析[22];利用TMHMM Server 2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0)进行蛋白质序列跨膜结构域分析;使用Signal P 5.0 server(http://www.cbs.dtu.dk/services/SignalP)分析蛋白信号肽[23];PSORT (http://psort.hgc.jp/)预测蛋白质亚细胞定位;运用TBtools进行进化及保守域分析,通过MEGA 7.0构建Neighbor-joining系统进化树[24]. ...
异子蓬SabHLH169基因的克隆及抗旱功能分析
1
2023
... 应用NCBI 的在线ORF finder工具对SpARAF1基因进行蛋白翻译后,推导氨基酸序列.运用ExPSAy在线服务器中的ProtParam (http://web.expasy.org/protparam)软件分析SpARAF1编码蛋白质的理化性质;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat. plpage=npsa_sopma.html)在线软件分析预测蛋白质二级结构;使用SWISS-MODEL(https:// swissmodel.expasy.org/interactive)在线预测蛋白质三级结构;应用ProtScale (http://web.expasy.org/prots-cale/)对该蛋白的亲水性进行预测分析[22];利用TMHMM Server 2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0)进行蛋白质序列跨膜结构域分析;使用Signal P 5.0 server(http://www.cbs.dtu.dk/services/SignalP)分析蛋白信号肽[23];PSORT (http://psort.hgc.jp/)预测蛋白质亚细胞定位;运用TBtools进行进化及保守域分析,通过MEGA 7.0构建Neighbor-joining系统进化树[24]. ...
大蒜AsMKK5基因克隆及其在渗透胁迫下的表达分析
1
2023
... 应用NCBI 的在线ORF finder工具对SpARAF1基因进行蛋白翻译后,推导氨基酸序列.运用ExPSAy在线服务器中的ProtParam (http://web.expasy.org/protparam)软件分析SpARAF1编码蛋白质的理化性质;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat. plpage=npsa_sopma.html)在线软件分析预测蛋白质二级结构;使用SWISS-MODEL(https:// swissmodel.expasy.org/interactive)在线预测蛋白质三级结构;应用ProtScale (http://web.expasy.org/prots-cale/)对该蛋白的亲水性进行预测分析[22];利用TMHMM Server 2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0)进行蛋白质序列跨膜结构域分析;使用Signal P 5.0 server(http://www.cbs.dtu.dk/services/SignalP)分析蛋白信号肽[23];PSORT (http://psort.hgc.jp/)预测蛋白质亚细胞定位;运用TBtools进行进化及保守域分析,通过MEGA 7.0构建Neighbor-joining系统进化树[24]. ...
Selection of the reference genes for quantitative gene expression by RT-qPCR in the desert plant Stipagrostis pennata
2
2021
... 选择处理后的羽毛针禾根为材料,提取总RNA及反转录cDNA,以羽毛针禾GAPDH、ELF、APR6作为内参基因.利用软件Premier 5.0设计SpARAF1引物(表1),引用内参基因GAPDH、ELF、APR6[15],参考SuperReal荧光定量预混试剂(SYBR Green)说明书,采用罗氏LightCycler 480实时荧光定量PCR仪扩增,体系10 μL:2×SuperReal PreMix Plus 5 μL、正向引物0.2 μL,反向引物0.2 μL,cDNA模板2.5 μL、RNase-free ddH2O 2.1 μL,扩增程序:95 ℃下预变性15 min,95 ℃下变性10 s,52 ℃下退火20 s,72 ℃下延伸20 s,循环40次,每个样3个重复,根据2-ΔΔCt方法[25]计算目的基因的相对表达量. ...
... 植物在生长发育过程中常常面临许多非生物胁迫环境[26].细胞壁作为细胞与外界环境的边界,能够感知非生物胁迫并将胁迫信号传递到质膜,引起细胞质中钙离子、活性氧信号和脱落酸等激素水平的变化以及相关蛋白磷酸化,以及通过转录和翻译水平调控细胞壁各组分合成酶基因表达来适应非生物胁迫[27].糖在胁迫感知和信号传递中发挥着重要作用,是胁迫基因表达的调节中枢,确保渗透调节、清除ROS的反应,并通过碳分配维持细胞的能量状态[28].糖转运蛋白通过调节碳水化合物的分配,参与和感知生物与非生物胁迫的关键信号传导[29].植物的沙套结构对于沙漠极端环境适应具有重要作用[30],我们前期发现羽毛针禾沙套的形成与糖密切相关[31],克隆获得一个羽毛针禾糖转运蛋白基因SWEET,该基因的表达与非生物胁迫密切相关[25].本研究获得一个编码α-L-阿拉伯呋喃糖苷酶基因SpARAF1,该基因具有典型的Alpha-L-AF-C和AbfA结构域,可能在糖代谢过程中发挥重要作用. ...
植物细胞壁形成及在非生物胁迫中的作用
1
2023
... 植物在生长发育过程中常常面临许多非生物胁迫环境[26].细胞壁作为细胞与外界环境的边界,能够感知非生物胁迫并将胁迫信号传递到质膜,引起细胞质中钙离子、活性氧信号和脱落酸等激素水平的变化以及相关蛋白磷酸化,以及通过转录和翻译水平调控细胞壁各组分合成酶基因表达来适应非生物胁迫[27].糖在胁迫感知和信号传递中发挥着重要作用,是胁迫基因表达的调节中枢,确保渗透调节、清除ROS的反应,并通过碳分配维持细胞的能量状态[28].糖转运蛋白通过调节碳水化合物的分配,参与和感知生物与非生物胁迫的关键信号传导[29].植物的沙套结构对于沙漠极端环境适应具有重要作用[30],我们前期发现羽毛针禾沙套的形成与糖密切相关[31],克隆获得一个羽毛针禾糖转运蛋白基因SWEET,该基因的表达与非生物胁迫密切相关[25].本研究获得一个编码α-L-阿拉伯呋喃糖苷酶基因SpARAF1,该基因具有典型的Alpha-L-AF-C和AbfA结构域,可能在糖代谢过程中发挥重要作用. ...
Na+/H+逆向转运蛋白在植物应答非生物逆境胁迫中的作用
1
2022
... 植物在生长发育过程中常常面临许多非生物胁迫环境[26].细胞壁作为细胞与外界环境的边界,能够感知非生物胁迫并将胁迫信号传递到质膜,引起细胞质中钙离子、活性氧信号和脱落酸等激素水平的变化以及相关蛋白磷酸化,以及通过转录和翻译水平调控细胞壁各组分合成酶基因表达来适应非生物胁迫[27].糖在胁迫感知和信号传递中发挥着重要作用,是胁迫基因表达的调节中枢,确保渗透调节、清除ROS的反应,并通过碳分配维持细胞的能量状态[28].糖转运蛋白通过调节碳水化合物的分配,参与和感知生物与非生物胁迫的关键信号传导[29].植物的沙套结构对于沙漠极端环境适应具有重要作用[30],我们前期发现羽毛针禾沙套的形成与糖密切相关[31],克隆获得一个羽毛针禾糖转运蛋白基因SWEET,该基因的表达与非生物胁迫密切相关[25].本研究获得一个编码α-L-阿拉伯呋喃糖苷酶基因SpARAF1,该基因具有典型的Alpha-L-AF-C和AbfA结构域,可能在糖代谢过程中发挥重要作用. ...
Disruption of the sugar transporters AtSWEET11 and AtSWEET12 affects vascular development and freezing tolerance in Arabidopsis
1
2015
... 植物在生长发育过程中常常面临许多非生物胁迫环境[26].细胞壁作为细胞与外界环境的边界,能够感知非生物胁迫并将胁迫信号传递到质膜,引起细胞质中钙离子、活性氧信号和脱落酸等激素水平的变化以及相关蛋白磷酸化,以及通过转录和翻译水平调控细胞壁各组分合成酶基因表达来适应非生物胁迫[27].糖在胁迫感知和信号传递中发挥着重要作用,是胁迫基因表达的调节中枢,确保渗透调节、清除ROS的反应,并通过碳分配维持细胞的能量状态[28].糖转运蛋白通过调节碳水化合物的分配,参与和感知生物与非生物胁迫的关键信号传导[29].植物的沙套结构对于沙漠极端环境适应具有重要作用[30],我们前期发现羽毛针禾沙套的形成与糖密切相关[31],克隆获得一个羽毛针禾糖转运蛋白基因SWEET,该基因的表达与非生物胁迫密切相关[25].本研究获得一个编码α-L-阿拉伯呋喃糖苷酶基因SpARAF1,该基因具有典型的Alpha-L-AF-C和AbfA结构域,可能在糖代谢过程中发挥重要作用. ...
大蒜糖转运蛋白基因AsSWEET14克隆与胁迫表达分析
1
2023
... 植物在生长发育过程中常常面临许多非生物胁迫环境[26].细胞壁作为细胞与外界环境的边界,能够感知非生物胁迫并将胁迫信号传递到质膜,引起细胞质中钙离子、活性氧信号和脱落酸等激素水平的变化以及相关蛋白磷酸化,以及通过转录和翻译水平调控细胞壁各组分合成酶基因表达来适应非生物胁迫[27].糖在胁迫感知和信号传递中发挥着重要作用,是胁迫基因表达的调节中枢,确保渗透调节、清除ROS的反应,并通过碳分配维持细胞的能量状态[28].糖转运蛋白通过调节碳水化合物的分配,参与和感知生物与非生物胁迫的关键信号传导[29].植物的沙套结构对于沙漠极端环境适应具有重要作用[30],我们前期发现羽毛针禾沙套的形成与糖密切相关[31],克隆获得一个羽毛针禾糖转运蛋白基因SWEET,该基因的表达与非生物胁迫密切相关[25].本研究获得一个编码α-L-阿拉伯呋喃糖苷酶基因SpARAF1,该基因具有典型的Alpha-L-AF-C和AbfA结构域,可能在糖代谢过程中发挥重要作用. ...
植物SWEET基因家族结构、功能及调控研究进展
1
2017
... 植物在生长发育过程中常常面临许多非生物胁迫环境[26].细胞壁作为细胞与外界环境的边界,能够感知非生物胁迫并将胁迫信号传递到质膜,引起细胞质中钙离子、活性氧信号和脱落酸等激素水平的变化以及相关蛋白磷酸化,以及通过转录和翻译水平调控细胞壁各组分合成酶基因表达来适应非生物胁迫[27].糖在胁迫感知和信号传递中发挥着重要作用,是胁迫基因表达的调节中枢,确保渗透调节、清除ROS的反应,并通过碳分配维持细胞的能量状态[28].糖转运蛋白通过调节碳水化合物的分配,参与和感知生物与非生物胁迫的关键信号传导[29].植物的沙套结构对于沙漠极端环境适应具有重要作用[30],我们前期发现羽毛针禾沙套的形成与糖密切相关[31],克隆获得一个羽毛针禾糖转运蛋白基因SWEET,该基因的表达与非生物胁迫密切相关[25].本研究获得一个编码α-L-阿拉伯呋喃糖苷酶基因SpARAF1,该基因具有典型的Alpha-L-AF-C和AbfA结构域,可能在糖代谢过程中发挥重要作用. ...
1
... 植物在生长发育过程中常常面临许多非生物胁迫环境[26].细胞壁作为细胞与外界环境的边界,能够感知非生物胁迫并将胁迫信号传递到质膜,引起细胞质中钙离子、活性氧信号和脱落酸等激素水平的变化以及相关蛋白磷酸化,以及通过转录和翻译水平调控细胞壁各组分合成酶基因表达来适应非生物胁迫[27].糖在胁迫感知和信号传递中发挥着重要作用,是胁迫基因表达的调节中枢,确保渗透调节、清除ROS的反应,并通过碳分配维持细胞的能量状态[28].糖转运蛋白通过调节碳水化合物的分配,参与和感知生物与非生物胁迫的关键信号传导[29].植物的沙套结构对于沙漠极端环境适应具有重要作用[30],我们前期发现羽毛针禾沙套的形成与糖密切相关[31],克隆获得一个羽毛针禾糖转运蛋白基因SWEET,该基因的表达与非生物胁迫密切相关[25].本研究获得一个编码α-L-阿拉伯呋喃糖苷酶基因SpARAF1,该基因具有典型的Alpha-L-AF-C和AbfA结构域,可能在糖代谢过程中发挥重要作用. ...
Effect of drought stress on sugar metabolism in leaves and roots of soybean seedlings
1
2020
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
Cell wall modifications in Arabidopsis plants with altered alpha-L-arabinofuranosidase activity
1
2008
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
Cloning,expression,and characterization of a thermostable GH51 α-L-arabinofuranosidase from Paenibacillus sp.DG-22
1
2014
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
An alpha-L-arabinofuranosidase/beta-D-xylosidase from immature seeds of radish (Raphanus sativus L.)
1
2006
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
Protein subcellular localization prediction
1
2021
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
Gibberellic acid,synthetic auxins,and ethylene differentially modulate alpha-L-Arabinofuranosidase activities in antisense 1-aminocyclopropane-1-carboxylic acid synthase tomato pericarp discs
1
2002
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
Side chains of pectic polysaccharides are regulated in relation to cell proliferation and cell differentiation
1
1999
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
Characteristics of α-L-arabinofuranosidase from Streptomyces sp I10-1 for production of L-arabinose from corn hull arabinoxylan
1
2014
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...
Hydrolysis of wheat flour arabinoxylan,acid-debranched wheat flour arabinoxylan and arabino-xylo-oligosaccharides by β-xylanase,α-L-arabinofuranosidase and β-xylosidase
1
2015
... α-L-阿拉伯呋喃糖苷酶能够通过提高植物的抗氧化能力进而增强其抗旱性以及植物根系发育[32].复活植物中α-L-阿拉伯呋喃糖苷酶的表达水平高约占水解细胞壁组分的35%~40%,表明了ARAF在干旱响应过程中的重要作用[33].基因的亚细胞定位可以揭示细胞内各种结构和分子的功能以及在细胞内的相互作用.拟南芥中两个编码ARAF的基因(AtASD_1和AtASD_2)定位于细胞壁,对多糖的分解与代谢起关键作用[16].阿拉伯糖的聚合物是植物细胞壁的主要成分,富含阿拉伯糖的聚合物作为一种进化策略,可以塑化复活植物细胞壁以防止干燥.葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan,GAX)、果胶阿拉伯糖(L-arabinose)和阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGP)可以通过增强细胞壁的柔韧性来提高植物的干旱耐受性[34],另外,SpARAF1在拟南芥细胞增殖区以及组织的衰老和脱落区表达[16],同时参与未成熟萝卜种子中阿拉伯半乳聚糖蛋白的碳水化合物部分的水解,通过细胞壁的变化在果实成熟和软化过程中发挥重要作用[35].本研究中,SpARAF1基因在根组织中表现出最显著的累积表达,表明该基因与根及根部沙套发育之间存在密切联系.同时,羽毛针禾SpARAF1基因编码α-L-阿拉伯呋喃糖苷酶,在干旱、盐、高温胁迫下受到显著的诱导表达,另外,羽毛针禾SpARAF1基因编码的蛋白质定位在细胞壁.这些结果都说明了该基因很有可能通过影响细胞壁的结构与组分变化来提高植物对应非生物胁迫的耐受性.关于植物α-L-阿拉伯呋喃糖苷酶基因的功能及调控机制鲜有报道[36].大麦α-L-阿拉伯呋喃糖苷酶在谷物萌发过程中介导了阿拉伯木聚糖的代谢[37],推测在细胞生长过程中通过改变细胞壁的阿拉伯木聚糖组分促进谷物的萌发[38].番茄中存在3种a-L-阿拉伯呋喃糖苷酶同工酶[39],免疫分析显示这些同工酶与植物激素赤霉素和乙烯信号密切相关[40].那么羽毛针禾SpARAF1蛋白是否参与了植物激素的信号调控,是否通过与植物激素之间的调控来提高植物对抗逆境的能力的?这些都值得进一步地研究. ...








 甘公网安备 62010202000688号
甘公网安备 62010202000688号