What is a biocrust?A refined,contemporary definition for a broadening research community
1
2022
... 生物土壤结皮(BSCs)是由蓝绿藻、苔藓、地衣、真菌以及其他非维管束植物成分,通过菌丝、假根和分泌物等与土壤表层颗粒胶结形成的具有代谢活性的复合体[1].结皮依据表层优势光自养生物体类型被划分为藻类结皮、地衣结皮和苔藓结皮[2].在结皮演替初期,蓝藻、绿藻及其他真核藻类率先占领生境,在土壤表面形成一层灰黑色、生物量较低的复合体,即藻类结皮[3-4];地衣结皮是自养型藻类和异养型菌类组成的复合生物体;苔藓结皮则是以藓类植物为优势种的结皮类型,属于结皮演替的高级阶段,多呈绿色、棕色或棕红色,呈丛生垫状[3-4].结皮发生和演替基本遵循从简单到复杂、从低等到高等的自然规律,但在环境条件较为优越的特定条件下,也可能出现超越某个中间阶段而直接发展为更高级演替阶段的现象[4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
生物土壤结皮研究:进展、前沿与展望
1
2009
... 生物土壤结皮(BSCs)是由蓝绿藻、苔藓、地衣、真菌以及其他非维管束植物成分,通过菌丝、假根和分泌物等与土壤表层颗粒胶结形成的具有代谢活性的复合体[1].结皮依据表层优势光自养生物体类型被划分为藻类结皮、地衣结皮和苔藓结皮[2].在结皮演替初期,蓝藻、绿藻及其他真核藻类率先占领生境,在土壤表面形成一层灰黑色、生物量较低的复合体,即藻类结皮[3-4];地衣结皮是自养型藻类和异养型菌类组成的复合生物体;苔藓结皮则是以藓类植物为优势种的结皮类型,属于结皮演替的高级阶段,多呈绿色、棕色或棕红色,呈丛生垫状[3-4].结皮发生和演替基本遵循从简单到复杂、从低等到高等的自然规律,但在环境条件较为优越的特定条件下,也可能出现超越某个中间阶段而直接发展为更高级演替阶段的现象[4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
A review on effects of biological soil crusts on hydrological processes
2
2023
... 生物土壤结皮(BSCs)是由蓝绿藻、苔藓、地衣、真菌以及其他非维管束植物成分,通过菌丝、假根和分泌物等与土壤表层颗粒胶结形成的具有代谢活性的复合体[1].结皮依据表层优势光自养生物体类型被划分为藻类结皮、地衣结皮和苔藓结皮[2].在结皮演替初期,蓝藻、绿藻及其他真核藻类率先占领生境,在土壤表面形成一层灰黑色、生物量较低的复合体,即藻类结皮[3-4];地衣结皮是自养型藻类和异养型菌类组成的复合生物体;苔藓结皮则是以藓类植物为优势种的结皮类型,属于结皮演替的高级阶段,多呈绿色、棕色或棕红色,呈丛生垫状[3-4].结皮发生和演替基本遵循从简单到复杂、从低等到高等的自然规律,但在环境条件较为优越的特定条件下,也可能出现超越某个中间阶段而直接发展为更高级演替阶段的现象[4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
... [3-4].结皮发生和演替基本遵循从简单到复杂、从低等到高等的自然规律,但在环境条件较为优越的特定条件下,也可能出现超越某个中间阶段而直接发展为更高级演替阶段的现象[4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
荒漠地表生物土壤结皮形成与演替特征概述
3
2010
... 生物土壤结皮(BSCs)是由蓝绿藻、苔藓、地衣、真菌以及其他非维管束植物成分,通过菌丝、假根和分泌物等与土壤表层颗粒胶结形成的具有代谢活性的复合体[1].结皮依据表层优势光自养生物体类型被划分为藻类结皮、地衣结皮和苔藓结皮[2].在结皮演替初期,蓝藻、绿藻及其他真核藻类率先占领生境,在土壤表面形成一层灰黑色、生物量较低的复合体,即藻类结皮[3-4];地衣结皮是自养型藻类和异养型菌类组成的复合生物体;苔藓结皮则是以藓类植物为优势种的结皮类型,属于结皮演替的高级阶段,多呈绿色、棕色或棕红色,呈丛生垫状[3-4].结皮发生和演替基本遵循从简单到复杂、从低等到高等的自然规律,但在环境条件较为优越的特定条件下,也可能出现超越某个中间阶段而直接发展为更高级演替阶段的现象[4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
... -4].结皮发生和演替基本遵循从简单到复杂、从低等到高等的自然规律,但在环境条件较为优越的特定条件下,也可能出现超越某个中间阶段而直接发展为更高级演替阶段的现象[4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
... [4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
1
2012
... 生物土壤结皮(BSCs)是由蓝绿藻、苔藓、地衣、真菌以及其他非维管束植物成分,通过菌丝、假根和分泌物等与土壤表层颗粒胶结形成的具有代谢活性的复合体[1].结皮依据表层优势光自养生物体类型被划分为藻类结皮、地衣结皮和苔藓结皮[2].在结皮演替初期,蓝藻、绿藻及其他真核藻类率先占领生境,在土壤表面形成一层灰黑色、生物量较低的复合体,即藻类结皮[3-4];地衣结皮是自养型藻类和异养型菌类组成的复合生物体;苔藓结皮则是以藓类植物为优势种的结皮类型,属于结皮演替的高级阶段,多呈绿色、棕色或棕红色,呈丛生垫状[3-4].结皮发生和演替基本遵循从简单到复杂、从低等到高等的自然规律,但在环境条件较为优越的特定条件下,也可能出现超越某个中间阶段而直接发展为更高级演替阶段的现象[4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
黄土高原退耕草地土壤有机碳固存对放牧干扰的响应及机制
1
2023
... 生物土壤结皮(BSCs)是由蓝绿藻、苔藓、地衣、真菌以及其他非维管束植物成分,通过菌丝、假根和分泌物等与土壤表层颗粒胶结形成的具有代谢活性的复合体[1].结皮依据表层优势光自养生物体类型被划分为藻类结皮、地衣结皮和苔藓结皮[2].在结皮演替初期,蓝藻、绿藻及其他真核藻类率先占领生境,在土壤表面形成一层灰黑色、生物量较低的复合体,即藻类结皮[3-4];地衣结皮是自养型藻类和异养型菌类组成的复合生物体;苔藓结皮则是以藓类植物为优势种的结皮类型,属于结皮演替的高级阶段,多呈绿色、棕色或棕红色,呈丛生垫状[3-4].结皮发生和演替基本遵循从简单到复杂、从低等到高等的自然规律,但在环境条件较为优越的特定条件下,也可能出现超越某个中间阶段而直接发展为更高级演替阶段的现象[4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
干旱荒漠区不同藓结皮斑块碳通量对降雨量变化的响应
2023
高寒沙区生物土壤结皮-土壤系统碳收支对模拟增温的响应
13
2020
... 生物土壤结皮(BSCs)是由蓝绿藻、苔藓、地衣、真菌以及其他非维管束植物成分,通过菌丝、假根和分泌物等与土壤表层颗粒胶结形成的具有代谢活性的复合体[1].结皮依据表层优势光自养生物体类型被划分为藻类结皮、地衣结皮和苔藓结皮[2].在结皮演替初期,蓝藻、绿藻及其他真核藻类率先占领生境,在土壤表面形成一层灰黑色、生物量较低的复合体,即藻类结皮[3-4];地衣结皮是自养型藻类和异养型菌类组成的复合生物体;苔藓结皮则是以藓类植物为优势种的结皮类型,属于结皮演替的高级阶段,多呈绿色、棕色或棕红色,呈丛生垫状[3-4].结皮发生和演替基本遵循从简单到复杂、从低等到高等的自然规律,但在环境条件较为优越的特定条件下,也可能出现超越某个中间阶段而直接发展为更高级演替阶段的现象[4].在高寒干旱高温的极端环境,生物土壤结皮因较强的适应能力取代了维管植物,成为地表活体覆盖的优势种群.干旱少雨的荒漠地区,生物土壤结皮分布极为广泛,分布面积可占到地表活体覆盖的40%,在部分区域甚至可达70%[5].作为极端环境生态系统的关键组成部分,结皮在生态系统的能量流动和物质循环中扮演着重要角色.结皮中的自养生物,如蓝藻、地衣、绿藻和苔藓等,能够通过光合作用固定大气中的CO2,而细菌、真菌等异养组分则通过分解作用进行呼吸碳排放.因此,结皮参与了结皮土壤系统与大气间碳交换(图1).近年来,众多研究从微观、区域以及全球尺度,探究了极端环境下结皮碳循环过程及其对土壤-大气碳交换的影响,剖析了结皮及结皮土壤系统碳循环过程对环境变化的响应机制.多数研究结果表明,降水和温度是影响结皮及结皮土壤系统碳循环过程的关键因素[6-8]. ...
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮对区域碳排放的影响机制主要有3方面:①结皮中细菌、真菌等微生物组分通过呼吸作用释放CO2,增加土壤呼吸碳排放;②结皮发育堵塞土壤孔隙,减少土壤与大气之间的CO2交换,抑制土壤呼吸碳排放[33-34];③结皮发育改变下层土壤的温度和水分等环境条件,间接影响土壤呼吸碳排放[35].结皮发育对土壤碳排放速率的影响取决于多种机制的综合作用.当促进机制超过阻碍机制时,结皮发育促进土壤碳排放速率,反之则抑制.多项研究结果表明,结皮发育对极端环境土壤碳排放的影响表现出明显的地域性差异[8,11,25,36](表3). ...
... /(μmol·m
-2·s
-1)
结皮发育对土壤 碳排放速率 的影响 | 参考 文献 | | 共和盆地 | 藻结皮 | — | 0.43~1.53 | 0.49~2.36 | 促进 | [8] |
| 苔藓结皮 | — | 0.43~1.53 | 0.59~3.13 | 促进 | [8] |
| 黄土高原 | 苔藓结皮 | 极地真藓(Bryum arcticum)、土生扭口藓(Barbula vinealis) | 1.45~2.01 | 1.19~1.66 | 抑制 | [25] |
| 毛乌素沙地 | 藻结皮 | — | 0.50~1.55 | 0.57~1.66 | 促进 | [11] |
| 苔藓结皮 | — | 0.50~1.55 | 0.86~1.95 | 促进 | [11] |
| 科尔沁沙地 | 藻结皮、苔藓结皮 | 蓝藻、真藓 | 0.45~12.35 | 0.40~4.86 | 抑制 | [36] |
结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... [
8]
| 黄土高原 | 苔藓结皮 | 极地真藓(Bryum arcticum)、土生扭口藓(Barbula vinealis) | 1.45~2.01 | 1.19~1.66 | 抑制 | [25] |
| 毛乌素沙地 | 藻结皮 | — | 0.50~1.55 | 0.57~1.66 | 促进 | [11] |
| 苔藓结皮 | — | 0.50~1.55 | 0.86~1.95 | 促进 | [11] |
| 科尔沁沙地 | 藻结皮、苔藓结皮 | 蓝藻、真藓 | 0.45~12.35 | 0.40~4.86 | 抑制 | [36] |
结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... 研究表明,结皮发育普遍提高了土壤呼吸碳排放量,但其促进效果存在明显的区域分异[42,55].例如,腾格里沙漠的藻类、苔藓和混生结皮发育后,结皮土壤系统碳排放量分别为60.98~121.41、112.77~145.40、81.67~97.24 g·m-2·a-1,较裸土(70.10~82.15 g·m-2·a-1)增加了19.8%~69.6%[34].而共和盆地的藻类和苔藓结皮发育后,结皮土壤系统碳排放量分别为79.36~236.80、120.26~385.88 g·m-2·a-1,较裸土(60~140 g·m-2·a-1)增加了58.1%~153.1%[8].土壤呼吸碳排放对结皮发育的差异化响应主要在于区域间环境条件的差异.腾格里沙漠的结皮因降水匮乏(年降水量仅186 mm)处于长期干燥失活状态,生理活动被长期抑制.高寒沙区的结皮因降水相对充沛(年降水量为246 mm),维持生理活性的时间更长,内部微生物活动更为频繁,使得其对土壤呼吸性碳排放的促进效果更为明显. ...
... 结皮发育能否改变生态系统的碳收支是研究学者关注的热点.净碳通量是碳排放和光合固碳之间的净差值,是表征区域生态系统碳源汇的关键指标.通常情况下,净碳通量正值表示结皮土壤系统呼吸大于光合,表现为碳源;负值表示光合大于呼吸,表现为碳汇.自然状态下极端环境结皮土壤系统净碳通量为-10.02~5.30 μmol·m-2·s-1[8,10,22,56-57](表4),且存在明显区域间差异.此外,同一区域不同类型结皮土壤系统净碳通量并未表现出明显差异,这是因为相较于低级演替阶段的藻类结皮,苔藓结皮光合固碳能力及呼吸碳排放能力均更强,但其光合固定碳与呼吸排放碳相互抵消,使得苔藓结皮土壤系统净碳通量与藻类无明显差异[41]. ...
... /(μmol·m
-2·s
-1)
参考文献 | | 纳米比亚沙漠 | 地衣结皮 | 荒漠微孢衣 | -10.02~3.01 | [22] |
| 橙衣属 | -7.25~1.88 | [22] |
| 小网衣属 | -6.21~1.02 | [22] |
| 古尔班通古特沙漠 | 苔藓结皮 | — | -0.28~1.18 | [56] |
| 藻结皮、地衣结皮 | — | -0.18~1.20 | [56] |
| 共和盆地 | 藻结皮 | — | -0.01~4.83 | [8] |
| 苔藓结皮 | — | 0.20~5.10 | [8] |
| 毛乌素沙地 | 藻结皮 | — | -0.18~1.43 | [57] |
| 苔藓结皮 | — | -1.24~1.38 | [57] |
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... [
8]
| 毛乌素沙地 | 藻结皮 | — | -0.18~1.43 | [57] |
| 苔藓结皮 | — | -1.24~1.38 | [57] |
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... 降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... 结皮发育对极端环境生态系统碳源汇的长期效应已得到了深入研究.多数研究表明,结皮发育促进了生态系统的长期碳源效应,且促进效果存在明显区域分异.例如,古尔班通古特沙漠的藻类、苔藓结皮发育后,结皮土壤系统净碳通量分别为23.1~48.2、30.0~48.5 g·m-2·a-1,较裸土(10~45 g·m-2·a-1)增加了29.6%~42.7%[56].共和盆地以苔藓、藻类为优势种的结皮发育后,结皮土壤系统净碳通量分别为117~354、75.2~208 g·m-2·a-1,较裸土(75~130 g·m-2·a-1)增加了38.1%~129.8%[8].与古尔班通古特沙漠相比,降水较为充沛的高寒沙区,结皮发育后对生态系统碳源的促进效应更为显著.尽管古尔班通古特沙漠的年平均温度(7.3 ℃)高于共和盆地(2.4 ℃),但受当地降水条件的制约,增温对结皮土壤系统碳源效应的促进作用受到抑制.类似的科罗拉多高原的研究表明,自然状态下,结皮土壤系统净碳通量为47 g·m-2·a-1,而在增温和增雨后,结皮土壤系统净碳通量增加到69~87 g·m-2·a-1,证实了增雨及增温条件对结皮土壤系统乃至区域生态环境碳源效应的促进作用[61]. ...
Soil moisture content dominates the photosynthesis of C3 and C4 plants in a desert steppe after long-term warming and increasing precipitation
1
2023
... 光合固碳速率是衡量光合作用强度的重要指标,反映结皮光合固碳的活跃程度.研究表明极端环境发育的结皮光合固碳速率为0.05~8.28 μmol·m-2·s-1(表1),最高值与荒漠草原维管植物相当[9].不同类型结皮光合固碳速率存在明显差异,以苔藓为优势种的高级演替阶段结皮光合固碳速率是以藻类为优势种的初级演替阶段结皮的2~7倍,这一差异与结皮叶绿素含量密切相关[10-12].藻类结皮叶绿素含量通常小于200 mg·m-2[13],而苔藓结皮叶绿素含量高达805 mg·m-2[14].较高的叶绿素含量赋予苔藓结皮更强的光捕获能力和光合活性,使其光利用效率明显优于藻类结皮.随着结皮光合固碳速率测量方法不断优化,早期研究人员多将结皮从土壤表面剥离后进行室内测定,而现今研究学者多采用原位观测.不同观测方法测定结果在数量级上大致相当(表1)[15-19]. ...
黄土高原不同侵蚀区生物结皮对土壤CO2通量的影响
5
2013
... 光合固碳速率是衡量光合作用强度的重要指标,反映结皮光合固碳的活跃程度.研究表明极端环境发育的结皮光合固碳速率为0.05~8.28 μmol·m-2·s-1(表1),最高值与荒漠草原维管植物相当[9].不同类型结皮光合固碳速率存在明显差异,以苔藓为优势种的高级演替阶段结皮光合固碳速率是以藻类为优势种的初级演替阶段结皮的2~7倍,这一差异与结皮叶绿素含量密切相关[10-12].藻类结皮叶绿素含量通常小于200 mg·m-2[13],而苔藓结皮叶绿素含量高达805 mg·m-2[14].较高的叶绿素含量赋予苔藓结皮更强的光捕获能力和光合活性,使其光利用效率明显优于藻类结皮.随着结皮光合固碳速率测量方法不断优化,早期研究人员多将结皮从土壤表面剥离后进行室内测定,而现今研究学者多采用原位观测.不同观测方法测定结果在数量级上大致相当(表1)[15-19]. ...
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮发育能否改变生态系统的碳收支是研究学者关注的热点.净碳通量是碳排放和光合固碳之间的净差值,是表征区域生态系统碳源汇的关键指标.通常情况下,净碳通量正值表示结皮土壤系统呼吸大于光合,表现为碳源;负值表示光合大于呼吸,表现为碳汇.自然状态下极端环境结皮土壤系统净碳通量为-10.02~5.30 μmol·m-2·s-1[8,10,22,56-57](表4),且存在明显区域间差异.此外,同一区域不同类型结皮土壤系统净碳通量并未表现出明显差异,这是因为相较于低级演替阶段的藻类结皮,苔藓结皮光合固碳能力及呼吸碳排放能力均更强,但其光合固定碳与呼吸排放碳相互抵消,使得苔藓结皮土壤系统净碳通量与藻类无明显差异[41]. ...
... /(μmol·m
-2·s
-1)
参考文献 | | 纳米比亚沙漠 | 地衣结皮 | 荒漠微孢衣 | -10.02~3.01 | [22] |
| 橙衣属 | -7.25~1.88 | [22] |
| 小网衣属 | -6.21~1.02 | [22] |
| 古尔班通古特沙漠 | 苔藓结皮 | — | -0.28~1.18 | [56] |
| 藻结皮、地衣结皮 | — | -0.18~1.20 | [56] |
| 共和盆地 | 藻结皮 | — | -0.01~4.83 | [8] |
| 苔藓结皮 | — | 0.20~5.10 | [8] |
| 毛乌素沙地 | 藻结皮 | — | -0.18~1.43 | [57] |
| 苔藓结皮 | — | -1.24~1.38 | [57] |
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... [
10]
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
毛乌素沙地生物结皮的光合及土壤CO2通量特征研究
6
2018
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮对区域碳排放的影响机制主要有3方面:①结皮中细菌、真菌等微生物组分通过呼吸作用释放CO2,增加土壤呼吸碳排放;②结皮发育堵塞土壤孔隙,减少土壤与大气之间的CO2交换,抑制土壤呼吸碳排放[33-34];③结皮发育改变下层土壤的温度和水分等环境条件,间接影响土壤呼吸碳排放[35].结皮发育对土壤碳排放速率的影响取决于多种机制的综合作用.当促进机制超过阻碍机制时,结皮发育促进土壤碳排放速率,反之则抑制.多项研究结果表明,结皮发育对极端环境土壤碳排放的影响表现出明显的地域性差异[8,11,25,36](表3). ...
... /(μmol·m
-2·s
-1)
结皮发育对土壤 碳排放速率 的影响 | 参考 文献 | | 共和盆地 | 藻结皮 | — | 0.43~1.53 | 0.49~2.36 | 促进 | [8] |
| 苔藓结皮 | — | 0.43~1.53 | 0.59~3.13 | 促进 | [8] |
| 黄土高原 | 苔藓结皮 | 极地真藓(Bryum arcticum)、土生扭口藓(Barbula vinealis) | 1.45~2.01 | 1.19~1.66 | 抑制 | [25] |
| 毛乌素沙地 | 藻结皮 | — | 0.50~1.55 | 0.57~1.66 | 促进 | [11] |
| 苔藓结皮 | — | 0.50~1.55 | 0.86~1.95 | 促进 | [11] |
| 科尔沁沙地 | 藻结皮、苔藓结皮 | 蓝藻、真藓 | 0.45~12.35 | 0.40~4.86 | 抑制 | [36] |
结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... [
11]
| 科尔沁沙地 | 藻结皮、苔藓结皮 | 蓝藻、真藓 | 0.45~12.35 | 0.40~4.86 | 抑制 | [36] |
结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
Temporal variation in community composition,pigmentation,and Fv/Fm of desert cyanobacterial soil crusts
1
2002
... 光合固碳速率是衡量光合作用强度的重要指标,反映结皮光合固碳的活跃程度.研究表明极端环境发育的结皮光合固碳速率为0.05~8.28 μmol·m-2·s-1(表1),最高值与荒漠草原维管植物相当[9].不同类型结皮光合固碳速率存在明显差异,以苔藓为优势种的高级演替阶段结皮光合固碳速率是以藻类为优势种的初级演替阶段结皮的2~7倍,这一差异与结皮叶绿素含量密切相关[10-12].藻类结皮叶绿素含量通常小于200 mg·m-2[13],而苔藓结皮叶绿素含量高达805 mg·m-2[14].较高的叶绿素含量赋予苔藓结皮更强的光捕获能力和光合活性,使其光利用效率明显优于藻类结皮.随着结皮光合固碳速率测量方法不断优化,早期研究人员多将结皮从土壤表面剥离后进行室内测定,而现今研究学者多采用原位观测.不同观测方法测定结果在数量级上大致相当(表1)[15-19]. ...
Estimates of global cyanobacterial biomass and its distribution
1
2003
... 光合固碳速率是衡量光合作用强度的重要指标,反映结皮光合固碳的活跃程度.研究表明极端环境发育的结皮光合固碳速率为0.05~8.28 μmol·m-2·s-1(表1),最高值与荒漠草原维管植物相当[9].不同类型结皮光合固碳速率存在明显差异,以苔藓为优势种的高级演替阶段结皮光合固碳速率是以藻类为优势种的初级演替阶段结皮的2~7倍,这一差异与结皮叶绿素含量密切相关[10-12].藻类结皮叶绿素含量通常小于200 mg·m-2[13],而苔藓结皮叶绿素含量高达805 mg·m-2[14].较高的叶绿素含量赋予苔藓结皮更强的光捕获能力和光合活性,使其光利用效率明显优于藻类结皮.随着结皮光合固碳速率测量方法不断优化,早期研究人员多将结皮从土壤表面剥离后进行室内测定,而现今研究学者多采用原位观测.不同观测方法测定结果在数量级上大致相当(表1)[15-19]. ...
腾格里沙漠不同组成生物结皮特征及其对土壤酶活性的影响
1
2022
... 光合固碳速率是衡量光合作用强度的重要指标,反映结皮光合固碳的活跃程度.研究表明极端环境发育的结皮光合固碳速率为0.05~8.28 μmol·m-2·s-1(表1),最高值与荒漠草原维管植物相当[9].不同类型结皮光合固碳速率存在明显差异,以苔藓为优势种的高级演替阶段结皮光合固碳速率是以藻类为优势种的初级演替阶段结皮的2~7倍,这一差异与结皮叶绿素含量密切相关[10-12].藻类结皮叶绿素含量通常小于200 mg·m-2[13],而苔藓结皮叶绿素含量高达805 mg·m-2[14].较高的叶绿素含量赋予苔藓结皮更强的光捕获能力和光合活性,使其光利用效率明显优于藻类结皮.随着结皮光合固碳速率测量方法不断优化,早期研究人员多将结皮从土壤表面剥离后进行室内测定,而现今研究学者多采用原位观测.不同观测方法测定结果在数量级上大致相当(表1)[15-19]. ...
Photosynthesis of cryptobiotic soil crusts in a seasonally inundated system of pans and dunes in the western Mojave Desert,CA:field studies
6
2005
... 光合固碳速率是衡量光合作用强度的重要指标,反映结皮光合固碳的活跃程度.研究表明极端环境发育的结皮光合固碳速率为0.05~8.28 μmol·m-2·s-1(表1),最高值与荒漠草原维管植物相当[9].不同类型结皮光合固碳速率存在明显差异,以苔藓为优势种的高级演替阶段结皮光合固碳速率是以藻类为优势种的初级演替阶段结皮的2~7倍,这一差异与结皮叶绿素含量密切相关[10-12].藻类结皮叶绿素含量通常小于200 mg·m-2[13],而苔藓结皮叶绿素含量高达805 mg·m-2[14].较高的叶绿素含量赋予苔藓结皮更强的光捕获能力和光合活性,使其光利用效率明显优于藻类结皮.随着结皮光合固碳速率测量方法不断优化,早期研究人员多将结皮从土壤表面剥离后进行室内测定,而现今研究学者多采用原位观测.不同观测方法测定结果在数量级上大致相当(表1)[15-19]. ...
... /(μmol·m
-2·s
-1)
参考 文献 | | 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻(Microcoleus vaginatus) | 样品采集 | 最大值 5.75 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 8.28 | [15] |
| 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 最大值 3.93 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 4.16 | [15] |
| 腾格里沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 0.55~2.8 | [16] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.07~2.93 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓(Syntrichia caninervis)、对齿藓属、胶衣属 | 样品采集 | 0.69~3.07 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.14~2.3 | [17] |
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [
15]
| 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 最大值 3.93 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 4.16 | [15] |
| 腾格里沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 0.55~2.8 | [16] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.07~2.93 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓(Syntrichia caninervis)、对齿藓属、胶衣属 | 样品采集 | 0.69~3.07 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.14~2.3 | [17] |
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [
15]
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 4.16 | [15] |
| 腾格里沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 0.55~2.8 | [16] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.07~2.93 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓(Syntrichia caninervis)、对齿藓属、胶衣属 | 样品采集 | 0.69~3.07 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.14~2.3 | [17] |
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [
15]
| 腾格里沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 0.55~2.8 | [16] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.07~2.93 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓(Syntrichia caninervis)、对齿藓属、胶衣属 | 样品采集 | 0.69~3.07 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.14~2.3 | [17] |
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮光合固碳量是指在一段时间内通过结皮光合作用吸收并固定的碳量,表征结皮碳输入量,通常以g·m-2·a-1(C固定量)或Pg·a-1为单位.与维管植物相比,极端环境结皮覆盖面积广泛,是生态系统碳输入的主要来源.Elbert等[26]认为全球结皮光合固碳量可达3.9 Pg·a-1,相当于陆地植物净初级生产力的7%.美国莫哈维沙漠、中国腾格里沙漠及毛乌素沙地等干旱沙区发育的藻类结皮及苔藓结皮的固碳量分别为11.17~30.64[15,18,27]、26.75~51.57 g·m-2·a-1[18,27].高温且极度干旱的纳米比亚沙漠荒漠微孢衣(Acarospora schleicheri)、橙衣属和小网衣属地衣凭借自身极高的水分利用效率,通过吸收雾气以维持光合生理活性,固碳量达到16 g·m-2·a-1[22].寒冷极地及高海拔地区的厚垫状地衣及苔藓结皮通过冻融产生的大量可利用水分固定了相当一部分碳.例如南极地区极地金发藓(Polytrichum alpestre)、针叶离齿藓(Chorisodontium aciphyllum),固碳量分别为213~350 g·m-2·a-1和162 g·m-2·a-1[28].结皮光合固碳量是由结皮固碳速率与固碳时长共同决定的.在同一地区,处于高级演替阶段苔藓结皮因具有较强的光合固碳速率及持水能力,光合固碳量明显高于藻类结皮.此外,由于长期不均匀的降水分布,极端环境仅能为结皮提供不连续的水分供应,导致其光合固碳量时空异质性较强,存在明显的区域间差异. ...
不同演替序列的藻结皮净光合速率日变化特征
2
2010
... /(μmol·m
-2·s
-1)
参考 文献 | | 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻(Microcoleus vaginatus) | 样品采集 | 最大值 5.75 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 8.28 | [15] |
| 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 最大值 3.93 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 4.16 | [15] |
| 腾格里沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 0.55~2.8 | [16] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.07~2.93 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓(Syntrichia caninervis)、对齿藓属、胶衣属 | 样品采集 | 0.69~3.07 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.14~2.3 | [17] |
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
Carbon exchange in biological soil crust communities under differential temperatures and soil water contents:implications for global change
9
2010
... /(μmol·m
-2·s
-1)
参考 文献 | | 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻(Microcoleus vaginatus) | 样品采集 | 最大值 5.75 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 8.28 | [15] |
| 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 最大值 3.93 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 4.16 | [15] |
| 腾格里沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 0.55~2.8 | [16] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.07~2.93 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓(Syntrichia caninervis)、对齿藓属、胶衣属 | 样品采集 | 0.69~3.07 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.14~2.3 | [17] |
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [
17]
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.14~2.3 | [17] |
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [
17]
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 极端环境发育的结皮呼吸碳排放速率为0~3.58 μmol·m-2·s-1[17,29](表2).研究表明,水分和温度等环境条件是影响结皮呼吸碳排放的关键.降水可迅速激发结皮呼吸排放碳,促使其经历短暂由物理过程主导的CO2爆发过程.之后结皮吸水并恢复正常生理活动,呼吸碳排放速率提高[30].当结皮处于相对缺水状态时,降水发生后,其呼吸碳排放速率随含水量增加而持续增高;随着含水量的进一步增加,结皮呼吸速率逐渐趋于稳定[31].然而,在极端环境下,时空分布不均匀的降水活动导致结皮在长期干燥失活状态与短暂湿润激活状态之间频繁切换,进一步加剧了结皮呼吸碳排放的时空异质性.其次,温度也是影响结皮呼吸碳排放的关键因素.随着温度升高,胶衣属、双缘衣属、磷网衣属地衣结皮呼吸碳排放速率均明显增加[29].但该试验仅在0~50 ℃的适温范围内进行的,继续升温是否仍会促进结皮呼吸碳排放,有待进一步深入研究. ...
... Respiration carbon emission rate of BSCs
Table 2| 研究区域 | 结皮类型 | 优势种 | 结皮呼吸速率/(μmol·m-2·s-1) | 参考文献 |
|---|
| 美国犹他州南部 | 地衣结皮 | 胶衣属 | 0~1.42 | [29] |
| 双缘衣属 | 0~1.92 | [29] |
| 磷网衣属 | 0~2.53 | [29] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 0~1.82 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓、对齿藓属、胶衣属 | 0~2.72 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 0~2.34 | [17] |
| 地衣结皮、苔藓结皮 | 胶衣属 | 0~3.58 | [17] |
<strong>3</strong> 结皮净光合速率净光合速率是自养生物体光合速率与呼吸碳速率之间的差值.净光合速率为正,表示光合碳固定量大于呼吸碳排放量,积累有机物;净光合速率为负,表示光合固碳量小于呼吸碳排放量,消耗有机物.与维管植物类似,在适宜环境条件下,结皮净光合速率通常为正值. ...
... [
17]
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 0~2.34 | [17] |
| 地衣结皮、苔藓结皮 | 胶衣属 | 0~3.58 | [17] |
<strong>3</strong> 结皮净光合速率净光合速率是自养生物体光合速率与呼吸碳速率之间的差值.净光合速率为正,表示光合碳固定量大于呼吸碳排放量,积累有机物;净光合速率为负,表示光合固碳量小于呼吸碳排放量,消耗有机物.与维管植物类似,在适宜环境条件下,结皮净光合速率通常为正值. ...
... [
17]
| 地衣结皮、苔藓结皮 | 胶衣属 | 0~3.58 | [17] |
<strong>3</strong> 结皮净光合速率净光合速率是自养生物体光合速率与呼吸碳速率之间的差值.净光合速率为正,表示光合碳固定量大于呼吸碳排放量,积累有机物;净光合速率为负,表示光合固碳量小于呼吸碳排放量,消耗有机物.与维管植物类似,在适宜环境条件下,结皮净光合速率通常为正值. ...
... [
17]
<strong>3</strong> 结皮净光合速率净光合速率是自养生物体光合速率与呼吸碳速率之间的差值.净光合速率为正,表示光合碳固定量大于呼吸碳排放量,积累有机物;净光合速率为负,表示光合固碳量小于呼吸碳排放量,消耗有机物.与维管植物类似,在适宜环境条件下,结皮净光合速率通常为正值. ...
Carbon fixation by biological soil crusts following revegetation of sand dunes in arid desert regions of China:a four-year field study
5
2012
... /(μmol·m
-2·s
-1)
参考 文献 | | 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻(Microcoleus vaginatus) | 样品采集 | 最大值 5.75 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 8.28 | [15] |
| 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 最大值 3.93 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 4.16 | [15] |
| 腾格里沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 0.55~2.8 | [16] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.07~2.93 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓(Syntrichia caninervis)、对齿藓属、胶衣属 | 样品采集 | 0.69~3.07 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.14~2.3 | [17] |
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [
18]
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮光合固碳量是指在一段时间内通过结皮光合作用吸收并固定的碳量,表征结皮碳输入量,通常以g·m-2·a-1(C固定量)或Pg·a-1为单位.与维管植物相比,极端环境结皮覆盖面积广泛,是生态系统碳输入的主要来源.Elbert等[26]认为全球结皮光合固碳量可达3.9 Pg·a-1,相当于陆地植物净初级生产力的7%.美国莫哈维沙漠、中国腾格里沙漠及毛乌素沙地等干旱沙区发育的藻类结皮及苔藓结皮的固碳量分别为11.17~30.64[15,18,27]、26.75~51.57 g·m-2·a-1[18,27].高温且极度干旱的纳米比亚沙漠荒漠微孢衣(Acarospora schleicheri)、橙衣属和小网衣属地衣凭借自身极高的水分利用效率,通过吸收雾气以维持光合生理活性,固碳量达到16 g·m-2·a-1[22].寒冷极地及高海拔地区的厚垫状地衣及苔藓结皮通过冻融产生的大量可利用水分固定了相当一部分碳.例如南极地区极地金发藓(Polytrichum alpestre)、针叶离齿藓(Chorisodontium aciphyllum),固碳量分别为213~350 g·m-2·a-1和162 g·m-2·a-1[28].结皮光合固碳量是由结皮固碳速率与固碳时长共同决定的.在同一地区,处于高级演替阶段苔藓结皮因具有较强的光合固碳速率及持水能力,光合固碳量明显高于藻类结皮.此外,由于长期不均匀的降水分布,极端环境仅能为结皮提供不连续的水分供应,导致其光合固碳量时空异质性较强,存在明显的区域间差异. ...
... -1[18,27].高温且极度干旱的纳米比亚沙漠荒漠微孢衣(Acarospora schleicheri)、橙衣属和小网衣属地衣凭借自身极高的水分利用效率,通过吸收雾气以维持光合生理活性,固碳量达到16 g·m-2·a-1[22].寒冷极地及高海拔地区的厚垫状地衣及苔藓结皮通过冻融产生的大量可利用水分固定了相当一部分碳.例如南极地区极地金发藓(Polytrichum alpestre)、针叶离齿藓(Chorisodontium aciphyllum),固碳量分别为213~350 g·m-2·a-1和162 g·m-2·a-1[28].结皮光合固碳量是由结皮固碳速率与固碳时长共同决定的.在同一地区,处于高级演替阶段苔藓结皮因具有较强的光合固碳速率及持水能力,光合固碳量明显高于藻类结皮.此外,由于长期不均匀的降水分布,极端环境仅能为结皮提供不连续的水分供应,导致其光合固碳量时空异质性较强,存在明显的区域间差异. ...
Carbon and nitrogen fixation differ between successional stages of biological soil crusts in the Colorado Plateau and Chihuahuan Desert
5
2006
... 光合固碳速率是衡量光合作用强度的重要指标,反映结皮光合固碳的活跃程度.研究表明极端环境发育的结皮光合固碳速率为0.05~8.28 μmol·m-2·s-1(表1),最高值与荒漠草原维管植物相当[9].不同类型结皮光合固碳速率存在明显差异,以苔藓为优势种的高级演替阶段结皮光合固碳速率是以藻类为优势种的初级演替阶段结皮的2~7倍,这一差异与结皮叶绿素含量密切相关[10-12].藻类结皮叶绿素含量通常小于200 mg·m-2[13],而苔藓结皮叶绿素含量高达805 mg·m-2[14].较高的叶绿素含量赋予苔藓结皮更强的光捕获能力和光合活性,使其光利用效率明显优于藻类结皮.随着结皮光合固碳速率测量方法不断优化,早期研究人员多将结皮从土壤表面剥离后进行室内测定,而现今研究学者多采用原位观测.不同观测方法测定结果在数量级上大致相当(表1)[15-19]. ...
... /(μmol·m
-2·s
-1)
参考 文献 | | 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻(Microcoleus vaginatus) | 样品采集 | 最大值 5.75 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 8.28 | [15] |
| 莫哈维沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 最大值 3.93 | [15] |
| 藻结皮 | 具鞘藻属、伪枝藻属 | 样品采集 | 最大值 4.16 | [15] |
| 腾格里沙漠 | 藻结皮 | 具鞘微鞘藻 | 样品采集 | 0.55~2.8 | [16] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.07~2.93 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓(Syntrichia caninervis)、对齿藓属、胶衣属 | 样品采集 | 0.69~3.07 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 样品采集 | 0.14~2.3 | [17] |
| 腾格里沙漠 | 藻结皮 | 固氮鱼腥藻(Anabaena azotica)、衣藻属 | 原位测定 | 0.05~1.84 | [18] |
| 地衣结皮、苔藓结皮 | 真藓(Bryum argenteum)、齿肋赤藓 | 原位测定 | 0.22~2.25 | [18] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.10~1.48 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.30~1.52 | [19] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [
19]
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属 | 原位测定 | 0.05~1.23 | [19] |
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [
19]
| 藻结皮、地衣结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 原位测定 | 0.50~2.61 | [19] |
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... [
19]
结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
高寒沙区生物土壤结皮覆盖对土壤碳通量的影响
1
2016
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
干旱人工植被区藻结皮光合固碳的时间效应研究
1
2011
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
Photosynthesis and water relations of lichen soil crusts:field measurements in the coastal fog zone of the Namib Desert
6
1994
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮光合固碳量是指在一段时间内通过结皮光合作用吸收并固定的碳量,表征结皮碳输入量,通常以g·m-2·a-1(C固定量)或Pg·a-1为单位.与维管植物相比,极端环境结皮覆盖面积广泛,是生态系统碳输入的主要来源.Elbert等[26]认为全球结皮光合固碳量可达3.9 Pg·a-1,相当于陆地植物净初级生产力的7%.美国莫哈维沙漠、中国腾格里沙漠及毛乌素沙地等干旱沙区发育的藻类结皮及苔藓结皮的固碳量分别为11.17~30.64[15,18,27]、26.75~51.57 g·m-2·a-1[18,27].高温且极度干旱的纳米比亚沙漠荒漠微孢衣(Acarospora schleicheri)、橙衣属和小网衣属地衣凭借自身极高的水分利用效率,通过吸收雾气以维持光合生理活性,固碳量达到16 g·m-2·a-1[22].寒冷极地及高海拔地区的厚垫状地衣及苔藓结皮通过冻融产生的大量可利用水分固定了相当一部分碳.例如南极地区极地金发藓(Polytrichum alpestre)、针叶离齿藓(Chorisodontium aciphyllum),固碳量分别为213~350 g·m-2·a-1和162 g·m-2·a-1[28].结皮光合固碳量是由结皮固碳速率与固碳时长共同决定的.在同一地区,处于高级演替阶段苔藓结皮因具有较强的光合固碳速率及持水能力,光合固碳量明显高于藻类结皮.此外,由于长期不均匀的降水分布,极端环境仅能为结皮提供不连续的水分供应,导致其光合固碳量时空异质性较强,存在明显的区域间差异. ...
... 结皮发育能否改变生态系统的碳收支是研究学者关注的热点.净碳通量是碳排放和光合固碳之间的净差值,是表征区域生态系统碳源汇的关键指标.通常情况下,净碳通量正值表示结皮土壤系统呼吸大于光合,表现为碳源;负值表示光合大于呼吸,表现为碳汇.自然状态下极端环境结皮土壤系统净碳通量为-10.02~5.30 μmol·m-2·s-1[8,10,22,56-57](表4),且存在明显区域间差异.此外,同一区域不同类型结皮土壤系统净碳通量并未表现出明显差异,这是因为相较于低级演替阶段的藻类结皮,苔藓结皮光合固碳能力及呼吸碳排放能力均更强,但其光合固定碳与呼吸排放碳相互抵消,使得苔藓结皮土壤系统净碳通量与藻类无明显差异[41]. ...
... /(μmol·m
-2·s
-1)
参考文献 | | 纳米比亚沙漠 | 地衣结皮 | 荒漠微孢衣 | -10.02~3.01 | [22] |
| 橙衣属 | -7.25~1.88 | [22] |
| 小网衣属 | -6.21~1.02 | [22] |
| 古尔班通古特沙漠 | 苔藓结皮 | — | -0.28~1.18 | [56] |
| 藻结皮、地衣结皮 | — | -0.18~1.20 | [56] |
| 共和盆地 | 藻结皮 | — | -0.01~4.83 | [8] |
| 苔藓结皮 | — | 0.20~5.10 | [8] |
| 毛乌素沙地 | 藻结皮 | — | -0.18~1.43 | [57] |
| 苔藓结皮 | — | -1.24~1.38 | [57] |
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... [
22]
| 小网衣属 | -6.21~1.02 | [22] |
| 古尔班通古特沙漠 | 苔藓结皮 | — | -0.28~1.18 | [56] |
| 藻结皮、地衣结皮 | — | -0.18~1.20 | [56] |
| 共和盆地 | 藻结皮 | — | -0.01~4.83 | [8] |
| 苔藓结皮 | — | 0.20~5.10 | [8] |
| 毛乌素沙地 | 藻结皮 | — | -0.18~1.43 | [57] |
| 苔藓结皮 | — | -1.24~1.38 | [57] |
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... [
22]
| 古尔班通古特沙漠 | 苔藓结皮 | — | -0.28~1.18 | [56] |
| 藻结皮、地衣结皮 | — | -0.18~1.20 | [56] |
| 共和盆地 | 藻结皮 | — | -0.01~4.83 | [8] |
| 苔藓结皮 | — | 0.20~5.10 | [8] |
| 毛乌素沙地 | 藻结皮 | — | -0.18~1.43 | [57] |
| 苔藓结皮 | — | -1.24~1.38 | [57] |
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
荒漠生物结皮碳交换对模拟增温和降雨变化的响应
2
2024
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
生物土壤结皮光合固碳活性对水热因子的响应
1
2016
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
黄土高原两种质地土壤藓结皮的呼吸特征与变化规律
3
2016
... 结皮光合固碳是复杂的生物化学过程,对外界环境变化具有极高的敏感性.自然条件下结皮光合固碳速率的日、月动态均呈现明显的单峰或双峰曲线规律[8,10-11,16,20-21].水分是制约极端环境条件下生物正常生理活动的关键因素.结皮植物多为变水植物,在高温、干旱等极端环境条件下,通常处于休眠状态以维持生存[22].天然降水是极端环境结皮恢复正常生理活性,进行光合固碳的主要水分来源[23].随着降水量增加,结皮水分含量相应增加,结皮光合固碳速率提升.然而,当单次降水强度过大或降水总量过高时,结皮水分过度饱和,堵塞气体扩散的空隙通道,切断光合羧化反应的CO2供应路径,导致结皮光合固碳被抑制,光合速率下降[18,24].温度也是影响结皮光合固碳速率的重要因素.在适温环境,温度升高可提高结皮光合酶活性,加快结皮固碳速率;当增温幅度过高时,结皮内部酶结构被破坏,光合速率被抑制.结皮光合固碳速率在30 ℃左右时达到峰值,而当外界温度进一步升高,固碳速率迅速下降[17].而增温导致结皮光合固碳速率下降可归因于结皮水分蒸发导致的光合酶活性减弱[11,25].当环境温度持续升高,结皮因失水而重新恢复休眠状态是结皮应对高温环境演化的适应性生存策略.增温对结皮光合固碳促进效应受水分条件限制.以共和盆地研究为例,在降水量少、土壤含水量较低的相对干旱年,适度增温(0.65 ℃)可增加结皮的固碳速率,而过高增温幅度(>1 ℃)则降低结皮光合固碳速率;在降水充足、土壤含水量较高的湿润年,增温幅度越高,结皮固碳速率越大[8].综上所述,适度降水及增温能激发并提高结皮光合固碳速率;当影响超出一定阈值时,结皮光合固碳速率因底物供应不足、水分过度散失以及光合酶活性受抑制等而下降. ...
... 结皮对区域碳排放的影响机制主要有3方面:①结皮中细菌、真菌等微生物组分通过呼吸作用释放CO2,增加土壤呼吸碳排放;②结皮发育堵塞土壤孔隙,减少土壤与大气之间的CO2交换,抑制土壤呼吸碳排放[33-34];③结皮发育改变下层土壤的温度和水分等环境条件,间接影响土壤呼吸碳排放[35].结皮发育对土壤碳排放速率的影响取决于多种机制的综合作用.当促进机制超过阻碍机制时,结皮发育促进土壤碳排放速率,反之则抑制.多项研究结果表明,结皮发育对极端环境土壤碳排放的影响表现出明显的地域性差异[8,11,25,36](表3). ...
... /(μmol·m
-2·s
-1)
结皮发育对土壤 碳排放速率 的影响 | 参考 文献 | | 共和盆地 | 藻结皮 | — | 0.43~1.53 | 0.49~2.36 | 促进 | [8] |
| 苔藓结皮 | — | 0.43~1.53 | 0.59~3.13 | 促进 | [8] |
| 黄土高原 | 苔藓结皮 | 极地真藓(Bryum arcticum)、土生扭口藓(Barbula vinealis) | 1.45~2.01 | 1.19~1.66 | 抑制 | [25] |
| 毛乌素沙地 | 藻结皮 | — | 0.50~1.55 | 0.57~1.66 | 促进 | [11] |
| 苔藓结皮 | — | 0.50~1.55 | 0.86~1.95 | 促进 | [11] |
| 科尔沁沙地 | 藻结皮、苔藓结皮 | 蓝藻、真藓 | 0.45~12.35 | 0.40~4.86 | 抑制 | [36] |
结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
Contribution of cryptogamic covers to the global cycles of carbon and nitrogen
1
2012
... 结皮光合固碳量是指在一段时间内通过结皮光合作用吸收并固定的碳量,表征结皮碳输入量,通常以g·m-2·a-1(C固定量)或Pg·a-1为单位.与维管植物相比,极端环境结皮覆盖面积广泛,是生态系统碳输入的主要来源.Elbert等[26]认为全球结皮光合固碳量可达3.9 Pg·a-1,相当于陆地植物净初级生产力的7%.美国莫哈维沙漠、中国腾格里沙漠及毛乌素沙地等干旱沙区发育的藻类结皮及苔藓结皮的固碳量分别为11.17~30.64[15,18,27]、26.75~51.57 g·m-2·a-1[18,27].高温且极度干旱的纳米比亚沙漠荒漠微孢衣(Acarospora schleicheri)、橙衣属和小网衣属地衣凭借自身极高的水分利用效率,通过吸收雾气以维持光合生理活性,固碳量达到16 g·m-2·a-1[22].寒冷极地及高海拔地区的厚垫状地衣及苔藓结皮通过冻融产生的大量可利用水分固定了相当一部分碳.例如南极地区极地金发藓(Polytrichum alpestre)、针叶离齿藓(Chorisodontium aciphyllum),固碳量分别为213~350 g·m-2·a-1和162 g·m-2·a-1[28].结皮光合固碳量是由结皮固碳速率与固碳时长共同决定的.在同一地区,处于高级演替阶段苔藓结皮因具有较强的光合固碳速率及持水能力,光合固碳量明显高于藻类结皮.此外,由于长期不均匀的降水分布,极端环境仅能为结皮提供不连续的水分供应,导致其光合固碳量时空异质性较强,存在明显的区域间差异. ...
毛乌素沙地生物结皮光合固碳过程及对土壤碳排放的影响
3
2014
... 结皮光合固碳量是指在一段时间内通过结皮光合作用吸收并固定的碳量,表征结皮碳输入量,通常以g·m-2·a-1(C固定量)或Pg·a-1为单位.与维管植物相比,极端环境结皮覆盖面积广泛,是生态系统碳输入的主要来源.Elbert等[26]认为全球结皮光合固碳量可达3.9 Pg·a-1,相当于陆地植物净初级生产力的7%.美国莫哈维沙漠、中国腾格里沙漠及毛乌素沙地等干旱沙区发育的藻类结皮及苔藓结皮的固碳量分别为11.17~30.64[15,18,27]、26.75~51.57 g·m-2·a-1[18,27].高温且极度干旱的纳米比亚沙漠荒漠微孢衣(Acarospora schleicheri)、橙衣属和小网衣属地衣凭借自身极高的水分利用效率,通过吸收雾气以维持光合生理活性,固碳量达到16 g·m-2·a-1[22].寒冷极地及高海拔地区的厚垫状地衣及苔藓结皮通过冻融产生的大量可利用水分固定了相当一部分碳.例如南极地区极地金发藓(Polytrichum alpestre)、针叶离齿藓(Chorisodontium aciphyllum),固碳量分别为213~350 g·m-2·a-1和162 g·m-2·a-1[28].结皮光合固碳量是由结皮固碳速率与固碳时长共同决定的.在同一地区,处于高级演替阶段苔藓结皮因具有较强的光合固碳速率及持水能力,光合固碳量明显高于藻类结皮.此外,由于长期不均匀的降水分布,极端环境仅能为结皮提供不连续的水分供应,导致其光合固碳量时空异质性较强,存在明显的区域间差异. ...
... ,27].高温且极度干旱的纳米比亚沙漠荒漠微孢衣(Acarospora schleicheri)、橙衣属和小网衣属地衣凭借自身极高的水分利用效率,通过吸收雾气以维持光合生理活性,固碳量达到16 g·m-2·a-1[22].寒冷极地及高海拔地区的厚垫状地衣及苔藓结皮通过冻融产生的大量可利用水分固定了相当一部分碳.例如南极地区极地金发藓(Polytrichum alpestre)、针叶离齿藓(Chorisodontium aciphyllum),固碳量分别为213~350 g·m-2·a-1和162 g·m-2·a-1[28].结皮光合固碳量是由结皮固碳速率与固碳时长共同决定的.在同一地区,处于高级演替阶段苔藓结皮因具有较强的光合固碳速率及持水能力,光合固碳量明显高于藻类结皮.此外,由于长期不均匀的降水分布,极端环境仅能为结皮提供不连续的水分供应,导致其光合固碳量时空异质性较强,存在明显的区域间差异. ...
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
The rate of peat accumulation in Antarctic moss banks
1
1980
... 结皮光合固碳量是指在一段时间内通过结皮光合作用吸收并固定的碳量,表征结皮碳输入量,通常以g·m-2·a-1(C固定量)或Pg·a-1为单位.与维管植物相比,极端环境结皮覆盖面积广泛,是生态系统碳输入的主要来源.Elbert等[26]认为全球结皮光合固碳量可达3.9 Pg·a-1,相当于陆地植物净初级生产力的7%.美国莫哈维沙漠、中国腾格里沙漠及毛乌素沙地等干旱沙区发育的藻类结皮及苔藓结皮的固碳量分别为11.17~30.64[15,18,27]、26.75~51.57 g·m-2·a-1[18,27].高温且极度干旱的纳米比亚沙漠荒漠微孢衣(Acarospora schleicheri)、橙衣属和小网衣属地衣凭借自身极高的水分利用效率,通过吸收雾气以维持光合生理活性,固碳量达到16 g·m-2·a-1[22].寒冷极地及高海拔地区的厚垫状地衣及苔藓结皮通过冻融产生的大量可利用水分固定了相当一部分碳.例如南极地区极地金发藓(Polytrichum alpestre)、针叶离齿藓(Chorisodontium aciphyllum),固碳量分别为213~350 g·m-2·a-1和162 g·m-2·a-1[28].结皮光合固碳量是由结皮固碳速率与固碳时长共同决定的.在同一地区,处于高级演替阶段苔藓结皮因具有较强的光合固碳速率及持水能力,光合固碳量明显高于藻类结皮.此外,由于长期不均匀的降水分布,极端环境仅能为结皮提供不连续的水分供应,导致其光合固碳量时空异质性较强,存在明显的区域间差异. ...
Photosynthesis of the cyanobacterial soil-crust lichen collema tenax from arid lands in southern utah,USA:role of water content on light and temperature responses of CO2 exchange
5
1998
... 极端环境发育的结皮呼吸碳排放速率为0~3.58 μmol·m-2·s-1[17,29](表2).研究表明,水分和温度等环境条件是影响结皮呼吸碳排放的关键.降水可迅速激发结皮呼吸排放碳,促使其经历短暂由物理过程主导的CO2爆发过程.之后结皮吸水并恢复正常生理活动,呼吸碳排放速率提高[30].当结皮处于相对缺水状态时,降水发生后,其呼吸碳排放速率随含水量增加而持续增高;随着含水量的进一步增加,结皮呼吸速率逐渐趋于稳定[31].然而,在极端环境下,时空分布不均匀的降水活动导致结皮在长期干燥失活状态与短暂湿润激活状态之间频繁切换,进一步加剧了结皮呼吸碳排放的时空异质性.其次,温度也是影响结皮呼吸碳排放的关键因素.随着温度升高,胶衣属、双缘衣属、磷网衣属地衣结皮呼吸碳排放速率均明显增加[29].但该试验仅在0~50 ℃的适温范围内进行的,继续升温是否仍会促进结皮呼吸碳排放,有待进一步深入研究. ...
... [29].但该试验仅在0~50 ℃的适温范围内进行的,继续升温是否仍会促进结皮呼吸碳排放,有待进一步深入研究. ...
... Respiration carbon emission rate of BSCs
Table 2| 研究区域 | 结皮类型 | 优势种 | 结皮呼吸速率/(μmol·m-2·s-1) | 参考文献 |
|---|
| 美国犹他州南部 | 地衣结皮 | 胶衣属 | 0~1.42 | [29] |
| 双缘衣属 | 0~1.92 | [29] |
| 磷网衣属 | 0~2.53 | [29] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 0~1.82 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓、对齿藓属、胶衣属 | 0~2.72 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 0~2.34 | [17] |
| 地衣结皮、苔藓结皮 | 胶衣属 | 0~3.58 | [17] |
<strong>3</strong> 结皮净光合速率净光合速率是自养生物体光合速率与呼吸碳速率之间的差值.净光合速率为正,表示光合碳固定量大于呼吸碳排放量,积累有机物;净光合速率为负,表示光合固碳量小于呼吸碳排放量,消耗有机物.与维管植物类似,在适宜环境条件下,结皮净光合速率通常为正值. ...
... [
29]
| 磷网衣属 | 0~2.53 | [29] |
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 0~1.82 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓、对齿藓属、胶衣属 | 0~2.72 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 0~2.34 | [17] |
| 地衣结皮、苔藓结皮 | 胶衣属 | 0~3.58 | [17] |
<strong>3</strong> 结皮净光合速率净光合速率是自养生物体光合速率与呼吸碳速率之间的差值.净光合速率为正,表示光合碳固定量大于呼吸碳排放量,积累有机物;净光合速率为负,表示光合固碳量小于呼吸碳排放量,消耗有机物.与维管植物类似,在适宜环境条件下,结皮净光合速率通常为正值. ...
... [
29]
| 科罗拉多高原 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 0~1.82 | [17] |
| 地衣结皮、苔藓结皮 | 齿肋赤藓、对齿藓属、胶衣属 | 0~2.72 | [17] |
| 奇瓦瓦沙漠 | 藻结皮 | 具鞘藻属、念珠藻属、伪枝藻属 | 0~2.34 | [17] |
| 地衣结皮、苔藓结皮 | 胶衣属 | 0~3.58 | [17] |
<strong>3</strong> 结皮净光合速率净光合速率是自养生物体光合速率与呼吸碳速率之间的差值.净光合速率为正,表示光合碳固定量大于呼吸碳排放量,积累有机物;净光合速率为负,表示光合固碳量小于呼吸碳排放量,消耗有机物.与维管植物类似,在适宜环境条件下,结皮净光合速率通常为正值. ...
Ecological physiology of the lichen Hypogymnia physodes
1
1976
... 极端环境发育的结皮呼吸碳排放速率为0~3.58 μmol·m-2·s-1[17,29](表2).研究表明,水分和温度等环境条件是影响结皮呼吸碳排放的关键.降水可迅速激发结皮呼吸排放碳,促使其经历短暂由物理过程主导的CO2爆发过程.之后结皮吸水并恢复正常生理活动,呼吸碳排放速率提高[30].当结皮处于相对缺水状态时,降水发生后,其呼吸碳排放速率随含水量增加而持续增高;随着含水量的进一步增加,结皮呼吸速率逐渐趋于稳定[31].然而,在极端环境下,时空分布不均匀的降水活动导致结皮在长期干燥失活状态与短暂湿润激活状态之间频繁切换,进一步加剧了结皮呼吸碳排放的时空异质性.其次,温度也是影响结皮呼吸碳排放的关键因素.随着温度升高,胶衣属、双缘衣属、磷网衣属地衣结皮呼吸碳排放速率均明显增加[29].但该试验仅在0~50 ℃的适温范围内进行的,继续升温是否仍会促进结皮呼吸碳排放,有待进一步深入研究. ...
Photosynthesis of green algal soil crust lichens from arid lands in southern Utah,USA:role of water content on light and temperature responses of CO2 exchange
1
1997
... 极端环境发育的结皮呼吸碳排放速率为0~3.58 μmol·m-2·s-1[17,29](表2).研究表明,水分和温度等环境条件是影响结皮呼吸碳排放的关键.降水可迅速激发结皮呼吸排放碳,促使其经历短暂由物理过程主导的CO2爆发过程.之后结皮吸水并恢复正常生理活动,呼吸碳排放速率提高[30].当结皮处于相对缺水状态时,降水发生后,其呼吸碳排放速率随含水量增加而持续增高;随着含水量的进一步增加,结皮呼吸速率逐渐趋于稳定[31].然而,在极端环境下,时空分布不均匀的降水活动导致结皮在长期干燥失活状态与短暂湿润激活状态之间频繁切换,进一步加剧了结皮呼吸碳排放的时空异质性.其次,温度也是影响结皮呼吸碳排放的关键因素.随着温度升高,胶衣属、双缘衣属、磷网衣属地衣结皮呼吸碳排放速率均明显增加[29].但该试验仅在0~50 ℃的适温范围内进行的,继续升温是否仍会促进结皮呼吸碳排放,有待进一步深入研究. ...
2
2003
... 结皮净光合速率对水分条件极为敏感,能够对细微水分变化做出快速响应.在降水量仅为0.04 mm时,具有极强耐旱能力的藓生双缘衣(Diploschistes muscorum)仍可维持净光合速率的正值.相比之下,坚韧胶衣(Collema tenax)维持净光合速率正值所需的水分条件更高[32].随着降水量增加,结皮含水量增加,其净光合速率逐步提高,然而该现象仅发生于初始结皮含水量相对较低的情况下,当结皮水分含量过高甚至达到饱和状态时,降水反而会抑制结皮净光合速率.不同结皮维持净光合正值的水分含量阈值不同.当降水量由0增加至1.25 mm时,黄衣(Fulgensia fulgen)净光合速率先增大后减低,并逐渐趋近于0,而对于坚韧胶衣,净光合速率则表现为随降水量增加而持续上升,并且在降水量超过2 mm时,坚韧胶衣仍保持净光合速率正值,表现出对湿润环境较强的适应能力.温度同样是影响结皮净光合速率的关键.在温度由冰点变化至50 ℃时,结皮净光合速率均为正值,并且表现出随温度升高表现为先上升后下降的非线性趋势.同样,结皮对温度的响应存在明显的种间差异.例如,脑状鳞网衣(Psora cerebriformis)、双壳双缘衣(Diploschistes diacapsis)净光合速率在温度为10~28 ℃时维持较高水平,而坚韧胶衣则适应更高的温度条件,最大净光合速率出现在30 ℃左右[32].该现象与结皮持水能力有关,坚韧胶衣较强的持水能力能够减缓高温条件下水分的散失,从而维持结皮内部光合酶的活性,保障光合作用运行.综上所述,结皮净光合速率与降水水平、结皮种类、水分含量和温度等因素关系密切. ...
... [32].该现象与结皮持水能力有关,坚韧胶衣较强的持水能力能够减缓高温条件下水分的散失,从而维持结皮内部光合酶的活性,保障光合作用运行.综上所述,结皮净光合速率与降水水平、结皮种类、水分含量和温度等因素关系密切. ...
Characteristics of carbon flux in two biologically crusted soils in the Gurbantunggut Desert,Northwestern China
1
2012
... 结皮对区域碳排放的影响机制主要有3方面:①结皮中细菌、真菌等微生物组分通过呼吸作用释放CO2,增加土壤呼吸碳排放;②结皮发育堵塞土壤孔隙,减少土壤与大气之间的CO2交换,抑制土壤呼吸碳排放[33-34];③结皮发育改变下层土壤的温度和水分等环境条件,间接影响土壤呼吸碳排放[35].结皮发育对土壤碳排放速率的影响取决于多种机制的综合作用.当促进机制超过阻碍机制时,结皮发育促进土壤碳排放速率,反之则抑制.多项研究结果表明,结皮发育对极端环境土壤碳排放的影响表现出明显的地域性差异[8,11,25,36](表3). ...
不同类型生物土壤结皮对土壤呼吸的影响
2
2013
... 结皮对区域碳排放的影响机制主要有3方面:①结皮中细菌、真菌等微生物组分通过呼吸作用释放CO2,增加土壤呼吸碳排放;②结皮发育堵塞土壤孔隙,减少土壤与大气之间的CO2交换,抑制土壤呼吸碳排放[33-34];③结皮发育改变下层土壤的温度和水分等环境条件,间接影响土壤呼吸碳排放[35].结皮发育对土壤碳排放速率的影响取决于多种机制的综合作用.当促进机制超过阻碍机制时,结皮发育促进土壤碳排放速率,反之则抑制.多项研究结果表明,结皮发育对极端环境土壤碳排放的影响表现出明显的地域性差异[8,11,25,36](表3). ...
... 研究表明,结皮发育普遍提高了土壤呼吸碳排放量,但其促进效果存在明显的区域分异[42,55].例如,腾格里沙漠的藻类、苔藓和混生结皮发育后,结皮土壤系统碳排放量分别为60.98~121.41、112.77~145.40、81.67~97.24 g·m-2·a-1,较裸土(70.10~82.15 g·m-2·a-1)增加了19.8%~69.6%[34].而共和盆地的藻类和苔藓结皮发育后,结皮土壤系统碳排放量分别为79.36~236.80、120.26~385.88 g·m-2·a-1,较裸土(60~140 g·m-2·a-1)增加了58.1%~153.1%[8].土壤呼吸碳排放对结皮发育的差异化响应主要在于区域间环境条件的差异.腾格里沙漠的结皮因降水匮乏(年降水量仅186 mm)处于长期干燥失活状态,生理活动被长期抑制.高寒沙区的结皮因降水相对充沛(年降水量为246 mm),维持生理活性的时间更长,内部微生物活动更为频繁,使得其对土壤呼吸性碳排放的促进效果更为明显. ...
Biological soil crusts decrease soil temperature in summer and increase soil temperature in winter in semiarid environment
1
2013
... 结皮对区域碳排放的影响机制主要有3方面:①结皮中细菌、真菌等微生物组分通过呼吸作用释放CO2,增加土壤呼吸碳排放;②结皮发育堵塞土壤孔隙,减少土壤与大气之间的CO2交换,抑制土壤呼吸碳排放[33-34];③结皮发育改变下层土壤的温度和水分等环境条件,间接影响土壤呼吸碳排放[35].结皮发育对土壤碳排放速率的影响取决于多种机制的综合作用.当促进机制超过阻碍机制时,结皮发育促进土壤碳排放速率,反之则抑制.多项研究结果表明,结皮发育对极端环境土壤碳排放的影响表现出明显的地域性差异[8,11,25,36](表3). ...
生物结皮对土壤呼吸的影响作用初探
2
2008
... 结皮对区域碳排放的影响机制主要有3方面:①结皮中细菌、真菌等微生物组分通过呼吸作用释放CO2,增加土壤呼吸碳排放;②结皮发育堵塞土壤孔隙,减少土壤与大气之间的CO2交换,抑制土壤呼吸碳排放[33-34];③结皮发育改变下层土壤的温度和水分等环境条件,间接影响土壤呼吸碳排放[35].结皮发育对土壤碳排放速率的影响取决于多种机制的综合作用.当促进机制超过阻碍机制时,结皮发育促进土壤碳排放速率,反之则抑制.多项研究结果表明,结皮发育对极端环境土壤碳排放的影响表现出明显的地域性差异[8,11,25,36](表3). ...
... /(μmol·m
-2·s
-1)
结皮发育对土壤 碳排放速率 的影响 | 参考 文献 | | 共和盆地 | 藻结皮 | — | 0.43~1.53 | 0.49~2.36 | 促进 | [8] |
| 苔藓结皮 | — | 0.43~1.53 | 0.59~3.13 | 促进 | [8] |
| 黄土高原 | 苔藓结皮 | 极地真藓(Bryum arcticum)、土生扭口藓(Barbula vinealis) | 1.45~2.01 | 1.19~1.66 | 抑制 | [25] |
| 毛乌素沙地 | 藻结皮 | — | 0.50~1.55 | 0.57~1.66 | 促进 | [11] |
| 苔藓结皮 | — | 0.50~1.55 | 0.86~1.95 | 促进 | [11] |
| 科尔沁沙地 | 藻结皮、苔藓结皮 | 蓝藻、真藓 | 0.45~12.35 | 0.40~4.86 | 抑制 | [36] |
结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
腾格里沙漠东南缘生物结皮土壤呼吸对水热因子变化的响应
1
2017
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
干旱区生物结皮土壤呼吸特征及其对增温和降水变化的响应
3
2018
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... [38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... ,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
Seasonal dynamics of soilrespiration and nitrification in three subtropical plantations in southern China
1
2016
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
毛乌素沙地生物结皮覆盖土壤碳通量日动态特征及其影响因子
1
2018
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
库布齐沙漠植被恢复对风沙土壤碳通量与碳储量的影响
2
2022
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... 结皮发育能否改变生态系统的碳收支是研究学者关注的热点.净碳通量是碳排放和光合固碳之间的净差值,是表征区域生态系统碳源汇的关键指标.通常情况下,净碳通量正值表示结皮土壤系统呼吸大于光合,表现为碳源;负值表示光合大于呼吸,表现为碳汇.自然状态下极端环境结皮土壤系统净碳通量为-10.02~5.30 μmol·m-2·s-1[8,10,22,56-57](表4),且存在明显区域间差异.此外,同一区域不同类型结皮土壤系统净碳通量并未表现出明显差异,这是因为相较于低级演替阶段的藻类结皮,苔藓结皮光合固碳能力及呼吸碳排放能力均更强,但其光合固定碳与呼吸排放碳相互抵消,使得苔藓结皮土壤系统净碳通量与藻类无明显差异[41]. ...
高寒沙区生物土壤结皮覆盖土壤碳通量对模拟降水的响应
3
2017
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... 研究表明,结皮发育普遍提高了土壤呼吸碳排放量,但其促进效果存在明显的区域分异[42,55].例如,腾格里沙漠的藻类、苔藓和混生结皮发育后,结皮土壤系统碳排放量分别为60.98~121.41、112.77~145.40、81.67~97.24 g·m-2·a-1,较裸土(70.10~82.15 g·m-2·a-1)增加了19.8%~69.6%[34].而共和盆地的藻类和苔藓结皮发育后,结皮土壤系统碳排放量分别为79.36~236.80、120.26~385.88 g·m-2·a-1,较裸土(60~140 g·m-2·a-1)增加了58.1%~153.1%[8].土壤呼吸碳排放对结皮发育的差异化响应主要在于区域间环境条件的差异.腾格里沙漠的结皮因降水匮乏(年降水量仅186 mm)处于长期干燥失活状态,生理活动被长期抑制.高寒沙区的结皮因降水相对充沛(年降水量为246 mm),维持生理活性的时间更长,内部微生物活动更为频繁,使得其对土壤呼吸性碳排放的促进效果更为明显. ...
... 降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
干旱沙区生物土壤结皮覆盖土壤CO2对脉冲式降雨的响应
2
2016
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... 降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
固沙植被区两类结皮斑块土壤呼吸对不同频率干湿交替的响应
2
2015
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
... [44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
Winter snowfall can have a positive effect on photosynthetic carbon fixation and biomass accumulation of biological soil crusts from the Gurbantunggut Desert,China
1
2016
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
黄土高原藓结皮土壤呼吸速率对降雨量变化的响应
1
2022
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
极端降雨事件对不同类型生物土壤结皮覆盖土壤碳释放的影响
1
2013
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
干旱区不同降雨模式对藻结皮覆被区土壤碳释放的影响
1
2020
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
Soil moisture modifies the response of soil respiration to temperature in a desert shrub ecosystem
1
2014
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
模拟增温对荒漠生物土壤结皮-土壤系统CO2、CH4和N2O通量的影响
1
2014
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
Effect of warming and grazing on litter mass loss and temperature sensitivity of litter and dung mass loss on the Tibetan plateau
1
2010
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
生物结皮-土壤呼吸对冬季低温及模拟增温的响应
1
2016
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
模拟增温对高寒沙区生物土壤结皮-土壤系统呼吸的影响
1
2020
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
Warming effects on soil respiration in moss-dominated crusts in the Tengger Desert, Northern China
1
2019
... 结皮类型、降水及温度是造成区域间结皮发育对土壤碳排放影响存在明显差异的主导因素.多数研究表明,藓类结皮土壤系统碳排放速率高于藻-地衣结皮[37-38],前者有较多的底物含量、微生物数量以及较强的持水能力,结皮土壤系统自养及异养呼吸速率相对较高[39].自然状态下,结皮土壤系统碳排放速率日、月动态均呈明显的单峰变化规律[11,40],而土壤水分及温度变化是造成结皮土壤系统碳排放变化的关键[8,41].小降水事件是极端环境条件补充土壤水分的主要途径.降水发生后,土壤含水量提高,微生物活性增强,从而激发了结皮土壤系统呼吸碳排放[42-44].单次降水量是调控结皮土壤系统碳排放速率的关键.在一定范围内,单次降水量越高,结皮土壤系统碳排放速率越强[45].当降水量超过某一阈值时,结皮发育对土壤碳排放的激发作用降低,甚至出现抑制[43,46].主要是过量降水导致土壤水分饱和或发生积水,阻碍土壤与大气之间的气体交换,限制氧气进入土壤孔隙,从而抑制微生物有氧分解代谢过程,最终降低结皮土壤系统碳排放速率[47].降水频率也是调控结皮土壤系统碳排放速率的关键因素.在总降水量恒定的情况下,随着降水频率增加,结皮土壤系统碳排放对降水的敏感度降低,碳排放速率也随之减少[44,48].该现象与土壤有机质的减少以及微生物对水分适应性的增强密切相关.增温对结皮土壤系统碳排放的影响较为复杂,增温后结皮土壤系统碳排放可能增加、减少[38]或不变[49-50].适度增温通过提高土壤微生物丰度及酶活性,加快微生物生长和分解代谢活动,促进结皮土壤系统呼吸碳排放[51].而过高温度破坏微生物结构,造成酶失活,并且加速水分蒸发,降低水分有效性,抑制土壤呼吸碳排放[27,38,52].高寒沙区的研究表明生长季温度增幅超过1.5 ℃可降低苔藓、藻类结皮土壤系统呼吸速率[53-54]. ...
毛乌素沙地南缘沙丘生物结皮中微生物数量及其影响因素
1
2014
... 研究表明,结皮发育普遍提高了土壤呼吸碳排放量,但其促进效果存在明显的区域分异[42,55].例如,腾格里沙漠的藻类、苔藓和混生结皮发育后,结皮土壤系统碳排放量分别为60.98~121.41、112.77~145.40、81.67~97.24 g·m-2·a-1,较裸土(70.10~82.15 g·m-2·a-1)增加了19.8%~69.6%[34].而共和盆地的藻类和苔藓结皮发育后,结皮土壤系统碳排放量分别为79.36~236.80、120.26~385.88 g·m-2·a-1,较裸土(60~140 g·m-2·a-1)增加了58.1%~153.1%[8].土壤呼吸碳排放对结皮发育的差异化响应主要在于区域间环境条件的差异.腾格里沙漠的结皮因降水匮乏(年降水量仅186 mm)处于长期干燥失活状态,生理活动被长期抑制.高寒沙区的结皮因降水相对充沛(年降水量为246 mm),维持生理活性的时间更长,内部微生物活动更为频繁,使得其对土壤呼吸性碳排放的促进效果更为明显. ...
Carbon flux in deserts depends on soil cover type:a case study in the Gurbantunggute Desert,North China
5
2013
... 结皮发育能否改变生态系统的碳收支是研究学者关注的热点.净碳通量是碳排放和光合固碳之间的净差值,是表征区域生态系统碳源汇的关键指标.通常情况下,净碳通量正值表示结皮土壤系统呼吸大于光合,表现为碳源;负值表示光合大于呼吸,表现为碳汇.自然状态下极端环境结皮土壤系统净碳通量为-10.02~5.30 μmol·m-2·s-1[8,10,22,56-57](表4),且存在明显区域间差异.此外,同一区域不同类型结皮土壤系统净碳通量并未表现出明显差异,这是因为相较于低级演替阶段的藻类结皮,苔藓结皮光合固碳能力及呼吸碳排放能力均更强,但其光合固定碳与呼吸排放碳相互抵消,使得苔藓结皮土壤系统净碳通量与藻类无明显差异[41]. ...
... /(μmol·m
-2·s
-1)
参考文献 | | 纳米比亚沙漠 | 地衣结皮 | 荒漠微孢衣 | -10.02~3.01 | [22] |
| 橙衣属 | -7.25~1.88 | [22] |
| 小网衣属 | -6.21~1.02 | [22] |
| 古尔班通古特沙漠 | 苔藓结皮 | — | -0.28~1.18 | [56] |
| 藻结皮、地衣结皮 | — | -0.18~1.20 | [56] |
| 共和盆地 | 藻结皮 | — | -0.01~4.83 | [8] |
| 苔藓结皮 | — | 0.20~5.10 | [8] |
| 毛乌素沙地 | 藻结皮 | — | -0.18~1.43 | [57] |
| 苔藓结皮 | — | -1.24~1.38 | [57] |
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... [
56]
| 共和盆地 | 藻结皮 | — | -0.01~4.83 | [8] |
| 苔藓结皮 | — | 0.20~5.10 | [8] |
| 毛乌素沙地 | 藻结皮 | — | -0.18~1.43 | [57] |
| 苔藓结皮 | — | -1.24~1.38 | [57] |
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... 降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... 结皮发育对极端环境生态系统碳源汇的长期效应已得到了深入研究.多数研究表明,结皮发育促进了生态系统的长期碳源效应,且促进效果存在明显区域分异.例如,古尔班通古特沙漠的藻类、苔藓结皮发育后,结皮土壤系统净碳通量分别为23.1~48.2、30.0~48.5 g·m-2·a-1,较裸土(10~45 g·m-2·a-1)增加了29.6%~42.7%[56].共和盆地以苔藓、藻类为优势种的结皮发育后,结皮土壤系统净碳通量分别为117~354、75.2~208 g·m-2·a-1,较裸土(75~130 g·m-2·a-1)增加了38.1%~129.8%[8].与古尔班通古特沙漠相比,降水较为充沛的高寒沙区,结皮发育后对生态系统碳源的促进效应更为显著.尽管古尔班通古特沙漠的年平均温度(7.3 ℃)高于共和盆地(2.4 ℃),但受当地降水条件的制约,增温对结皮土壤系统碳源效应的促进作用受到抑制.类似的科罗拉多高原的研究表明,自然状态下,结皮土壤系统净碳通量为47 g·m-2·a-1,而在增温和增雨后,结皮土壤系统净碳通量增加到69~87 g·m-2·a-1,证实了增雨及增温条件对结皮土壤系统乃至区域生态环境碳源效应的促进作用[61]. ...
两类典型荒漠生物结皮覆盖土壤碳通量月变化特征及其影响因子
3
2021
... 结皮发育能否改变生态系统的碳收支是研究学者关注的热点.净碳通量是碳排放和光合固碳之间的净差值,是表征区域生态系统碳源汇的关键指标.通常情况下,净碳通量正值表示结皮土壤系统呼吸大于光合,表现为碳源;负值表示光合大于呼吸,表现为碳汇.自然状态下极端环境结皮土壤系统净碳通量为-10.02~5.30 μmol·m-2·s-1[8,10,22,56-57](表4),且存在明显区域间差异.此外,同一区域不同类型结皮土壤系统净碳通量并未表现出明显差异,这是因为相较于低级演替阶段的藻类结皮,苔藓结皮光合固碳能力及呼吸碳排放能力均更强,但其光合固定碳与呼吸排放碳相互抵消,使得苔藓结皮土壤系统净碳通量与藻类无明显差异[41]. ...
... /(μmol·m
-2·s
-1)
参考文献 | | 纳米比亚沙漠 | 地衣结皮 | 荒漠微孢衣 | -10.02~3.01 | [22] |
| 橙衣属 | -7.25~1.88 | [22] |
| 小网衣属 | -6.21~1.02 | [22] |
| 古尔班通古特沙漠 | 苔藓结皮 | — | -0.28~1.18 | [56] |
| 藻结皮、地衣结皮 | — | -0.18~1.20 | [56] |
| 共和盆地 | 藻结皮 | — | -0.01~4.83 | [8] |
| 苔藓结皮 | — | 0.20~5.10 | [8] |
| 毛乌素沙地 | 藻结皮 | — | -0.18~1.43 | [57] |
| 苔藓结皮 | — | -1.24~1.38 | [57] |
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
... [
57]
| 黄土高原 | 藻结皮 | 点形黏球藻(Gloeocapsa punctata)、席藻属 | 0.13~2.00 | [10] |
| 苔藓结皮 | 短叶扭口藓(Barbula tectorum) | -1.02~1.40 | [10] |
降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
模拟降水对古尔班通古特沙漠生物结皮表观土壤碳通量的影响
1
2012
... 降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
Biocrusts modulate carbon losses under warming across global drylands:a bayesian meta-analysis
1
2024
... 降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
增温对生物土壤结皮微生物群落组成及其呼吸作用的影响
1
2024
... 降水以及温度变化是调控极端环境结皮土壤系统碳源汇效应的重要因素.降水通过调节结皮光合固碳作用和呼吸碳排放过程影响结皮土壤系统净碳通量[23].多数情况下,降水发生后的短暂时间内,结皮土壤系统碳排放迅速攀升至峰值;结皮光合固碳作用被激发,结皮土壤系统净碳通量随即下降,甚至可能转变为负值;经过一段时间后,结皮土壤系统逐渐恢复至降水前的弱碳源水平[42-43,58].此外,降水量越高,结皮湿润时间越长,激发的结皮土壤系统固碳量和释放总量越多.温度变化通过影响微生物活性及丰富度,调节结皮土壤系统的光合固碳及呼吸碳排放过程,进而影响结皮土壤系统的净碳通量[56].大量增温实验结果表明,增温同时提高结皮土壤系统光合固碳及呼吸碳排放,但对呼吸碳排放促进效果更为显著,从而增强结皮土壤系统的碳源效应;但增温幅度过高,受水分条件限制,结皮土壤系统碳源效应增加效应受到抑制[8,59].增温时长同样影响结皮土壤系统净碳通量对增温响应程度.短期增温(<2 a)促进或抑制结皮土壤系统的净碳通量,长期增温(>5 a)引起结皮优势种变化,降低生物对温度和湿度变化的敏感性,使结皮土壤系统净碳通量在增温条件下维持相对稳定状态[60]. ...
Annual CO2 flux from a biological soil crust system on the Colorado Plateau:effects of increased temperature and summer precipitation
1
2007
... 结皮发育对极端环境生态系统碳源汇的长期效应已得到了深入研究.多数研究表明,结皮发育促进了生态系统的长期碳源效应,且促进效果存在明显区域分异.例如,古尔班通古特沙漠的藻类、苔藓结皮发育后,结皮土壤系统净碳通量分别为23.1~48.2、30.0~48.5 g·m-2·a-1,较裸土(10~45 g·m-2·a-1)增加了29.6%~42.7%[56].共和盆地以苔藓、藻类为优势种的结皮发育后,结皮土壤系统净碳通量分别为117~354、75.2~208 g·m-2·a-1,较裸土(75~130 g·m-2·a-1)增加了38.1%~129.8%[8].与古尔班通古特沙漠相比,降水较为充沛的高寒沙区,结皮发育后对生态系统碳源的促进效应更为显著.尽管古尔班通古特沙漠的年平均温度(7.3 ℃)高于共和盆地(2.4 ℃),但受当地降水条件的制约,增温对结皮土壤系统碳源效应的促进作用受到抑制.类似的科罗拉多高原的研究表明,自然状态下,结皮土壤系统净碳通量为47 g·m-2·a-1,而在增温和增雨后,结皮土壤系统净碳通量增加到69~87 g·m-2·a-1,证实了增雨及增温条件对结皮土壤系统乃至区域生态环境碳源效应的促进作用[61]. ...
Exploring some relationships between biological soil crusts,soil aggregation and wind erosion
1
2003
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
Biocrust succession improves soil aggregate stability of subsurface after “Grain for Green” project in the hilly Loess Plateau,China
1
2022
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
黄土丘陵区退耕地生物结皮对土壤理化性状的影响
1
2006
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
生物土壤结皮对土壤微生物量碳的影响
1
2012
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
生物土壤结皮对荒漠区土壤微生物生物量的影响
2014
生物结皮演替对黄土高原水蚀风蚀交错区土壤氮素转化及微生物活性的促进效应
1
2023
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
荒漠区生物土壤结皮对土壤酶活性的影响
1
2015
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
Initial soil formation by biocrusts:nitrogen demand and clay protection control microbial necromass accrual and recycling
2
2022
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
... [70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
Labile carbon in biological soil crusts in the Tabernas Desert,SE Spain
1
2013
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
Soil nitrogen and climate drive the positive effect of biological soil crusts on soil organic carbon sequestration in drylands:a meta-analysis
1
2022
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
Relationships between soil crust development and soil properties in the desert region of North China
1
2017
... 结皮发育提高了土壤有机碳含量:①结皮发育增加地表粗糙度,拦截并积累大量富含有机碳的土壤细颗粒物质.②结皮内部假根和菌丝结构的机械束缚作用,以及微生物分泌物的高黏性,稳定表层土壤,降低土壤侵蚀造成的有机碳流失.部分研究表明,当结皮覆盖度从0增加到100%时,土壤流失量减少接近两个数量级[62].③结皮发育改善了土壤理化性质.与裸土相比,结皮发育后,表层土壤的黏粒、粉粒含量及土壤团聚体平均重量直径、全量养分及速效养分均明显增加[63-65].④结皮发育增加下层土壤微生物数量及活性[66-68],提高微生物的碳转化效率[69],加速生物残体的分解.分解产生的大量微生物残体成为下层土壤各组分有机碳的主要来源[70].研究表明在结皮发育的前期阶段,矿物结合态有机碳迅速积累并快速达到饱和状态;在结皮发育后期,颗粒有机碳含量则呈现出明显的增加趋势[70-71].整合分析结果发现,与裸土相比,结皮发育增加了70.9%土壤有机碳含量,其中苔藓、地衣和藻类结皮发育土壤有机碳含量分别增加了67.5%、82.8%和58.2%[72].苔藓和地衣结皮因其较强的光合固碳能力、复杂的菌丝结构以及丰富的微生物数量,增加了有机碳输入、有机质转化以及有机碳的物理固定过程,使得其土壤有机碳含量远高于藻类结皮.然而,由于结皮厚度的限制,结皮发育对土壤有机碳固存作用主要局限于土壤表面[73]. ...
Contributions of hypolithic communities to surface soil organic carbon across a hyperarid-to-arid climate gradient
1
2023
... 除此之外,在维管植物分布稀疏的极端环境下,结皮在土壤有机碳储量中仍占据着关键地位.例如,纳米布沙漠的研究表明结皮缺失会导致表层土壤有机碳库碳储量减少10%~20%[74].因此,极端环境下结皮发育对土壤有机碳及碳储量的贡献至关重要. ...
Evolution of soil respiration depends on biological soil crusts across a 50-year chronosequence of desert revegetation
1
2016
... 尽管结皮对极端环境碳循环的影响已被广泛认可,但影响程度尚未形成明确共识,主要存在以下两方面原因:一方面结皮发育对结皮土壤系统与大气碳交换的影响对环境条件极为敏感,能够对细微环境变化做出快速响应,从而表现出明显的地域性差异.另一方面现有研究在研究方法、时间尺度、研究对象等方面存在较大差异,导致结果可对比性较低.首先,指标测定方法尚未统一.对于结皮光合固碳速率测定,常见的测定方法包括室内模拟测定和原位测定两种.然而这两种测定方法在对环境条件的考量方面存在显著差异.相较于原位测定,室内模拟的恒定环境条件,未能充分考虑自然环境变化对结皮光合、呼吸的影响,从而造成测定结果存在偏差[75-77].其次,指标监测时长参差不齐.有关光合、呼吸及净碳排放等指标的野外监测时长从日、月、季节到年尺度不等,增加了不同研究结果之间的对比难度.第三,研究对象可重复性低.结皮分布具有高度异质性,在选择重复样品时,难以确保各样品总盖度、分盖度以及各优势种盖度完全一致,导致研究结果代表性不足,结论可靠性与普适性较低.且大多数研究聚焦于藻类、苔藓等某一种结皮类型,往往忽视了不同优势种间结皮光合及呼吸等指标的差异.此外,监测技术手段不同.例如,多数研究探究增温对结皮土壤系统碳排放的影响时,采用主动增温与被动增温两种方式进行变量控制.然而,主动增温能够实现环境的恒温控制,而被动增温则表现为脉冲型增温,可能改变土壤微生物的群落结构和代谢活性,进而影响结皮土壤系统碳排放,影响实验结果. ...
Water relations and CO2 exchange of the terrestrial lichen Teloschistes capensis in the Namib Fog Desert:measurements during two seasons in the field and under controlled conditions
2006
Precipitation and topsoil attributes determine the species diversity and distribution patterns of crustal communities in desert ecosystems
1
2017
... 尽管结皮对极端环境碳循环的影响已被广泛认可,但影响程度尚未形成明确共识,主要存在以下两方面原因:一方面结皮发育对结皮土壤系统与大气碳交换的影响对环境条件极为敏感,能够对细微环境变化做出快速响应,从而表现出明显的地域性差异.另一方面现有研究在研究方法、时间尺度、研究对象等方面存在较大差异,导致结果可对比性较低.首先,指标测定方法尚未统一.对于结皮光合固碳速率测定,常见的测定方法包括室内模拟测定和原位测定两种.然而这两种测定方法在对环境条件的考量方面存在显著差异.相较于原位测定,室内模拟的恒定环境条件,未能充分考虑自然环境变化对结皮光合、呼吸的影响,从而造成测定结果存在偏差[75-77].其次,指标监测时长参差不齐.有关光合、呼吸及净碳排放等指标的野外监测时长从日、月、季节到年尺度不等,增加了不同研究结果之间的对比难度.第三,研究对象可重复性低.结皮分布具有高度异质性,在选择重复样品时,难以确保各样品总盖度、分盖度以及各优势种盖度完全一致,导致研究结果代表性不足,结论可靠性与普适性较低.且大多数研究聚焦于藻类、苔藓等某一种结皮类型,往往忽视了不同优势种间结皮光合及呼吸等指标的差异.此外,监测技术手段不同.例如,多数研究探究增温对结皮土壤系统碳排放的影响时,采用主动增温与被动增温两种方式进行变量控制.然而,主动增温能够实现环境的恒温控制,而被动增温则表现为脉冲型增温,可能改变土壤微生物的群落结构和代谢活性,进而影响结皮土壤系统碳排放,影响实验结果. ...



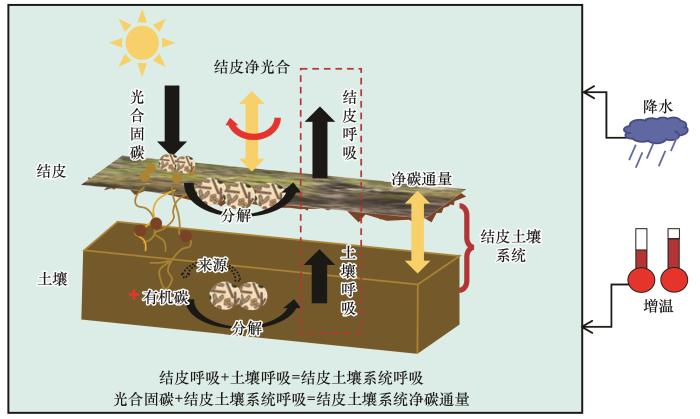

 甘公网安备 62010202000688号
甘公网安备 62010202000688号