荒漠生物土壤结皮碳降解菌株的筛选鉴定及特性分析
赵丽娜 , , 谢燚谛 , 贺子康 , 柴梦洋 , 高源婧坤 , 吴影 , 张杰 , 古绍彬 ,
河南科技大学 食品与生物工程学院,河南 洛阳 471000
Screening , identification and characterization of carbon -degrading strains in biological soil crusts of desert ecosystems
Zhao Lina , , Xie Yidi , He Zikang , Chai Mengyang , Gao Yuanjingkun , Wu Ying , Zhang Jie , Gu Shaobin ,
College of Food and Bioengineering,Henan University of Science and Technology,Luoyang 471000,Henan,China
通讯作者: 古绍彬(E-mail: shaobingu@haust.edu.cn )
收稿日期: 2024-11-17
修回日期: 2025-02-17
基金资助:
国家自然科学基金青年科学基金项目 . 32201383 河南省重大科技专项项目 . 231100310200 河南省重点研发项目 . 241111314200
Received: 2024-11-17
Revised: 2025-02-17
摘要
生物土壤结皮(Biological Soil Crusts)是荒漠生态系统的关键组成,其中蕴含的丰富多样的碳降解菌株能够将有机碳转化为无机碳形式,在促进有机质分解和维持荒漠生态系统碳循环过程中发挥着重要作用。本研究选取沙坡头固沙植被区的生物土壤结皮为研究对象,旨在筛选并鉴定具有不同碳源类型降解能力的功能菌株,并评估其酶活性。结果显示:菌株D7、D8的淀粉酶活性最高,分别为1.52、1.69 U·mL-1 ;G5菌株的果胶酶活性最高,为1.01 U·mL-1 ;菌株X2、X5的纤维素酶活性最高,分别为1.59、2.19 U·mL-1 ;通过苯胺蓝脱色法测定,M1菌株显示出较强的木质素过氧化物酶活性。经过分子生物学鉴定,这些菌株主要包括Pantoea alhagi (D7、D8、X5)、Bacillus subtilis (X2)、Erwinia piriflorinigrans (G5)和Cupriavidus respiracul (M1)。
关键词:
生物土壤结皮 碳降解菌株 碳循环 荒漠化
Abstract
Biological soil crusts (BSCs) are integral to desert ecosystems, facilitating the conversion of organic carbon to inorganic forms through a diverse array of carbon-degrading strains, thereby promoting the decomposition of organic matter and the carbon cycle in desert ecosystems. This study focused on BSCs from the Shapotou sand-fixing vegetation area, aiming to screen and identify functional strains with the ability to degrade different types of carbon sources and to evaluate their enzyme activities. The results showed that strains D7 and D8 had the highest amylase activity, at 1.52 U·mL-1 and 1.69 U·mL-1 , respectively; strain G5 had the highest pectinase activity, at 1.01 U·mL-1 ; strains X2 and X5 had the highest cellulase activity, at 1.59 U·mL-1 and 2.19 U·mL-1 , respectively. Strain M1 displayed significant lignin peroxidase activity as determined by the aniline blue decolorization assay. Molecular biological identification revealed that these strains primarily belong to Pantoea alhagi (D7、D8、X5), Bacillus subtilis (X2), Erwinia piriflorinigrans (G5), and Cupriavidus respiraculi (M1).
Keywords:
biological soil crusts carbon-degrading strains carbon cycle desertification
本文引用格式
赵丽娜, 谢燚谛, 贺子康, 柴梦洋, 高源婧坤, 吴影, 张杰, 古绍彬. 荒漠生物土壤结皮碳降解菌株的筛选鉴定及特性分析 . 中国沙漠 [J], 2025, 45(3): 185-190 doi:10.7522/j.issn.1000-694X.2025.00011
Zhao Lina, Xie Yidi, He Zikang, Chai Mengyang, Gao Yuanjingkun, Wu Ying, Zhang Jie, Gu Shaobin. Screening , identification and characterization of carbon -degrading strains in biological soil crusts of desert ecosystems Journal of Desert Research
0 引言
荒漠化作为全球性问题,已经成为人类经济社会可持续发展的重大挑战。中国荒漠化土地面积达2.63×106 km2 ,荒漠化已严重威胁生态安全、粮食安全和经济安全,每年造成的直接经济损失约642亿元、间接经济损失889亿元[1 ] 。荒漠化土地的恢复和重建成为人类社会亟待解决的问题。
生物土壤结皮(Biological soil crusts, BSC)是由细菌、真菌、古菌、藻类、地衣、藓类以及其他微小生物体通过菌丝体、假根和多聚糖分泌物等与土壤表层微小颗粒胶结形成的复合生物系统[2 ] 。作为干旱区生态系统的关键组成,BSC在调节土壤生态水文过程、维持生物地球化学循环及促进生态修复等方面发挥着不可替代的作用[3 -5 ] 。微生物群落作为BSC碳氮循环过程的核心驱动者,对生态系统养分归还和多功能性(multifunctionality)维持具有重要作用[6 -8 ] 。其中,碳降解菌株通过分泌胞外酶(淀粉酶、纤维素酶、木质素过氧化物酶等)将复杂有机碳化合物降解为简单的可溶性碳源,继而通过细胞呼吸作用将这些碳源氧化为CO2 ,同时将部分有机碳转化为微生物生物量,构建了完整的碳素转化网络[9 -10 ] 。在BSC碳降解过程中,细菌和真菌群落表现出明显的功能分工:细菌群落主要参与淀粉、果胶、半纤维素、纤维素、几丁质和芳烃等物质的降解,而真菌群落则在降解复杂的木质素结构方面发挥着更为关键的作用[6 ] 。这些协同降解机制不仅确保了土壤碳循环的有效运转,而且维持了有机碳在生态系统中的持续循环,对生态系统的稳定性具有重要意义。然而,目前对荒漠生态系统BSC中碳降解菌株的系统研究仍显不足,尤其缺乏对具有多重碳源降解能力的功能菌株的深入挖掘,这在一定程度上限制了我们对荒漠生态系统碳循环微生物调控机制的深入认知。
本研究以腾格里沙漠东南缘沙坡头人工固沙植被区的BSCs与流沙为研究对象,对其碳降解菌株进行筛选、鉴定及酶活性测试,以期获得荒漠BSC优势碳降解菌株。这不仅将丰富我们对荒漠生态系统中功能微生物资源的认识和理解,而且将为荒漠化地区的生态恢复和重建提供坚实的理论基础。
1 材料与方法
1.1 材料
1.1.1 样品来源
供试BSCs与流沙样品采集自腾格里沙漠东南缘沙坡头固沙植被区(37°32′N、105°02′E;海拔1 330 m)。该研究区主要的景观为高大密集分布的格状沙丘,多年平均气温10 ℃(低温极值为-25 ℃;高温极值为38.1 ℃),多年平均降水量186 mm,集中在5—9月),年蒸发量3 000 mm,年平均风速2.9 m·s-1[11 ] 。2024年3月,对距离植被至少2 m的藻类结皮、地衣结皮和藓类结皮,以及流沙进行采集,样品采集后保存于无菌采样袋中,于4 ℃冰箱中保存备用。
1.1.2 培养基
淀粉培养基:可溶性淀粉2.0 g·L-1 ,牛肉膏5.0 g·L-1 ,胰蛋白胨10.0 g·L-1 ,NaCl 5.0 g·L-1 ,pH 7.0~7.2,固体培养基加2%琼脂粉。
果胶培养基:果胶8.0 g·L-1 ,NH4 Cl 1.4 g·L-1 ,KH2 PO4 2.0 g·L-1 ,K2 HPO4 ·3H2 O 6.0 g·L-1 ,MgSO4 ·7H2 O 0.1 g·L-1 ,pH自然,固体培养基加2%琼脂粉。
纤维素固体培养基:羧甲基纤维素钠10.0 g·L-1 ,蛋白胨2.5 g·L-1 ,Na2 HPO4 2.5 g·L-1 ,pH 7.0~7.2,固体培养基加2%琼脂粉。
木质素固体培养基:蛋白胨1.0 g·L-1 ,木质素3.0 g·L-1 ,NaCl 5.0 g·L-1 ,pH自然,固体培养基加2%琼脂粉。
LB-苯胺蓝培养基:将5 mL 1%的苯胺蓝溶液加入到500 mL液体LB培养基(胰蛋白胨10.0 g·L-1 ,酵母粉5.0 g·L-1 ,NaCl 10.0 g·L-1 ,pH 7.0~7.2)中。
1.2 方法
1.2.1 菌株筛选及复筛
称取样品1 g,置于9 mL无菌生理盐水中,28 ℃、180 r·min-1 振荡富集2 h;移液器吸取悬液200 μL分别涂布于淀粉、果胶、纤维素、木质素固体培养基上,28 ℃倒置培养3~4 d,初步认为能够在选择培养基中生长的菌株具有降解该碳源的能力。随后观察选择性平板上的菌落形态特征,并多次划线纯化。
将选择固体培养基得到的菌落形态不一的菌株分别接种于20 mL液体发酵培养基进行培养,将发酵液10 000 r·min-1 离心5 min,取上清液作为粗酶液,测定其碳降解酶活性,并确定优势碳降解菌株。
1.2.2 酶活性测定
参考赵蓉等[12 ] 、张小丹[13 ] 、陈欢等[14 ] 描述的DNS法分别测定菌株淀粉酶、果胶酶和纤维素酶活性,粗酶液与DNS试剂反应后在540 nm处测量其OD值并计算其酶活性。参考唐云梦[15 ] 描述的方法筛选具有产生木质素过氧化物酶的菌株,将5 μL菌株发酵液点种于苯胺蓝固体培养基中心,30 ℃培养3 d,期间观察菌落透明圈出现与否及大小。
1.2.3 16S rRNA 测序及系统发育树构建
采用索莱宝公司的细菌DNA提取试剂盒对菌株DNA进行提取,以细菌基因组DNA为模板,以27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTACGACTT-3')为引物进行PCR扩增。所得PCR产物经琼脂糖凝胶电泳检测,在1 500 bp左右处可观察到明显条带,PCR产物由生工生物工程股份有限公司测序。对获得的序列进行BLAST比对,并通过 Mega 11软件进行系统发育树的构建。
2 结果与分析
2.1 样品菌株的分离及筛选结果
本试验从BSCs及流沙样品中筛选获得淀粉降解菌株8株(分别命名为D1、D2、D3、D4、D5、D6、D7、D8)、果胶降解菌株5株(分别命名为G1、G2、G3、G4、G5)、纤维素降解菌株5株(分别命名为X1、X2、X3、X4、X5)、木质素降解菌株8株(分别命名为M1、M2、M3、M4、M5、M6、M7、M8)。
2.2 菌株水解酶活性
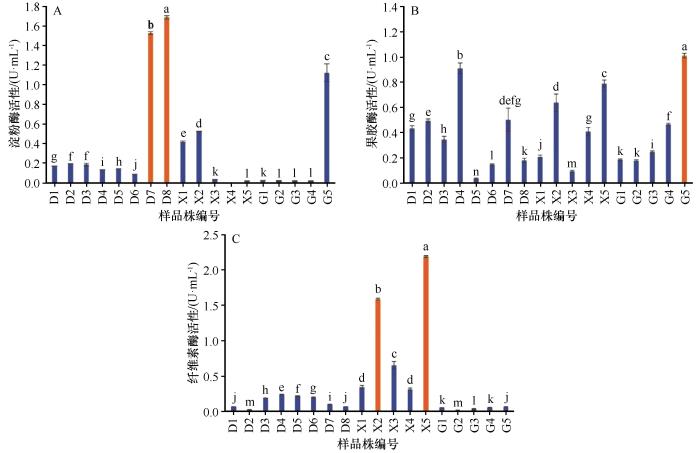
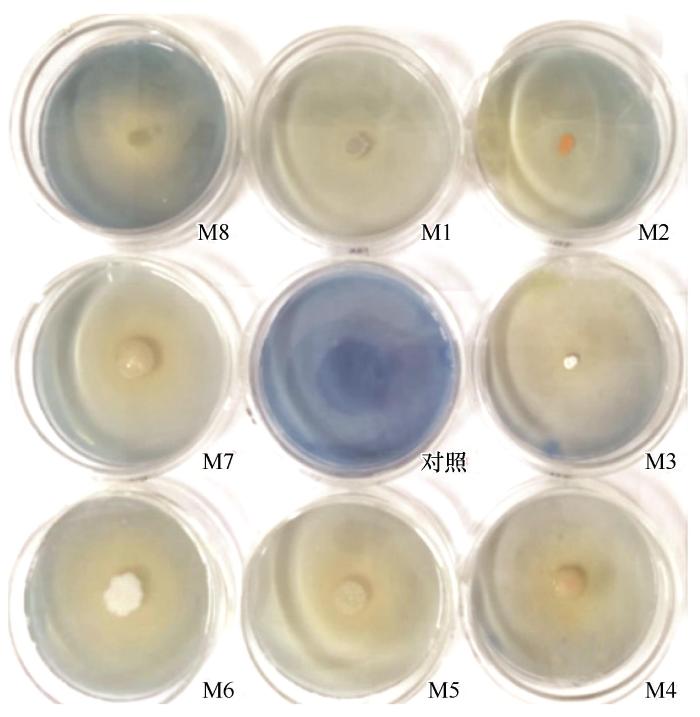
本研究使用DNS法评估不同菌株对淀粉、果胶和纤维素的水解能力,并据此评估其相应的酶活性。淀粉酶活性的评估基于菌株水解淀粉生成麦芽糖的量。结果显示,淀粉降解菌株D7和D8表现出最高的淀粉酶活性,分别为1.52 U·mL-1 和1.69 U·mL-1 ,被认定为优势淀粉降解菌株(图1 )。果胶酶活性的评估基于菌株水解果胶生成半乳糖醛酸的量。结果显示,果胶降解菌株G5具有最高的果胶酶活性(1.01 U·mL-1 ),被认定为优势果胶降解菌株。纤维素酶活性的评估基于菌株水解羧甲基纤维素钠生成葡萄糖的量。结果显示,纤维素降解菌株X2和X5具有最高的纤维素酶活性,分别为1.59 U·mL-1 和2.19 U·mL-1 ,被认定为优势纤维素降解菌株。同时,研究发现具有果胶降解能力的菌株G5也显示出较高的淀粉酶活性(>1.0 U·mL-1 ),表明其降解果胶和淀粉的能力均较优;而具有淀粉降解能力的菌株D4也显示出较高的果胶酶活性(>0.9 U·mL-1 )。此外,使用苯胺蓝脱色法测定菌株木质素过氧化物酶活性发现,菌株M1可能是木质素降解优势菌株(图2 )。
图1
图1
菌株水解酶活性
Fig.1
Hydrolase activities of strains
图2
图2
菌株在LB-苯胺蓝固体培养基上产生脱色圈
Fig.2
Strains produced decolorization circles on the plates of LB-aniline blue
2.3 碳降解优势菌株的鉴定
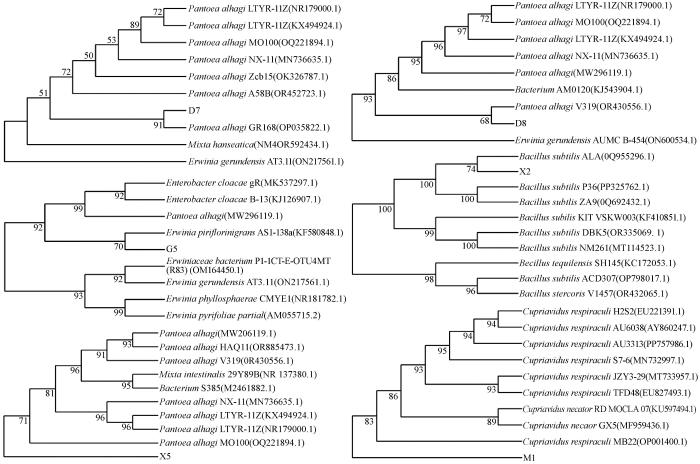
根据上述水解酶活性测试结果,本研究选定菌株D7、D8、G5、X2、X5和M1为荒漠生态系统优势碳降解菌株。为进一步确认6株优势碳降解菌株的种属关系,通过细菌基因组DNA提取试剂盒分别提取菌株的基因组DNA,以27F和1492R为上下游引物进行PCR扩增,扩增出约1 500 bp的特异条带并进行测序。测序结果经NCBI数据库比对,并通过Mega 11软件构建系统发育树显示:D7、D8和X5菌株被鉴定为Pantoea alhagi ;X2菌株被鉴定为枯草芽孢杆菌(Bacillus subtilis );G5菌株被鉴定为Erwinia piriflorinigrans ;M1菌株被鉴定为Cupriavidus respiraculi (图3 )。
图3
图3
优势碳降解菌株16S rDNA基因序列的系统发育树
Fig.3
Phylogenetic trees of dominate carbon degrading strains based on 16S rDNA sequences
3 讨论
在碳降解过程中,BSC微生物通过分泌多种胞外酶将土壤微生物及微小动物的死亡组织、隐花植物及灌木植被的凋落物等复杂有机碳化合物降解为可溶性小分子物质。这些物质一部分被微生物吸收转化为生物量,一部分通过微生物呼吸作用分解为CO2 释放至大气,还有一部分则与土壤矿物质结合形成稳定的土壤有机碳库,显著影响着土壤碳库的动态平衡[16 -20 ] 。
不同类型BSC中碳降解酶活性存在显著差异。Miralles等[21 ] 研究塔韦纳斯沙漠BSC碳降解相关水解酶活性发现,地衣为主BSC表现出最高的水解酶活性,且降解低分子量底物的酶活性普遍高于降解高分子量底物(纤维素和蛋白质)的酶活性。这种差异性反映了BSC微生物群落对不同碳源的选择性利用策略。Xu等[22 ] 发现,藓类为主BSC能够产生较其他类型BSC更多的难降解碳基质,进而促进对难降解碳具有偏好性的真菌群落的富集。值得注意的是,我们前期利用GeoChip 5.0功能基因芯片研究BSC碳降解过程发现,BSC中的细菌和真菌群落在碳降解过程中表现出明显的功能互补和协同作用[6 ] 。细菌群落的放线菌门(主要为链霉菌属)和变形菌门主要通过amyA 基因调控淀粉降解途径,而真菌群落的担子菌门(主要为栓菌属和平革菌属)和子囊菌门主要通过phenol oxidase 基因调控木质素降解途径,这种功能分工可能通过共代谢途径提高碳基质的降解效率[6 ] 。此外,真菌群落在难降解碳降解过程中的巨大贡献也被Boer等[23 ] 和Schneider等[24 ] 的研究所揭示,而曲霉属和毛壳菌属(Chaetomium )也被证实为难降解碳降解过程中的优势功能菌属[6 ] 。
值得注意的是,BSC中碳降解菌株间可能存在复杂的生态互作关系。例如,某些菌株可能通过产生特定的代谢产物促进其他菌株的生长,或通过竞争作用维持群落稳定性[7 ] 。这种互作关系对维持BSC碳循环功能的稳定性具有重要意义。因此,在后续对于荒漠生态系统BSC碳降解菌株的研究中,我们将同时关注真菌群落对木质素等难降解碳的降解作用,争取在碳降解菌群的研究中实现多功能碳降解菌群的资源挖掘,并利用菌群的“主场优势”[25 ] 和“种间互作”[7 ] 研发微生物菌剂,以期通过菌剂的应用促进荒漠生态系统的恢复和重建。
4 结论
碳降解菌株广泛存在于BSC中,在荒漠生态环境修复方面具有重要应用价值。本研究通过筛选、鉴定和特性分析,获得6株(D7、D8、G5、X2、X5和M1)优势碳降解菌株,菌株鉴定结果显示上述菌株来源于Pantoea alhagi 、Bacillus subtilis 、Erwinia piriflorinigrans 和Cupriavidus respiraculi ,为荒漠生态系统的恢复和重建提供了重要的微生物资源。然而,本研究所得结果的适用范围仍需进一步探讨。一方面,不同荒漠生态系统具有独特的环境特征,如土壤质地、气候条件等,这些因素可能影响菌株的生存与功能发挥,因此有必要研究这些菌株在其他荒漠生态系统中的适应性和有效性,以明确其推广范围。另一方面,从实际生态修复应用角度出发,可进一步探索如何利用这些菌株开发高效的微生物菌剂。例如,研究菌株的最佳培养条件、菌剂的制备工艺以及施用方法等,使这些菌株能够更便捷、有效地应用于荒漠生态系统的修复实践中,从而提升研究的实用价值,为荒漠生态恢复提供更具针对性和可操作性的解决方案。
参考文献
View Option
[1]
卢琦 ,吴波 中国荒漠化灾害评估及其经济价值核算
[J].中国人口资源与环境 ,2002 ,12 (2 ):29 -33 .
[本文引用: 1]
[2]
Weber B Büdel B Belnap J Biological Soil Crusts: An Organizing Principle in Drylands [M].New York,USA :Springer ,2016 :3 -13 .
[本文引用: 1]
[3]
Baumann K Glaser K Mutz J E et al Biological soil crusts of temperate forests:their role in P cycling
[J].Soil Biology and Biochemistry ,2017 ,109 :156 -166 .
[本文引用: 1]
[4]
张胜男 ,高海燕 ,闫德仁 ,等 沙漠生物土壤结皮演替对微生物群落结构和土壤酶活力的影响
[J].中国沙漠 ,2023 ,42 (3 ):178 -187 .
[5]
Li X R Zhang P Su Y G et al Carbon fixation by biological soil crusts following revegetation of sand dunes in arid desert regions of China:a four-year field study
[J].Catena ,2012 ,97 :119 -126 .
[本文引用: 1]
[6]
Zhao L N Liu Y B Wang Z R et al Bacteria and fungi differentially contribute to carbon and nitrogen cycles during biological soil crust succession in arid ecosystems
[J].Plant and Soil ,2020 :1 -14 .
[本文引用: 5]
[7]
Zhao L Yuan S Jia R et al Unveiling hidden bacterial players:a closer look at the succession characteristics and co-occurrence patterns of abundant, intermediate and rare bacteria in biological soil crusts
[J].Catena ,2024 ,243 :108223 .
[本文引用: 2]
[8]
Zhao L Kang C Zhang S et al Bacillus cereus CGMCC 1.60196:a promising bacterial inoculant isolated from biological soil crusts for maize growth enhancement
[J].Frontiers in Microbiology ,2024 ,15 :1461949 .
[本文引用: 1]
[9]
Wu X Wu L Liu Y et al Microbial interactions with dissolved organic matter drive carbon dynamics and community succession
[J].Frontiers in Microbiology ,2018 :91234 .
[本文引用: 1]
[10]
张彬 ,陈奇 ,丁雪丽 ,等 微生物残体在土壤中的积累转化过程与稳定机理研究进展
[J].土壤学报 ,2022 ,59 (6 ):1479 -1491 .
[本文引用: 1]
[11]
Li X R Jia R L Zhang Z S et al Hydrological response of biological soil crusts to global warming:a ten-year simulative study
[J].Global Change Biology ,2018 ,24 :4960 -4971 .
[本文引用: 1]
[12]
赵蓉 ,李多伟 ,任涛 ,等 DNS比色法测定白芸豆中α-淀粉酶抑制剂活性的方法研究
[J].中成药 ,2013 ,35 (3 ):573 -576 .
[本文引用: 1]
[13]
张小丹 产果胶酶菌株的筛选、酶学性质的研究及应用
[D].上海 :上海海洋大学 ,2023 .
[本文引用: 1]
[14]
陈欢 ,史子浩 ,吴春会 ,等 不同来源纤维素降解菌的筛选、鉴定及产酶能力的比较
[J].草地学报 ,2024 ,32 (4 ):1252 -1258 .
[本文引用: 1]
[15]
唐云梦 两株木质素降解菌的筛选鉴定及其对秸秆微贮的影响
[D].北京 :中国科学院大学 ,2023 .
[本文引用: 1]
[16]
Hu Y G Zhang Z S Huang L et al Shifts in soil microbial community functional gene structure across a 61-year desert revegetation chronosequence
[J].Geoderma ,2019 ,347 :126 -134 .
[本文引用: 1]
[17]
Zhou J Xue K Xie J et al Microbial mediation of carbon-cycle feedbacks to climate warming
[J].Nature Climate Change ,2012 ,2 :106 -110 .
[18]
贺郝钰 ,刘蔚 ,常宗强 ,等 腾格里沙漠南缘植被恢复对土壤有机碳组成及稳定性的影响
[J].中国沙漠 ,2024 ,44 (6 ):307 -317 .
URL
[19]
王怀海 ,黄文达 ,何远政 ,等 短期增温和降水减少对沙质草地土壤微生物量碳氮和酶活性的影响
[J].中国沙漠 ,2022 ,42 (3 ):274 -281 .
URL
[20]
王少昆 ,赵学勇 ,黄文达 ,等 科尔沁沙质草地纤维素分解菌的筛选、鉴定及其分解能力
[J].中国沙漠 ,2015 ,35 (6 ):1584 -1591 .
URL
[本文引用: 1]
[21]
Miralles I Domingo F Cantón Y et al Hydrolase enzyme activities in a successional gradient of biological soil crusts in arid and semi-arid zones
[J].Soil Biology and Biochemistry ,2012 ,53 :124 -132 .
[本文引用: 1]
[22]
Xu L Zhu B Li C et al Development of biological soil crust prompts convergent succession of prokaryotic communities
[J].Catena ,2020 ,187 :104360 .
[本文引用: 1]
[23]
Boer W Folman L B Summerbell R C et al Living in a fungal world: impact of fungi on soil bacterial niche development
[J].FEMS Microbiology Reviews ,2005 ,29 (4 ):795 -811 .
[本文引用: 1]
[24]
Schneider T Keiblinger K M Schmid E et al Who is who in litter decomposition?Metaproteomics reveals major microbial players and their biogeochemical functions
[J].The ISME Journal ,2012 ,6 (9 ):1749 -1762 .
[本文引用: 1]
[25]
Jiang M Delgado-Baquerizo M Yuan M M et al Home-based microbial solution to boost crop growth in low-fertility soil
[J].New Phytologist ,2023 ,239 :752 -765 .
[本文引用: 1]
中国荒漠化灾害评估及其经济价值核算
1
2002
... 荒漠化作为全球性问题,已经成为人类经济社会可持续发展的重大挑战.中国荒漠化土地面积达2.63×106 km2 ,荒漠化已严重威胁生态安全、粮食安全和经济安全,每年造成的直接经济损失约642亿元、间接经济损失889亿元[1 ] .荒漠化土地的恢复和重建成为人类社会亟待解决的问题. ...
1
2016
... 生物土壤结皮(Biological soil crusts, BSC)是由细菌、真菌、古菌、藻类、地衣、藓类以及其他微小生物体通过菌丝体、假根和多聚糖分泌物等与土壤表层微小颗粒胶结形成的复合生物系统[2 ] .作为干旱区生态系统的关键组成,BSC在调节土壤生态水文过程、维持生物地球化学循环及促进生态修复等方面发挥着不可替代的作用[3 -5 ] .微生物群落作为BSC碳氮循环过程的核心驱动者,对生态系统养分归还和多功能性(multifunctionality)维持具有重要作用[6 -8 ] .其中,碳降解菌株通过分泌胞外酶(淀粉酶、纤维素酶、木质素过氧化物酶等)将复杂有机碳化合物降解为简单的可溶性碳源,继而通过细胞呼吸作用将这些碳源氧化为CO2 ,同时将部分有机碳转化为微生物生物量,构建了完整的碳素转化网络[9 -10 ] .在BSC碳降解过程中,细菌和真菌群落表现出明显的功能分工:细菌群落主要参与淀粉、果胶、半纤维素、纤维素、几丁质和芳烃等物质的降解,而真菌群落则在降解复杂的木质素结构方面发挥着更为关键的作用[6 ] .这些协同降解机制不仅确保了土壤碳循环的有效运转,而且维持了有机碳在生态系统中的持续循环,对生态系统的稳定性具有重要意义.然而,目前对荒漠生态系统BSC中碳降解菌株的系统研究仍显不足,尤其缺乏对具有多重碳源降解能力的功能菌株的深入挖掘,这在一定程度上限制了我们对荒漠生态系统碳循环微生物调控机制的深入认知. ...
Biological soil crusts of temperate forests:their role in P cycling
1
2017
... 生物土壤结皮(Biological soil crusts, BSC)是由细菌、真菌、古菌、藻类、地衣、藓类以及其他微小生物体通过菌丝体、假根和多聚糖分泌物等与土壤表层微小颗粒胶结形成的复合生物系统[2 ] .作为干旱区生态系统的关键组成,BSC在调节土壤生态水文过程、维持生物地球化学循环及促进生态修复等方面发挥着不可替代的作用[3 -5 ] .微生物群落作为BSC碳氮循环过程的核心驱动者,对生态系统养分归还和多功能性(multifunctionality)维持具有重要作用[6 -8 ] .其中,碳降解菌株通过分泌胞外酶(淀粉酶、纤维素酶、木质素过氧化物酶等)将复杂有机碳化合物降解为简单的可溶性碳源,继而通过细胞呼吸作用将这些碳源氧化为CO2 ,同时将部分有机碳转化为微生物生物量,构建了完整的碳素转化网络[9 -10 ] .在BSC碳降解过程中,细菌和真菌群落表现出明显的功能分工:细菌群落主要参与淀粉、果胶、半纤维素、纤维素、几丁质和芳烃等物质的降解,而真菌群落则在降解复杂的木质素结构方面发挥着更为关键的作用[6 ] .这些协同降解机制不仅确保了土壤碳循环的有效运转,而且维持了有机碳在生态系统中的持续循环,对生态系统的稳定性具有重要意义.然而,目前对荒漠生态系统BSC中碳降解菌株的系统研究仍显不足,尤其缺乏对具有多重碳源降解能力的功能菌株的深入挖掘,这在一定程度上限制了我们对荒漠生态系统碳循环微生物调控机制的深入认知. ...
沙漠生物土壤结皮演替对微生物群落结构和土壤酶活力的影响
2023
Carbon fixation by biological soil crusts following revegetation of sand dunes in arid desert regions of China:a four-year field study
1
2012
... 生物土壤结皮(Biological soil crusts, BSC)是由细菌、真菌、古菌、藻类、地衣、藓类以及其他微小生物体通过菌丝体、假根和多聚糖分泌物等与土壤表层微小颗粒胶结形成的复合生物系统[2 ] .作为干旱区生态系统的关键组成,BSC在调节土壤生态水文过程、维持生物地球化学循环及促进生态修复等方面发挥着不可替代的作用[3 -5 ] .微生物群落作为BSC碳氮循环过程的核心驱动者,对生态系统养分归还和多功能性(multifunctionality)维持具有重要作用[6 -8 ] .其中,碳降解菌株通过分泌胞外酶(淀粉酶、纤维素酶、木质素过氧化物酶等)将复杂有机碳化合物降解为简单的可溶性碳源,继而通过细胞呼吸作用将这些碳源氧化为CO2 ,同时将部分有机碳转化为微生物生物量,构建了完整的碳素转化网络[9 -10 ] .在BSC碳降解过程中,细菌和真菌群落表现出明显的功能分工:细菌群落主要参与淀粉、果胶、半纤维素、纤维素、几丁质和芳烃等物质的降解,而真菌群落则在降解复杂的木质素结构方面发挥着更为关键的作用[6 ] .这些协同降解机制不仅确保了土壤碳循环的有效运转,而且维持了有机碳在生态系统中的持续循环,对生态系统的稳定性具有重要意义.然而,目前对荒漠生态系统BSC中碳降解菌株的系统研究仍显不足,尤其缺乏对具有多重碳源降解能力的功能菌株的深入挖掘,这在一定程度上限制了我们对荒漠生态系统碳循环微生物调控机制的深入认知. ...
Bacteria and fungi differentially contribute to carbon and nitrogen cycles during biological soil crust succession in arid ecosystems
5
2020
... 生物土壤结皮(Biological soil crusts, BSC)是由细菌、真菌、古菌、藻类、地衣、藓类以及其他微小生物体通过菌丝体、假根和多聚糖分泌物等与土壤表层微小颗粒胶结形成的复合生物系统[2 ] .作为干旱区生态系统的关键组成,BSC在调节土壤生态水文过程、维持生物地球化学循环及促进生态修复等方面发挥着不可替代的作用[3 -5 ] .微生物群落作为BSC碳氮循环过程的核心驱动者,对生态系统养分归还和多功能性(multifunctionality)维持具有重要作用[6 -8 ] .其中,碳降解菌株通过分泌胞外酶(淀粉酶、纤维素酶、木质素过氧化物酶等)将复杂有机碳化合物降解为简单的可溶性碳源,继而通过细胞呼吸作用将这些碳源氧化为CO2 ,同时将部分有机碳转化为微生物生物量,构建了完整的碳素转化网络[9 -10 ] .在BSC碳降解过程中,细菌和真菌群落表现出明显的功能分工:细菌群落主要参与淀粉、果胶、半纤维素、纤维素、几丁质和芳烃等物质的降解,而真菌群落则在降解复杂的木质素结构方面发挥着更为关键的作用[6 ] .这些协同降解机制不仅确保了土壤碳循环的有效运转,而且维持了有机碳在生态系统中的持续循环,对生态系统的稳定性具有重要意义.然而,目前对荒漠生态系统BSC中碳降解菌株的系统研究仍显不足,尤其缺乏对具有多重碳源降解能力的功能菌株的深入挖掘,这在一定程度上限制了我们对荒漠生态系统碳循环微生物调控机制的深入认知. ...
... [6 ].这些协同降解机制不仅确保了土壤碳循环的有效运转,而且维持了有机碳在生态系统中的持续循环,对生态系统的稳定性具有重要意义.然而,目前对荒漠生态系统BSC中碳降解菌株的系统研究仍显不足,尤其缺乏对具有多重碳源降解能力的功能菌株的深入挖掘,这在一定程度上限制了我们对荒漠生态系统碳循环微生物调控机制的深入认知. ...
... 不同类型BSC中碳降解酶活性存在显著差异.Miralles等[21 ] 研究塔韦纳斯沙漠BSC碳降解相关水解酶活性发现,地衣为主BSC表现出最高的水解酶活性,且降解低分子量底物的酶活性普遍高于降解高分子量底物(纤维素和蛋白质)的酶活性.这种差异性反映了BSC微生物群落对不同碳源的选择性利用策略.Xu等[22 ] 发现,藓类为主BSC能够产生较其他类型BSC更多的难降解碳基质,进而促进对难降解碳具有偏好性的真菌群落的富集.值得注意的是,我们前期利用GeoChip 5.0功能基因芯片研究BSC碳降解过程发现,BSC中的细菌和真菌群落在碳降解过程中表现出明显的功能互补和协同作用[6 ] .细菌群落的放线菌门(主要为链霉菌属)和变形菌门主要通过amyA 基因调控淀粉降解途径,而真菌群落的担子菌门(主要为栓菌属和平革菌属)和子囊菌门主要通过phenol oxidase 基因调控木质素降解途径,这种功能分工可能通过共代谢途径提高碳基质的降解效率[6 ] .此外,真菌群落在难降解碳降解过程中的巨大贡献也被Boer等[23 ] 和Schneider等[24 ] 的研究所揭示,而曲霉属和毛壳菌属(Chaetomium )也被证实为难降解碳降解过程中的优势功能菌属[6 ] . ...
... [6 ].此外,真菌群落在难降解碳降解过程中的巨大贡献也被Boer等[23 ] 和Schneider等[24 ] 的研究所揭示,而曲霉属和毛壳菌属(Chaetomium )也被证实为难降解碳降解过程中的优势功能菌属[6 ] . ...
... [6 ]. ...
Unveiling hidden bacterial players:a closer look at the succession characteristics and co-occurrence patterns of abundant, intermediate and rare bacteria in biological soil crusts
2
2024
... 值得注意的是,BSC中碳降解菌株间可能存在复杂的生态互作关系.例如,某些菌株可能通过产生特定的代谢产物促进其他菌株的生长,或通过竞争作用维持群落稳定性[7 ] .这种互作关系对维持BSC碳循环功能的稳定性具有重要意义.因此,在后续对于荒漠生态系统BSC碳降解菌株的研究中,我们将同时关注真菌群落对木质素等难降解碳的降解作用,争取在碳降解菌群的研究中实现多功能碳降解菌群的资源挖掘,并利用菌群的“主场优势”[25 ] 和“种间互作”[7 ] 研发微生物菌剂,以期通过菌剂的应用促进荒漠生态系统的恢复和重建. ...
... [7 ]研发微生物菌剂,以期通过菌剂的应用促进荒漠生态系统的恢复和重建. ...
Bacillus cereus CGMCC 1.60196:a promising bacterial inoculant isolated from biological soil crusts for maize growth enhancement
1
2024
... 生物土壤结皮(Biological soil crusts, BSC)是由细菌、真菌、古菌、藻类、地衣、藓类以及其他微小生物体通过菌丝体、假根和多聚糖分泌物等与土壤表层微小颗粒胶结形成的复合生物系统[2 ] .作为干旱区生态系统的关键组成,BSC在调节土壤生态水文过程、维持生物地球化学循环及促进生态修复等方面发挥着不可替代的作用[3 -5 ] .微生物群落作为BSC碳氮循环过程的核心驱动者,对生态系统养分归还和多功能性(multifunctionality)维持具有重要作用[6 -8 ] .其中,碳降解菌株通过分泌胞外酶(淀粉酶、纤维素酶、木质素过氧化物酶等)将复杂有机碳化合物降解为简单的可溶性碳源,继而通过细胞呼吸作用将这些碳源氧化为CO2 ,同时将部分有机碳转化为微生物生物量,构建了完整的碳素转化网络[9 -10 ] .在BSC碳降解过程中,细菌和真菌群落表现出明显的功能分工:细菌群落主要参与淀粉、果胶、半纤维素、纤维素、几丁质和芳烃等物质的降解,而真菌群落则在降解复杂的木质素结构方面发挥着更为关键的作用[6 ] .这些协同降解机制不仅确保了土壤碳循环的有效运转,而且维持了有机碳在生态系统中的持续循环,对生态系统的稳定性具有重要意义.然而,目前对荒漠生态系统BSC中碳降解菌株的系统研究仍显不足,尤其缺乏对具有多重碳源降解能力的功能菌株的深入挖掘,这在一定程度上限制了我们对荒漠生态系统碳循环微生物调控机制的深入认知. ...
Microbial interactions with dissolved organic matter drive carbon dynamics and community succession
1
2018
... 生物土壤结皮(Biological soil crusts, BSC)是由细菌、真菌、古菌、藻类、地衣、藓类以及其他微小生物体通过菌丝体、假根和多聚糖分泌物等与土壤表层微小颗粒胶结形成的复合生物系统[2 ] .作为干旱区生态系统的关键组成,BSC在调节土壤生态水文过程、维持生物地球化学循环及促进生态修复等方面发挥着不可替代的作用[3 -5 ] .微生物群落作为BSC碳氮循环过程的核心驱动者,对生态系统养分归还和多功能性(multifunctionality)维持具有重要作用[6 -8 ] .其中,碳降解菌株通过分泌胞外酶(淀粉酶、纤维素酶、木质素过氧化物酶等)将复杂有机碳化合物降解为简单的可溶性碳源,继而通过细胞呼吸作用将这些碳源氧化为CO2 ,同时将部分有机碳转化为微生物生物量,构建了完整的碳素转化网络[9 -10 ] .在BSC碳降解过程中,细菌和真菌群落表现出明显的功能分工:细菌群落主要参与淀粉、果胶、半纤维素、纤维素、几丁质和芳烃等物质的降解,而真菌群落则在降解复杂的木质素结构方面发挥着更为关键的作用[6 ] .这些协同降解机制不仅确保了土壤碳循环的有效运转,而且维持了有机碳在生态系统中的持续循环,对生态系统的稳定性具有重要意义.然而,目前对荒漠生态系统BSC中碳降解菌株的系统研究仍显不足,尤其缺乏对具有多重碳源降解能力的功能菌株的深入挖掘,这在一定程度上限制了我们对荒漠生态系统碳循环微生物调控机制的深入认知. ...
微生物残体在土壤中的积累转化过程与稳定机理研究进展
1
2022
... 生物土壤结皮(Biological soil crusts, BSC)是由细菌、真菌、古菌、藻类、地衣、藓类以及其他微小生物体通过菌丝体、假根和多聚糖分泌物等与土壤表层微小颗粒胶结形成的复合生物系统[2 ] .作为干旱区生态系统的关键组成,BSC在调节土壤生态水文过程、维持生物地球化学循环及促进生态修复等方面发挥着不可替代的作用[3 -5 ] .微生物群落作为BSC碳氮循环过程的核心驱动者,对生态系统养分归还和多功能性(multifunctionality)维持具有重要作用[6 -8 ] .其中,碳降解菌株通过分泌胞外酶(淀粉酶、纤维素酶、木质素过氧化物酶等)将复杂有机碳化合物降解为简单的可溶性碳源,继而通过细胞呼吸作用将这些碳源氧化为CO2 ,同时将部分有机碳转化为微生物生物量,构建了完整的碳素转化网络[9 -10 ] .在BSC碳降解过程中,细菌和真菌群落表现出明显的功能分工:细菌群落主要参与淀粉、果胶、半纤维素、纤维素、几丁质和芳烃等物质的降解,而真菌群落则在降解复杂的木质素结构方面发挥着更为关键的作用[6 ] .这些协同降解机制不仅确保了土壤碳循环的有效运转,而且维持了有机碳在生态系统中的持续循环,对生态系统的稳定性具有重要意义.然而,目前对荒漠生态系统BSC中碳降解菌株的系统研究仍显不足,尤其缺乏对具有多重碳源降解能力的功能菌株的深入挖掘,这在一定程度上限制了我们对荒漠生态系统碳循环微生物调控机制的深入认知. ...
Hydrological response of biological soil crusts to global warming:a ten-year simulative study
1
2018
... 供试BSCs与流沙样品采集自腾格里沙漠东南缘沙坡头固沙植被区(37°32′N、105°02′E;海拔1 330 m).该研究区主要的景观为高大密集分布的格状沙丘,多年平均气温10 ℃(低温极值为-25 ℃;高温极值为38.1 ℃),多年平均降水量186 mm,集中在5—9月),年蒸发量3 000 mm,年平均风速2.9 m·s-1[11 ] .2024年3月,对距离植被至少2 m的藻类结皮、地衣结皮和藓类结皮,以及流沙进行采集,样品采集后保存于无菌采样袋中,于4 ℃冰箱中保存备用. ...
DNS比色法测定白芸豆中α-淀粉酶抑制剂活性的方法研究
1
2013
... 参考赵蓉等[12 ] 、张小丹[13 ] 、陈欢等[14 ] 描述的DNS法分别测定菌株淀粉酶、果胶酶和纤维素酶活性,粗酶液与DNS试剂反应后在540 nm处测量其OD值并计算其酶活性.参考唐云梦[15 ] 描述的方法筛选具有产生木质素过氧化物酶的菌株,将5 μL菌株发酵液点种于苯胺蓝固体培养基中心,30 ℃培养3 d,期间观察菌落透明圈出现与否及大小. ...
产果胶酶菌株的筛选、酶学性质的研究及应用
1
2023
... 参考赵蓉等[12 ] 、张小丹[13 ] 、陈欢等[14 ] 描述的DNS法分别测定菌株淀粉酶、果胶酶和纤维素酶活性,粗酶液与DNS试剂反应后在540 nm处测量其OD值并计算其酶活性.参考唐云梦[15 ] 描述的方法筛选具有产生木质素过氧化物酶的菌株,将5 μL菌株发酵液点种于苯胺蓝固体培养基中心,30 ℃培养3 d,期间观察菌落透明圈出现与否及大小. ...
不同来源纤维素降解菌的筛选、鉴定及产酶能力的比较
1
2024
... 参考赵蓉等[12 ] 、张小丹[13 ] 、陈欢等[14 ] 描述的DNS法分别测定菌株淀粉酶、果胶酶和纤维素酶活性,粗酶液与DNS试剂反应后在540 nm处测量其OD值并计算其酶活性.参考唐云梦[15 ] 描述的方法筛选具有产生木质素过氧化物酶的菌株,将5 μL菌株发酵液点种于苯胺蓝固体培养基中心,30 ℃培养3 d,期间观察菌落透明圈出现与否及大小. ...
两株木质素降解菌的筛选鉴定及其对秸秆微贮的影响
1
2023
... 参考赵蓉等[12 ] 、张小丹[13 ] 、陈欢等[14 ] 描述的DNS法分别测定菌株淀粉酶、果胶酶和纤维素酶活性,粗酶液与DNS试剂反应后在540 nm处测量其OD值并计算其酶活性.参考唐云梦[15 ] 描述的方法筛选具有产生木质素过氧化物酶的菌株,将5 μL菌株发酵液点种于苯胺蓝固体培养基中心,30 ℃培养3 d,期间观察菌落透明圈出现与否及大小. ...
Shifts in soil microbial community functional gene structure across a 61-year desert revegetation chronosequence
1
2019
... 在碳降解过程中,BSC微生物通过分泌多种胞外酶将土壤微生物及微小动物的死亡组织、隐花植物及灌木植被的凋落物等复杂有机碳化合物降解为可溶性小分子物质.这些物质一部分被微生物吸收转化为生物量,一部分通过微生物呼吸作用分解为CO2 释放至大气,还有一部分则与土壤矿物质结合形成稳定的土壤有机碳库,显著影响着土壤碳库的动态平衡[16 -20 ] . ...
Microbial mediation of carbon-cycle feedbacks to climate warming
2012
腾格里沙漠南缘植被恢复对土壤有机碳组成及稳定性的影响
2024
短期增温和降水减少对沙质草地土壤微生物量碳氮和酶活性的影响
2022
科尔沁沙质草地纤维素分解菌的筛选、鉴定及其分解能力
1
2015
... 在碳降解过程中,BSC微生物通过分泌多种胞外酶将土壤微生物及微小动物的死亡组织、隐花植物及灌木植被的凋落物等复杂有机碳化合物降解为可溶性小分子物质.这些物质一部分被微生物吸收转化为生物量,一部分通过微生物呼吸作用分解为CO2 释放至大气,还有一部分则与土壤矿物质结合形成稳定的土壤有机碳库,显著影响着土壤碳库的动态平衡[16 -20 ] . ...
Hydrolase enzyme activities in a successional gradient of biological soil crusts in arid and semi-arid zones
1
2012
... 不同类型BSC中碳降解酶活性存在显著差异.Miralles等[21 ] 研究塔韦纳斯沙漠BSC碳降解相关水解酶活性发现,地衣为主BSC表现出最高的水解酶活性,且降解低分子量底物的酶活性普遍高于降解高分子量底物(纤维素和蛋白质)的酶活性.这种差异性反映了BSC微生物群落对不同碳源的选择性利用策略.Xu等[22 ] 发现,藓类为主BSC能够产生较其他类型BSC更多的难降解碳基质,进而促进对难降解碳具有偏好性的真菌群落的富集.值得注意的是,我们前期利用GeoChip 5.0功能基因芯片研究BSC碳降解过程发现,BSC中的细菌和真菌群落在碳降解过程中表现出明显的功能互补和协同作用[6 ] .细菌群落的放线菌门(主要为链霉菌属)和变形菌门主要通过amyA 基因调控淀粉降解途径,而真菌群落的担子菌门(主要为栓菌属和平革菌属)和子囊菌门主要通过phenol oxidase 基因调控木质素降解途径,这种功能分工可能通过共代谢途径提高碳基质的降解效率[6 ] .此外,真菌群落在难降解碳降解过程中的巨大贡献也被Boer等[23 ] 和Schneider等[24 ] 的研究所揭示,而曲霉属和毛壳菌属(Chaetomium )也被证实为难降解碳降解过程中的优势功能菌属[6 ] . ...
Development of biological soil crust prompts convergent succession of prokaryotic communities
1
2020
... 不同类型BSC中碳降解酶活性存在显著差异.Miralles等[21 ] 研究塔韦纳斯沙漠BSC碳降解相关水解酶活性发现,地衣为主BSC表现出最高的水解酶活性,且降解低分子量底物的酶活性普遍高于降解高分子量底物(纤维素和蛋白质)的酶活性.这种差异性反映了BSC微生物群落对不同碳源的选择性利用策略.Xu等[22 ] 发现,藓类为主BSC能够产生较其他类型BSC更多的难降解碳基质,进而促进对难降解碳具有偏好性的真菌群落的富集.值得注意的是,我们前期利用GeoChip 5.0功能基因芯片研究BSC碳降解过程发现,BSC中的细菌和真菌群落在碳降解过程中表现出明显的功能互补和协同作用[6 ] .细菌群落的放线菌门(主要为链霉菌属)和变形菌门主要通过amyA 基因调控淀粉降解途径,而真菌群落的担子菌门(主要为栓菌属和平革菌属)和子囊菌门主要通过phenol oxidase 基因调控木质素降解途径,这种功能分工可能通过共代谢途径提高碳基质的降解效率[6 ] .此外,真菌群落在难降解碳降解过程中的巨大贡献也被Boer等[23 ] 和Schneider等[24 ] 的研究所揭示,而曲霉属和毛壳菌属(Chaetomium )也被证实为难降解碳降解过程中的优势功能菌属[6 ] . ...
Living in a fungal world: impact of fungi on soil bacterial niche development
1
2005
... 不同类型BSC中碳降解酶活性存在显著差异.Miralles等[21 ] 研究塔韦纳斯沙漠BSC碳降解相关水解酶活性发现,地衣为主BSC表现出最高的水解酶活性,且降解低分子量底物的酶活性普遍高于降解高分子量底物(纤维素和蛋白质)的酶活性.这种差异性反映了BSC微生物群落对不同碳源的选择性利用策略.Xu等[22 ] 发现,藓类为主BSC能够产生较其他类型BSC更多的难降解碳基质,进而促进对难降解碳具有偏好性的真菌群落的富集.值得注意的是,我们前期利用GeoChip 5.0功能基因芯片研究BSC碳降解过程发现,BSC中的细菌和真菌群落在碳降解过程中表现出明显的功能互补和协同作用[6 ] .细菌群落的放线菌门(主要为链霉菌属)和变形菌门主要通过amyA 基因调控淀粉降解途径,而真菌群落的担子菌门(主要为栓菌属和平革菌属)和子囊菌门主要通过phenol oxidase 基因调控木质素降解途径,这种功能分工可能通过共代谢途径提高碳基质的降解效率[6 ] .此外,真菌群落在难降解碳降解过程中的巨大贡献也被Boer等[23 ] 和Schneider等[24 ] 的研究所揭示,而曲霉属和毛壳菌属(Chaetomium )也被证实为难降解碳降解过程中的优势功能菌属[6 ] . ...
Who is who in litter decomposition?Metaproteomics reveals major microbial players and their biogeochemical functions
1
2012
... 不同类型BSC中碳降解酶活性存在显著差异.Miralles等[21 ] 研究塔韦纳斯沙漠BSC碳降解相关水解酶活性发现,地衣为主BSC表现出最高的水解酶活性,且降解低分子量底物的酶活性普遍高于降解高分子量底物(纤维素和蛋白质)的酶活性.这种差异性反映了BSC微生物群落对不同碳源的选择性利用策略.Xu等[22 ] 发现,藓类为主BSC能够产生较其他类型BSC更多的难降解碳基质,进而促进对难降解碳具有偏好性的真菌群落的富集.值得注意的是,我们前期利用GeoChip 5.0功能基因芯片研究BSC碳降解过程发现,BSC中的细菌和真菌群落在碳降解过程中表现出明显的功能互补和协同作用[6 ] .细菌群落的放线菌门(主要为链霉菌属)和变形菌门主要通过amyA 基因调控淀粉降解途径,而真菌群落的担子菌门(主要为栓菌属和平革菌属)和子囊菌门主要通过phenol oxidase 基因调控木质素降解途径,这种功能分工可能通过共代谢途径提高碳基质的降解效率[6 ] .此外,真菌群落在难降解碳降解过程中的巨大贡献也被Boer等[23 ] 和Schneider等[24 ] 的研究所揭示,而曲霉属和毛壳菌属(Chaetomium )也被证实为难降解碳降解过程中的优势功能菌属[6 ] . ...
Home-based microbial solution to boost crop growth in low-fertility soil
1
2023
... 值得注意的是,BSC中碳降解菌株间可能存在复杂的生态互作关系.例如,某些菌株可能通过产生特定的代谢产物促进其他菌株的生长,或通过竞争作用维持群落稳定性[7 ] .这种互作关系对维持BSC碳循环功能的稳定性具有重要意义.因此,在后续对于荒漠生态系统BSC碳降解菌株的研究中,我们将同时关注真菌群落对木质素等难降解碳的降解作用,争取在碳降解菌群的研究中实现多功能碳降解菌群的资源挖掘,并利用菌群的“主场优势”[25 ] 和“种间互作”[7 ] 研发微生物菌剂,以期通过菌剂的应用促进荒漠生态系统的恢复和重建. ...




 甘公网安备 62010202000688号
甘公网安备 62010202000688号