1
2017
... 青藏高原是世界上海拔最高且面积最大的高原,发育着草甸、草原、荒漠、湿地等高寒生态系统.由于在生物多样性保育、水源涵养、碳储存、全球气候调节等诸多生态方面的突出作用,青藏高原被列为中国重要的生态安全屏障[1].其中,以高寒草甸和高寒草原为主体的高寒草地生态系统占整个高原面积的50%以上[2].由于地处高寒区域,高寒草地具有土壤形成过程缓慢、养分可利用性低、生长季短的特点,决定了其生态系统的脆弱性和对各类干扰的高度敏感性,一旦退化就很难被恢复[3].近些年来,在气候变化和人类活动(如放牧、开垦和城市化)的双重压力下[4-5],青藏高原近一半的高寒草地已发生了不同程度的退化[6],成为全球草地退化的热点区域.这种以草地的生产和生态功能下降为主要特征的草地退化,极大地威胁青藏高原生态安全屏障作用的稳定发挥.在此背景下,中国通过颁布和实施草原法、建立自然保护区、划区轮牧、补播、施肥等多项政策与管理措施相结合进行草地保护与恢复,在区域尺度上取得了不错的成效[7].然而,局部地区的草地退化现象仍非常普遍,高寒草甸退化形成的“黑土滩”和高寒草原的草地沙化形势依然严峻[8-9].在此类极度退化的草地上进行人工植被重建是高寒退化草地恢复的必然选择. ...
A 250 m annual alpine grassland AGB dataset over the Qinghai-Tibet Plateau (2000-2019) in China based on in situ measurements,UAV photos,and MODIS data
1
2023
... 青藏高原是世界上海拔最高且面积最大的高原,发育着草甸、草原、荒漠、湿地等高寒生态系统.由于在生物多样性保育、水源涵养、碳储存、全球气候调节等诸多生态方面的突出作用,青藏高原被列为中国重要的生态安全屏障[1].其中,以高寒草甸和高寒草原为主体的高寒草地生态系统占整个高原面积的50%以上[2].由于地处高寒区域,高寒草地具有土壤形成过程缓慢、养分可利用性低、生长季短的特点,决定了其生态系统的脆弱性和对各类干扰的高度敏感性,一旦退化就很难被恢复[3].近些年来,在气候变化和人类活动(如放牧、开垦和城市化)的双重压力下[4-5],青藏高原近一半的高寒草地已发生了不同程度的退化[6],成为全球草地退化的热点区域.这种以草地的生产和生态功能下降为主要特征的草地退化,极大地威胁青藏高原生态安全屏障作用的稳定发挥.在此背景下,中国通过颁布和实施草原法、建立自然保护区、划区轮牧、补播、施肥等多项政策与管理措施相结合进行草地保护与恢复,在区域尺度上取得了不错的成效[7].然而,局部地区的草地退化现象仍非常普遍,高寒草甸退化形成的“黑土滩”和高寒草原的草地沙化形势依然严峻[8-9].在此类极度退化的草地上进行人工植被重建是高寒退化草地恢复的必然选择. ...
Overgrazing leads to soil cracking that later triggers the severe degradation of alpine meadows on the Tibetan Plateau
1
2019
... 青藏高原是世界上海拔最高且面积最大的高原,发育着草甸、草原、荒漠、湿地等高寒生态系统.由于在生物多样性保育、水源涵养、碳储存、全球气候调节等诸多生态方面的突出作用,青藏高原被列为中国重要的生态安全屏障[1].其中,以高寒草甸和高寒草原为主体的高寒草地生态系统占整个高原面积的50%以上[2].由于地处高寒区域,高寒草地具有土壤形成过程缓慢、养分可利用性低、生长季短的特点,决定了其生态系统的脆弱性和对各类干扰的高度敏感性,一旦退化就很难被恢复[3].近些年来,在气候变化和人类活动(如放牧、开垦和城市化)的双重压力下[4-5],青藏高原近一半的高寒草地已发生了不同程度的退化[6],成为全球草地退化的热点区域.这种以草地的生产和生态功能下降为主要特征的草地退化,极大地威胁青藏高原生态安全屏障作用的稳定发挥.在此背景下,中国通过颁布和实施草原法、建立自然保护区、划区轮牧、补播、施肥等多项政策与管理措施相结合进行草地保护与恢复,在区域尺度上取得了不错的成效[7].然而,局部地区的草地退化现象仍非常普遍,高寒草甸退化形成的“黑土滩”和高寒草原的草地沙化形势依然严峻[8-9].在此类极度退化的草地上进行人工植被重建是高寒退化草地恢复的必然选择. ...
Assessing the effects of climate variation and human activities on grassland degradation and restoration across the globe
1
2019
... 青藏高原是世界上海拔最高且面积最大的高原,发育着草甸、草原、荒漠、湿地等高寒生态系统.由于在生物多样性保育、水源涵养、碳储存、全球气候调节等诸多生态方面的突出作用,青藏高原被列为中国重要的生态安全屏障[1].其中,以高寒草甸和高寒草原为主体的高寒草地生态系统占整个高原面积的50%以上[2].由于地处高寒区域,高寒草地具有土壤形成过程缓慢、养分可利用性低、生长季短的特点,决定了其生态系统的脆弱性和对各类干扰的高度敏感性,一旦退化就很难被恢复[3].近些年来,在气候变化和人类活动(如放牧、开垦和城市化)的双重压力下[4-5],青藏高原近一半的高寒草地已发生了不同程度的退化[6],成为全球草地退化的热点区域.这种以草地的生产和生态功能下降为主要特征的草地退化,极大地威胁青藏高原生态安全屏障作用的稳定发挥.在此背景下,中国通过颁布和实施草原法、建立自然保护区、划区轮牧、补播、施肥等多项政策与管理措施相结合进行草地保护与恢复,在区域尺度上取得了不错的成效[7].然而,局部地区的草地退化现象仍非常普遍,高寒草甸退化形成的“黑土滩”和高寒草原的草地沙化形势依然严峻[8-9].在此类极度退化的草地上进行人工植被重建是高寒退化草地恢复的必然选择. ...
Coupled effect of climate change and human activities on the restoration/degradation of the Qinghai-Tibet Plateau grassland
1
2021
... 青藏高原是世界上海拔最高且面积最大的高原,发育着草甸、草原、荒漠、湿地等高寒生态系统.由于在生物多样性保育、水源涵养、碳储存、全球气候调节等诸多生态方面的突出作用,青藏高原被列为中国重要的生态安全屏障[1].其中,以高寒草甸和高寒草原为主体的高寒草地生态系统占整个高原面积的50%以上[2].由于地处高寒区域,高寒草地具有土壤形成过程缓慢、养分可利用性低、生长季短的特点,决定了其生态系统的脆弱性和对各类干扰的高度敏感性,一旦退化就很难被恢复[3].近些年来,在气候变化和人类活动(如放牧、开垦和城市化)的双重压力下[4-5],青藏高原近一半的高寒草地已发生了不同程度的退化[6],成为全球草地退化的热点区域.这种以草地的生产和生态功能下降为主要特征的草地退化,极大地威胁青藏高原生态安全屏障作用的稳定发挥.在此背景下,中国通过颁布和实施草原法、建立自然保护区、划区轮牧、补播、施肥等多项政策与管理措施相结合进行草地保护与恢复,在区域尺度上取得了不错的成效[7].然而,局部地区的草地退化现象仍非常普遍,高寒草甸退化形成的“黑土滩”和高寒草原的草地沙化形势依然严峻[8-9].在此类极度退化的草地上进行人工植被重建是高寒退化草地恢复的必然选择. ...
Quantitative assessment of the contributions of climate change and human activities on global grassland degradation
1
2014
... 青藏高原是世界上海拔最高且面积最大的高原,发育着草甸、草原、荒漠、湿地等高寒生态系统.由于在生物多样性保育、水源涵养、碳储存、全球气候调节等诸多生态方面的突出作用,青藏高原被列为中国重要的生态安全屏障[1].其中,以高寒草甸和高寒草原为主体的高寒草地生态系统占整个高原面积的50%以上[2].由于地处高寒区域,高寒草地具有土壤形成过程缓慢、养分可利用性低、生长季短的特点,决定了其生态系统的脆弱性和对各类干扰的高度敏感性,一旦退化就很难被恢复[3].近些年来,在气候变化和人类活动(如放牧、开垦和城市化)的双重压力下[4-5],青藏高原近一半的高寒草地已发生了不同程度的退化[6],成为全球草地退化的热点区域.这种以草地的生产和生态功能下降为主要特征的草地退化,极大地威胁青藏高原生态安全屏障作用的稳定发挥.在此背景下,中国通过颁布和实施草原法、建立自然保护区、划区轮牧、补播、施肥等多项政策与管理措施相结合进行草地保护与恢复,在区域尺度上取得了不错的成效[7].然而,局部地区的草地退化现象仍非常普遍,高寒草甸退化形成的“黑土滩”和高寒草原的草地沙化形势依然严峻[8-9].在此类极度退化的草地上进行人工植被重建是高寒退化草地恢复的必然选择. ...
Human-induced grassland degradation/restoration in the central Tibetan Plateau: the effects of ecological protection and restoration projects
1
2015
... 青藏高原是世界上海拔最高且面积最大的高原,发育着草甸、草原、荒漠、湿地等高寒生态系统.由于在生物多样性保育、水源涵养、碳储存、全球气候调节等诸多生态方面的突出作用,青藏高原被列为中国重要的生态安全屏障[1].其中,以高寒草甸和高寒草原为主体的高寒草地生态系统占整个高原面积的50%以上[2].由于地处高寒区域,高寒草地具有土壤形成过程缓慢、养分可利用性低、生长季短的特点,决定了其生态系统的脆弱性和对各类干扰的高度敏感性,一旦退化就很难被恢复[3].近些年来,在气候变化和人类活动(如放牧、开垦和城市化)的双重压力下[4-5],青藏高原近一半的高寒草地已发生了不同程度的退化[6],成为全球草地退化的热点区域.这种以草地的生产和生态功能下降为主要特征的草地退化,极大地威胁青藏高原生态安全屏障作用的稳定发挥.在此背景下,中国通过颁布和实施草原法、建立自然保护区、划区轮牧、补播、施肥等多项政策与管理措施相结合进行草地保护与恢复,在区域尺度上取得了不错的成效[7].然而,局部地区的草地退化现象仍非常普遍,高寒草甸退化形成的“黑土滩”和高寒草原的草地沙化形势依然严峻[8-9].在此类极度退化的草地上进行人工植被重建是高寒退化草地恢复的必然选择. ...
High-altitude aeolian desertification and sand dunes on the Tibetan Plateau,China
1
2023
... 青藏高原是世界上海拔最高且面积最大的高原,发育着草甸、草原、荒漠、湿地等高寒生态系统.由于在生物多样性保育、水源涵养、碳储存、全球气候调节等诸多生态方面的突出作用,青藏高原被列为中国重要的生态安全屏障[1].其中,以高寒草甸和高寒草原为主体的高寒草地生态系统占整个高原面积的50%以上[2].由于地处高寒区域,高寒草地具有土壤形成过程缓慢、养分可利用性低、生长季短的特点,决定了其生态系统的脆弱性和对各类干扰的高度敏感性,一旦退化就很难被恢复[3].近些年来,在气候变化和人类活动(如放牧、开垦和城市化)的双重压力下[4-5],青藏高原近一半的高寒草地已发生了不同程度的退化[6],成为全球草地退化的热点区域.这种以草地的生产和生态功能下降为主要特征的草地退化,极大地威胁青藏高原生态安全屏障作用的稳定发挥.在此背景下,中国通过颁布和实施草原法、建立自然保护区、划区轮牧、补播、施肥等多项政策与管理措施相结合进行草地保护与恢复,在区域尺度上取得了不错的成效[7].然而,局部地区的草地退化现象仍非常普遍,高寒草甸退化形成的“黑土滩”和高寒草原的草地沙化形势依然严峻[8-9].在此类极度退化的草地上进行人工植被重建是高寒退化草地恢复的必然选择. ...
青藏铁路植被恢复和黑土型退化草地治理的实践与启示
2
2015
... 青藏高原是世界上海拔最高且面积最大的高原,发育着草甸、草原、荒漠、湿地等高寒生态系统.由于在生物多样性保育、水源涵养、碳储存、全球气候调节等诸多生态方面的突出作用,青藏高原被列为中国重要的生态安全屏障[1].其中,以高寒草甸和高寒草原为主体的高寒草地生态系统占整个高原面积的50%以上[2].由于地处高寒区域,高寒草地具有土壤形成过程缓慢、养分可利用性低、生长季短的特点,决定了其生态系统的脆弱性和对各类干扰的高度敏感性,一旦退化就很难被恢复[3].近些年来,在气候变化和人类活动(如放牧、开垦和城市化)的双重压力下[4-5],青藏高原近一半的高寒草地已发生了不同程度的退化[6],成为全球草地退化的热点区域.这种以草地的生产和生态功能下降为主要特征的草地退化,极大地威胁青藏高原生态安全屏障作用的稳定发挥.在此背景下,中国通过颁布和实施草原法、建立自然保护区、划区轮牧、补播、施肥等多项政策与管理措施相结合进行草地保护与恢复,在区域尺度上取得了不错的成效[7].然而,局部地区的草地退化现象仍非常普遍,高寒草甸退化形成的“黑土滩”和高寒草原的草地沙化形势依然严峻[8-9].在此类极度退化的草地上进行人工植被重建是高寒退化草地恢复的必然选择. ...
... 针对不同程度的草地退化已经开展了大量的研究和恢复实践,也形成了众多的恢复技术和措施[9],其恢复效果以地上植被的覆盖度、生产力和土壤养分水平的提高为主要评判指标[10].值得注意的是,长期的恢复实践也促使人们逐渐认识到近自然恢复的重要性,它强调了基于生物多样性、生态系统多功能性和多服务性及生态系统稳定性为目标的协同恢复[11].其中,适宜物种的选择与搭配是近自然恢复面临的重要问题,特别是在极度退化草地上进行人工植被重建时,可供选择的植物物种非常有限[11].目前,许多学者已从植被[12]、土壤[12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
青藏高寒区退化草地生态恢复:退化现状、恢复措施、效应与展望
1
2019
... 针对不同程度的草地退化已经开展了大量的研究和恢复实践,也形成了众多的恢复技术和措施[9],其恢复效果以地上植被的覆盖度、生产力和土壤养分水平的提高为主要评判指标[10].值得注意的是,长期的恢复实践也促使人们逐渐认识到近自然恢复的重要性,它强调了基于生物多样性、生态系统多功能性和多服务性及生态系统稳定性为目标的协同恢复[11].其中,适宜物种的选择与搭配是近自然恢复面临的重要问题,特别是在极度退化草地上进行人工植被重建时,可供选择的植物物种非常有限[11].目前,许多学者已从植被[12]、土壤[12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
退化高寒草地的近自然恢复:理论基础与技术途径
2
2020
... 针对不同程度的草地退化已经开展了大量的研究和恢复实践,也形成了众多的恢复技术和措施[9],其恢复效果以地上植被的覆盖度、生产力和土壤养分水平的提高为主要评判指标[10].值得注意的是,长期的恢复实践也促使人们逐渐认识到近自然恢复的重要性,它强调了基于生物多样性、生态系统多功能性和多服务性及生态系统稳定性为目标的协同恢复[11].其中,适宜物种的选择与搭配是近自然恢复面临的重要问题,特别是在极度退化草地上进行人工植被重建时,可供选择的植物物种非常有限[11].目前,许多学者已从植被[12]、土壤[12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
... [11].目前,许多学者已从植被[12]、土壤[12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
青藏高原退化高寒草地恢复对不同措施响应的Meta分析
2
2021
... 针对不同程度的草地退化已经开展了大量的研究和恢复实践,也形成了众多的恢复技术和措施[9],其恢复效果以地上植被的覆盖度、生产力和土壤养分水平的提高为主要评判指标[10].值得注意的是,长期的恢复实践也促使人们逐渐认识到近自然恢复的重要性,它强调了基于生物多样性、生态系统多功能性和多服务性及生态系统稳定性为目标的协同恢复[11].其中,适宜物种的选择与搭配是近自然恢复面临的重要问题,特别是在极度退化草地上进行人工植被重建时,可供选择的植物物种非常有限[11].目前,许多学者已从植被[12]、土壤[12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
... [12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
人工植被重建对沙化高寒草地土壤真菌群落特征的影响
2
2023
... 针对不同程度的草地退化已经开展了大量的研究和恢复实践,也形成了众多的恢复技术和措施[9],其恢复效果以地上植被的覆盖度、生产力和土壤养分水平的提高为主要评判指标[10].值得注意的是,长期的恢复实践也促使人们逐渐认识到近自然恢复的重要性,它强调了基于生物多样性、生态系统多功能性和多服务性及生态系统稳定性为目标的协同恢复[11].其中,适宜物种的选择与搭配是近自然恢复面临的重要问题,特别是在极度退化草地上进行人工植被重建时,可供选择的植物物种非常有限[11].目前,许多学者已从植被[12]、土壤[12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
... 研究区位于青海省贵南县过马营镇,平均海拔3 107 m.该区域属于典型的大陆性高原气候,雨热同期.年平均气温2.3 ℃,年降水量391 mm,降水集中在7—8月,年蒸发量超过1 300 mm.自然景观以天然草地和人工饲草地为主,主要优势植物包括早熟禾(Poa annua)、丛生黄耆(Astragalus confertus)、矮嵩草(Kobresia humilis)、多色苦菜(Ixeris chinensis)等.土壤类型以栗钙土为主.自20世纪80年代以来,该地区由于过度放牧、气候变化、自然侵蚀以及不合理的人为活动等多种因素共同作用,陆续出现了以植被覆盖度降低、生产力下降、生物多样性丧失为主要特征的草地退化现象,部分区域,特别是较为干旱的山地南坡草地,已经出现了完全沙化的极度退化现象(图1).为了遏制草地的进一步退化,当地政府和牧民陆续采取了围封、减畜、划区轮牧、人工饲草地建植等一系列的草地管理措施.针对完全沙化的重度退化草地,分别利用草本植物(早熟禾、丛生黄耆等)和灌木(如柠条Caragana korshinskii)物种进行人工植被重建,有效促进了当地的生态恢复[13-14]. ...
沙化和人工植被重建对高寒草地土壤细菌群落特征的影响
2
2022
... 针对不同程度的草地退化已经开展了大量的研究和恢复实践,也形成了众多的恢复技术和措施[9],其恢复效果以地上植被的覆盖度、生产力和土壤养分水平的提高为主要评判指标[10].值得注意的是,长期的恢复实践也促使人们逐渐认识到近自然恢复的重要性,它强调了基于生物多样性、生态系统多功能性和多服务性及生态系统稳定性为目标的协同恢复[11].其中,适宜物种的选择与搭配是近自然恢复面临的重要问题,特别是在极度退化草地上进行人工植被重建时,可供选择的植物物种非常有限[11].目前,许多学者已从植被[12]、土壤[12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
... 研究区位于青海省贵南县过马营镇,平均海拔3 107 m.该区域属于典型的大陆性高原气候,雨热同期.年平均气温2.3 ℃,年降水量391 mm,降水集中在7—8月,年蒸发量超过1 300 mm.自然景观以天然草地和人工饲草地为主,主要优势植物包括早熟禾(Poa annua)、丛生黄耆(Astragalus confertus)、矮嵩草(Kobresia humilis)、多色苦菜(Ixeris chinensis)等.土壤类型以栗钙土为主.自20世纪80年代以来,该地区由于过度放牧、气候变化、自然侵蚀以及不合理的人为活动等多种因素共同作用,陆续出现了以植被覆盖度降低、生产力下降、生物多样性丧失为主要特征的草地退化现象,部分区域,特别是较为干旱的山地南坡草地,已经出现了完全沙化的极度退化现象(图1).为了遏制草地的进一步退化,当地政府和牧民陆续采取了围封、减畜、划区轮牧、人工饲草地建植等一系列的草地管理措施.针对完全沙化的重度退化草地,分别利用草本植物(早熟禾、丛生黄耆等)和灌木(如柠条Caragana korshinskii)物种进行人工植被重建,有效促进了当地的生态恢复[13-14]. ...
Soil structure and microbiome functions in agroecosystems
2
2023
... 针对不同程度的草地退化已经开展了大量的研究和恢复实践,也形成了众多的恢复技术和措施[9],其恢复效果以地上植被的覆盖度、生产力和土壤养分水平的提高为主要评判指标[10].值得注意的是,长期的恢复实践也促使人们逐渐认识到近自然恢复的重要性,它强调了基于生物多样性、生态系统多功能性和多服务性及生态系统稳定性为目标的协同恢复[11].其中,适宜物种的选择与搭配是近自然恢复面临的重要问题,特别是在极度退化草地上进行人工植被重建时,可供选择的植物物种非常有限[11].目前,许多学者已从植被[12]、土壤[12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
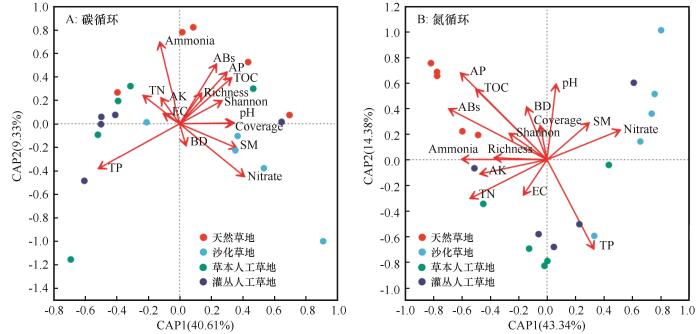
... 目前,土壤微生物结构和功能与环境因子之间密切相关已达成广泛共识[46].草地沙化和植被重建往往通过改变土壤的理化属性来重塑高寒草地土壤微生物的群落结构[15-16].类似地,本研究也发现与碳氮循环相关的微生物功能群结构与绝大多数环境因子之间存在正相关关系(表3),环境因子对这类功能群结构变异的解释度高达50%,表明植被和土壤质量的改善是高寒草甸稳定发挥其碳氮循环功能的关键,也是退化草地进行恢复实践所要关注的重点.植被盖度、植物物种多样性与碳氮循环的相关微生物功能群结构显著正相关,反映了草地生产力和群落结构的稳定性对于碳氮循环微生物功能群的积极影响.一方面,高的植被盖度和多样性会增加植物的光合作用和生物量的积累,从而为相关功能微生物提供更多的碳源和氮源[47].另一方面,植物根系分泌物的输入和根际微生物的定居也会协同促进土壤中碳氮的积累和转化[48].较高的物种多样性也可能会提高微生物群落对环境变化的适应性,从而有利于土壤的碳氮循环过程[49].土壤水分不仅直接影响微生物的活性,还间接调控植物的水分吸收和生长状态,进而又间接影响土壤中与碳氮循环相关的微生物功能群的结构和活性[21].土壤全氮和总有机碳水平反映了其碳氮的储存和供应能力,这些因子会进一步通过影响微生物的代谢活性来改变碳氮循环的效率.然而,一些指标(如pH、容重、全磷和铵态氮)与碳氮循环相关微生物功能群结构并不相关,这说明环境因子对微生物功能群的相对重要性存在差异,并因微生物功能群的不同而异. ...
Review of the roles of plants and soil microorganisms in regulating ecosystem nutrient cycling
2
2010
... 针对不同程度的草地退化已经开展了大量的研究和恢复实践,也形成了众多的恢复技术和措施[9],其恢复效果以地上植被的覆盖度、生产力和土壤养分水平的提高为主要评判指标[10].值得注意的是,长期的恢复实践也促使人们逐渐认识到近自然恢复的重要性,它强调了基于生物多样性、生态系统多功能性和多服务性及生态系统稳定性为目标的协同恢复[11].其中,适宜物种的选择与搭配是近自然恢复面临的重要问题,特别是在极度退化草地上进行人工植被重建时,可供选择的植物物种非常有限[11].目前,许多学者已从植被[12]、土壤[12]和土壤微生物[13-14]等方面研究评价了高寒草地生态恢复一段时间后的成效,但很少有研究从土壤微生物功能的角度对比不同恢复措施之间的优劣性,导致近自然恢复为目标的评价体系不够全面.众所周知,土壤微生物在介导生态系统内部及其与外界之间物质与能量循环方面起着不可替代的作用,从而直接或间接地影响生态系统的结构和功能[15].其中,碳氮循环作为维持生态系统稳定的关键过程而备受人们的关注[16]. ...
... 目前,土壤微生物结构和功能与环境因子之间密切相关已达成广泛共识[46].草地沙化和植被重建往往通过改变土壤的理化属性来重塑高寒草地土壤微生物的群落结构[15-16].类似地,本研究也发现与碳氮循环相关的微生物功能群结构与绝大多数环境因子之间存在正相关关系(表3),环境因子对这类功能群结构变异的解释度高达50%,表明植被和土壤质量的改善是高寒草甸稳定发挥其碳氮循环功能的关键,也是退化草地进行恢复实践所要关注的重点.植被盖度、植物物种多样性与碳氮循环的相关微生物功能群结构显著正相关,反映了草地生产力和群落结构的稳定性对于碳氮循环微生物功能群的积极影响.一方面,高的植被盖度和多样性会增加植物的光合作用和生物量的积累,从而为相关功能微生物提供更多的碳源和氮源[47].另一方面,植物根系分泌物的输入和根际微生物的定居也会协同促进土壤中碳氮的积累和转化[48].较高的物种多样性也可能会提高微生物群落对环境变化的适应性,从而有利于土壤的碳氮循环过程[49].土壤水分不仅直接影响微生物的活性,还间接调控植物的水分吸收和生长状态,进而又间接影响土壤中与碳氮循环相关的微生物功能群的结构和活性[21].土壤全氮和总有机碳水平反映了其碳氮的储存和供应能力,这些因子会进一步通过影响微生物的代谢活性来改变碳氮循环的效率.然而,一些指标(如pH、容重、全磷和铵态氮)与碳氮循环相关微生物功能群结构并不相关,这说明环境因子对微生物功能群的相对重要性存在差异,并因微生物功能群的不同而异. ...
Ecological insights into soil health according to the genomic traits and environment-wide associations of bacteria in agricultural soils
1
2023
... 近年来,随着分子生物学技术的迅速发展和逐渐成熟,尤其是以基因组学为代表的分子生物学技术的广泛应用,极大地丰富和加深了我们对土壤微生物结构和功能的认知[17].其中,宏基因组测序技术就是一项剖析土壤微生物结构和功能的重要手段[18].本文以青藏高原高寒草原沙化后的恢复草地为研究对象,以宏基因组测序技术为手段,对比分析了恢复22年后分别由草本植物和灌木植物构建的与碳氮循环相关的土壤微生物功能群的差异,并剖析了其关键影响因素,从微生物功能的角度为青藏高原高寒退化草地的恢复与治理提供依据. ...
Structure and function of the global topsoil microbiome
1
2018
... 近年来,随着分子生物学技术的迅速发展和逐渐成熟,尤其是以基因组学为代表的分子生物学技术的广泛应用,极大地丰富和加深了我们对土壤微生物结构和功能的认知[17].其中,宏基因组测序技术就是一项剖析土壤微生物结构和功能的重要手段[18].本文以青藏高原高寒草原沙化后的恢复草地为研究对象,以宏基因组测序技术为手段,对比分析了恢复22年后分别由草本植物和灌木植物构建的与碳氮循环相关的土壤微生物功能群的差异,并剖析了其关键影响因素,从微生物功能的角度为青藏高原高寒退化草地的恢复与治理提供依据. ...
1
1982
... 土壤水分采用烘干法测定,在105 ℃下烘干至恒重后称重,计算土壤含水量(SM).采用电位法(土∶水=1∶2.5)测定pH值和电导率(EC).利用Costech元素分析仪(ESC4010,Valencia,CA)测定总有机碳(TOC)和全氮(TN).全磷(TP)采用酸溶-钼锑抗比色法进行测定,有效磷(AP)采用NaHCO3浸提-钼锑抗比色法测定[19].有效钾(AK)采用NH4OAc浸提火焰光度计法进行测定[20].用2 mol·L-1 KCl(水∶土=1∶2.5)提取40 g鲜土中的无机氮,在室温下震荡1 h后静置30 min,再用#40滤纸过滤后在连续流动分析仪(Skarlar Analytical,荷兰)上测定滤液中的硝态氮(NO-N)和铵态氮(NH-N)的浓度. ...
1
2000
... 土壤水分采用烘干法测定,在105 ℃下烘干至恒重后称重,计算土壤含水量(SM).采用电位法(土∶水=1∶2.5)测定pH值和电导率(EC).利用Costech元素分析仪(ESC4010,Valencia,CA)测定总有机碳(TOC)和全氮(TN).全磷(TP)采用酸溶-钼锑抗比色法进行测定,有效磷(AP)采用NaHCO3浸提-钼锑抗比色法测定[19].有效钾(AK)采用NH4OAc浸提火焰光度计法进行测定[20].用2 mol·L-1 KCl(水∶土=1∶2.5)提取40 g鲜土中的无机氮,在室温下震荡1 h后静置30 min,再用#40滤纸过滤后在连续流动分析仪(Skarlar Analytical,荷兰)上测定滤液中的硝态氮(NO-N)和铵态氮(NH-N)的浓度. ...
Prodigal: prokaryotic gene recognition and translation initiation site identification
2
2010
... 采用fastp (v 0.20.0)软件对原始测序数据进行质控和优化,去除接头和长度小于50 bp、平均碱基质量值低于20以及含N碱基的低质量DNA片段.然后,用 Megahit (v 1.1.2)软件对优化后的DNA序列进行拼接和组装为≥300 bp的contigs,利用Prodigal (v 4.6.3)对拼接结果中的contigs进行ORF预测[21].选择核酸长度≥100 bp的基因将其翻译为氨基酸序列.再利用CD-HIT软件在相似度和覆盖度均为90%的条件下将ORFs进行聚类,构建非冗余基因集,并用SOAPaligner (v 2.21)软件在95%的识别率下分别将每个样品的高质量reads与非冗余基因集进行比对,统计基因在对应样品中的丰度信息. ...
... 目前,土壤微生物结构和功能与环境因子之间密切相关已达成广泛共识[46].草地沙化和植被重建往往通过改变土壤的理化属性来重塑高寒草地土壤微生物的群落结构[15-16].类似地,本研究也发现与碳氮循环相关的微生物功能群结构与绝大多数环境因子之间存在正相关关系(表3),环境因子对这类功能群结构变异的解释度高达50%,表明植被和土壤质量的改善是高寒草甸稳定发挥其碳氮循环功能的关键,也是退化草地进行恢复实践所要关注的重点.植被盖度、植物物种多样性与碳氮循环的相关微生物功能群结构显著正相关,反映了草地生产力和群落结构的稳定性对于碳氮循环微生物功能群的积极影响.一方面,高的植被盖度和多样性会增加植物的光合作用和生物量的积累,从而为相关功能微生物提供更多的碳源和氮源[47].另一方面,植物根系分泌物的输入和根际微生物的定居也会协同促进土壤中碳氮的积累和转化[48].较高的物种多样性也可能会提高微生物群落对环境变化的适应性,从而有利于土壤的碳氮循环过程[49].土壤水分不仅直接影响微生物的活性,还间接调控植物的水分吸收和生长状态,进而又间接影响土壤中与碳氮循环相关的微生物功能群的结构和活性[21].土壤全氮和总有机碳水平反映了其碳氮的储存和供应能力,这些因子会进一步通过影响微生物的代谢活性来改变碳氮循环的效率.然而,一些指标(如pH、容重、全磷和铵态氮)与碳氮循环相关微生物功能群结构并不相关,这说明环境因子对微生物功能群的相对重要性存在差异,并因微生物功能群的不同而异. ...
Influence of ecological restoration on vegetation and soil microbiological properties in alpine-cold semi-humid desertified land
1
2016
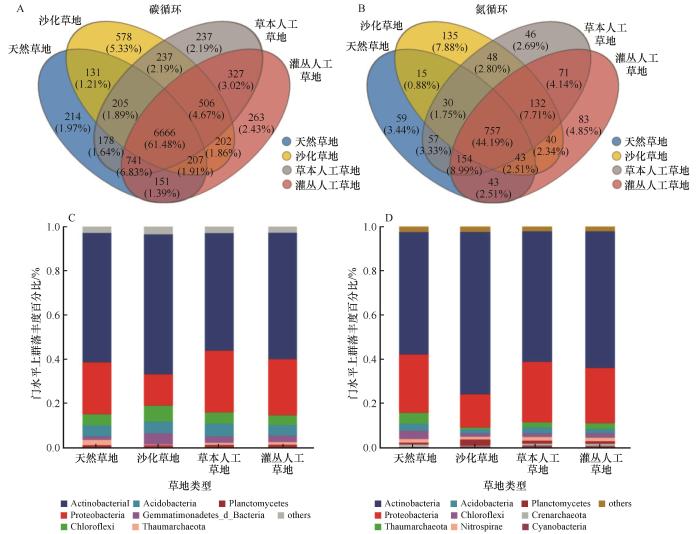
... 土壤微生物群落结构特征是指示退化草地生态恢复状况的关键指标[22-26].作为驱动碳氮循环的关键生物类群,与碳氮循环相关的微生物功能群的结构对于土壤碳氮循环过程至关重要[27-28].本研究发现,草地沙化显著降低了参与碳氮循环的土壤微生物功能群的Shannon-Wiener多样性指数,人工植被重建则使其得以显著提升,这与大多数之前的报道一致,主要与土壤环境的恶化或改善密切相关[29].同时,人工植被与微生物之间的相互作用(如根际微生物的共生关系)可能进一步促使此类功能微生物多样性的增加[30].然而,沙化草地和恢复草地与碳氮循环相关的微生物功能群的丰富度显著高于未退化的天然草地,表明高寒草地沙化和人工恢复草地中定居了更多与碳氮循环相关的外来微生物物种,其相对较高的特有物种数比例也间接印证了这一点(图2).草本人工草地和灌丛人工草地的Simpson指数显著低于沙化草地,表明人工植被重建不仅提高了土壤中与碳氮循环相关微生物功能群的丰富度,也增加了其均匀度,这可能是由于在相对一致的沙化土壤环境上重建的人工植被为此类微生物提供了相对均匀的生境和资源,从而促进了这些微生物群落的均衡发展[31]. ...
Response of soil labile organic carbon fractions and carbon-cycle enzyme activities to vegetation degradation in a wet meadow on the Qinghai-Tibet Plateau
2020
Global soil carbon projections are improved by modelling microbial processes
2013
Microbial formation of stable soil carbon is more efficient from belowground than aboveground input
2019
Effects of different artificial vegetation restoration modes on soil microbial community structure in the soil erosion area of southern China
1
2024
... 土壤微生物群落结构特征是指示退化草地生态恢复状况的关键指标[22-26].作为驱动碳氮循环的关键生物类群,与碳氮循环相关的微生物功能群的结构对于土壤碳氮循环过程至关重要[27-28].本研究发现,草地沙化显著降低了参与碳氮循环的土壤微生物功能群的Shannon-Wiener多样性指数,人工植被重建则使其得以显著提升,这与大多数之前的报道一致,主要与土壤环境的恶化或改善密切相关[29].同时,人工植被与微生物之间的相互作用(如根际微生物的共生关系)可能进一步促使此类功能微生物多样性的增加[30].然而,沙化草地和恢复草地与碳氮循环相关的微生物功能群的丰富度显著高于未退化的天然草地,表明高寒草地沙化和人工恢复草地中定居了更多与碳氮循环相关的外来微生物物种,其相对较高的特有物种数比例也间接印证了这一点(图2).草本人工草地和灌丛人工草地的Simpson指数显著低于沙化草地,表明人工植被重建不仅提高了土壤中与碳氮循环相关微生物功能群的丰富度,也增加了其均匀度,这可能是由于在相对一致的沙化土壤环境上重建的人工植被为此类微生物提供了相对均匀的生境和资源,从而促进了这些微生物群落的均衡发展[31]. ...
根系构型研究进展:功能、影响因子和研究方法
1
2023
... 土壤微生物群落结构特征是指示退化草地生态恢复状况的关键指标[22-26].作为驱动碳氮循环的关键生物类群,与碳氮循环相关的微生物功能群的结构对于土壤碳氮循环过程至关重要[27-28].本研究发现,草地沙化显著降低了参与碳氮循环的土壤微生物功能群的Shannon-Wiener多样性指数,人工植被重建则使其得以显著提升,这与大多数之前的报道一致,主要与土壤环境的恶化或改善密切相关[29].同时,人工植被与微生物之间的相互作用(如根际微生物的共生关系)可能进一步促使此类功能微生物多样性的增加[30].然而,沙化草地和恢复草地与碳氮循环相关的微生物功能群的丰富度显著高于未退化的天然草地,表明高寒草地沙化和人工恢复草地中定居了更多与碳氮循环相关的外来微生物物种,其相对较高的特有物种数比例也间接印证了这一点(图2).草本人工草地和灌丛人工草地的Simpson指数显著低于沙化草地,表明人工植被重建不仅提高了土壤中与碳氮循环相关微生物功能群的丰富度,也增加了其均匀度,这可能是由于在相对一致的沙化土壤环境上重建的人工植被为此类微生物提供了相对均匀的生境和资源,从而促进了这些微生物群落的均衡发展[31]. ...
The impact of artificial afforestation on the soil microbial community and function in desertified areas of NW China
1
2024
... 土壤微生物群落结构特征是指示退化草地生态恢复状况的关键指标[22-26].作为驱动碳氮循环的关键生物类群,与碳氮循环相关的微生物功能群的结构对于土壤碳氮循环过程至关重要[27-28].本研究发现,草地沙化显著降低了参与碳氮循环的土壤微生物功能群的Shannon-Wiener多样性指数,人工植被重建则使其得以显著提升,这与大多数之前的报道一致,主要与土壤环境的恶化或改善密切相关[29].同时,人工植被与微生物之间的相互作用(如根际微生物的共生关系)可能进一步促使此类功能微生物多样性的增加[30].然而,沙化草地和恢复草地与碳氮循环相关的微生物功能群的丰富度显著高于未退化的天然草地,表明高寒草地沙化和人工恢复草地中定居了更多与碳氮循环相关的外来微生物物种,其相对较高的特有物种数比例也间接印证了这一点(图2).草本人工草地和灌丛人工草地的Simpson指数显著低于沙化草地,表明人工植被重建不仅提高了土壤中与碳氮循环相关微生物功能群的丰富度,也增加了其均匀度,这可能是由于在相对一致的沙化土壤环境上重建的人工植被为此类微生物提供了相对均匀的生境和资源,从而促进了这些微生物群落的均衡发展[31]. ...
Metagenomic insights into microbial community structure and metabolism in alpine permafrost on the Tibetan Plateau
1
2024
... 土壤微生物群落结构特征是指示退化草地生态恢复状况的关键指标[22-26].作为驱动碳氮循环的关键生物类群,与碳氮循环相关的微生物功能群的结构对于土壤碳氮循环过程至关重要[27-28].本研究发现,草地沙化显著降低了参与碳氮循环的土壤微生物功能群的Shannon-Wiener多样性指数,人工植被重建则使其得以显著提升,这与大多数之前的报道一致,主要与土壤环境的恶化或改善密切相关[29].同时,人工植被与微生物之间的相互作用(如根际微生物的共生关系)可能进一步促使此类功能微生物多样性的增加[30].然而,沙化草地和恢复草地与碳氮循环相关的微生物功能群的丰富度显著高于未退化的天然草地,表明高寒草地沙化和人工恢复草地中定居了更多与碳氮循环相关的外来微生物物种,其相对较高的特有物种数比例也间接印证了这一点(图2).草本人工草地和灌丛人工草地的Simpson指数显著低于沙化草地,表明人工植被重建不仅提高了土壤中与碳氮循环相关微生物功能群的丰富度,也增加了其均匀度,这可能是由于在相对一致的沙化土壤环境上重建的人工植被为此类微生物提供了相对均匀的生境和资源,从而促进了这些微生物群落的均衡发展[31]. ...
我国草地生态系统碳循环机制及碳蓄积核算研究回顾与展望
1
2021
... 土壤微生物群落结构特征是指示退化草地生态恢复状况的关键指标[22-26].作为驱动碳氮循环的关键生物类群,与碳氮循环相关的微生物功能群的结构对于土壤碳氮循环过程至关重要[27-28].本研究发现,草地沙化显著降低了参与碳氮循环的土壤微生物功能群的Shannon-Wiener多样性指数,人工植被重建则使其得以显著提升,这与大多数之前的报道一致,主要与土壤环境的恶化或改善密切相关[29].同时,人工植被与微生物之间的相互作用(如根际微生物的共生关系)可能进一步促使此类功能微生物多样性的增加[30].然而,沙化草地和恢复草地与碳氮循环相关的微生物功能群的丰富度显著高于未退化的天然草地,表明高寒草地沙化和人工恢复草地中定居了更多与碳氮循环相关的外来微生物物种,其相对较高的特有物种数比例也间接印证了这一点(图2).草本人工草地和灌丛人工草地的Simpson指数显著低于沙化草地,表明人工植被重建不仅提高了土壤中与碳氮循环相关微生物功能群的丰富度,也增加了其均匀度,这可能是由于在相对一致的沙化土壤环境上重建的人工植被为此类微生物提供了相对均匀的生境和资源,从而促进了这些微生物群落的均衡发展[31]. ...
A Cellulolytic Streptomyces Sp.isolated from a highly oligotrophic niche shows potential for hydrolyzing agricultural wastes
1
2021
... 土壤微生物群落结构特征是指示退化草地生态恢复状况的关键指标[22-26].作为驱动碳氮循环的关键生物类群,与碳氮循环相关的微生物功能群的结构对于土壤碳氮循环过程至关重要[27-28].本研究发现,草地沙化显著降低了参与碳氮循环的土壤微生物功能群的Shannon-Wiener多样性指数,人工植被重建则使其得以显著提升,这与大多数之前的报道一致,主要与土壤环境的恶化或改善密切相关[29].同时,人工植被与微生物之间的相互作用(如根际微生物的共生关系)可能进一步促使此类功能微生物多样性的增加[30].然而,沙化草地和恢复草地与碳氮循环相关的微生物功能群的丰富度显著高于未退化的天然草地,表明高寒草地沙化和人工恢复草地中定居了更多与碳氮循环相关的外来微生物物种,其相对较高的特有物种数比例也间接印证了这一点(图2).草本人工草地和灌丛人工草地的Simpson指数显著低于沙化草地,表明人工植被重建不仅提高了土壤中与碳氮循环相关微生物功能群的丰富度,也增加了其均匀度,这可能是由于在相对一致的沙化土壤环境上重建的人工植被为此类微生物提供了相对均匀的生境和资源,从而促进了这些微生物群落的均衡发展[31]. ...
Extreme trophic tales: deciphering bacterial diversity and potential functions in oligotrophic and hypereutrophic lakes
1
2024
... 尽管不同草地类型与碳氮循环相关的微生物功能群结构存在显著差异(图3),但仍有近一半或以上的微生物功能群被所有草地类型所共有(图2).其中,放线菌门和变形菌门在所有草地类型中均占据主导地位,表明这类微生物在碳氮循环中,尤其是在碳的固定与分解和氮转化过程中均扮演着关键角色[32-33],因此其群落结构的构建和功能是今后研究中需要关注的重点.值得注意的是,草地沙化后放线菌门的相对丰度增加,而变形菌门的相对丰度却明显降低,人工植被重建后其变化则恰好相反,这一发现支持了两类微生物对营养型偏好的差异[34-35].此外,绿弯菌门和酸杆菌门在碳循环中也占有一定比例[36].奇古菌门在天然草地中的丰度比其他草地类型更高,这类古菌通过催化氨氧化获取能量并进行自养生长的代谢[37],天然草地中较高的有机质含量和适宜的环境条件可能有利于氨氧化古菌的生长[38].浮霉菌门的相对丰度在沙化草地较其他草地类型更高,这可能与它们对环境的较强适应性有关[39]. ...
Two Chloroflexi classes independently evolved the ability to persist on atmospheric hydrogen and carbon monoxide
1
2019
... 尽管不同草地类型与碳氮循环相关的微生物功能群结构存在显著差异(图3),但仍有近一半或以上的微生物功能群被所有草地类型所共有(图2).其中,放线菌门和变形菌门在所有草地类型中均占据主导地位,表明这类微生物在碳氮循环中,尤其是在碳的固定与分解和氮转化过程中均扮演着关键角色[32-33],因此其群落结构的构建和功能是今后研究中需要关注的重点.值得注意的是,草地沙化后放线菌门的相对丰度增加,而变形菌门的相对丰度却明显降低,人工植被重建后其变化则恰好相反,这一发现支持了两类微生物对营养型偏好的差异[34-35].此外,绿弯菌门和酸杆菌门在碳循环中也占有一定比例[36].奇古菌门在天然草地中的丰度比其他草地类型更高,这类古菌通过催化氨氧化获取能量并进行自养生长的代谢[37],天然草地中较高的有机质含量和适宜的环境条件可能有利于氨氧化古菌的生长[38].浮霉菌门的相对丰度在沙化草地较其他草地类型更高,这可能与它们对环境的较强适应性有关[39]. ...
Isolation of an autotrophic ammonia-oxidizing marine archaeon
1
2005
... 尽管不同草地类型与碳氮循环相关的微生物功能群结构存在显著差异(图3),但仍有近一半或以上的微生物功能群被所有草地类型所共有(图2).其中,放线菌门和变形菌门在所有草地类型中均占据主导地位,表明这类微生物在碳氮循环中,尤其是在碳的固定与分解和氮转化过程中均扮演着关键角色[32-33],因此其群落结构的构建和功能是今后研究中需要关注的重点.值得注意的是,草地沙化后放线菌门的相对丰度增加,而变形菌门的相对丰度却明显降低,人工植被重建后其变化则恰好相反,这一发现支持了两类微生物对营养型偏好的差异[34-35].此外,绿弯菌门和酸杆菌门在碳循环中也占有一定比例[36].奇古菌门在天然草地中的丰度比其他草地类型更高,这类古菌通过催化氨氧化获取能量并进行自养生长的代谢[37],天然草地中较高的有机质含量和适宜的环境条件可能有利于氨氧化古菌的生长[38].浮霉菌门的相对丰度在沙化草地较其他草地类型更高,这可能与它们对环境的较强适应性有关[39]. ...
Ammonia-oxidizing archaea possess a wide range of cellular ammonia affinities
1
2022
... 尽管不同草地类型与碳氮循环相关的微生物功能群结构存在显著差异(图3),但仍有近一半或以上的微生物功能群被所有草地类型所共有(图2).其中,放线菌门和变形菌门在所有草地类型中均占据主导地位,表明这类微生物在碳氮循环中,尤其是在碳的固定与分解和氮转化过程中均扮演着关键角色[32-33],因此其群落结构的构建和功能是今后研究中需要关注的重点.值得注意的是,草地沙化后放线菌门的相对丰度增加,而变形菌门的相对丰度却明显降低,人工植被重建后其变化则恰好相反,这一发现支持了两类微生物对营养型偏好的差异[34-35].此外,绿弯菌门和酸杆菌门在碳循环中也占有一定比例[36].奇古菌门在天然草地中的丰度比其他草地类型更高,这类古菌通过催化氨氧化获取能量并进行自养生长的代谢[37],天然草地中较高的有机质含量和适宜的环境条件可能有利于氨氧化古菌的生长[38].浮霉菌门的相对丰度在沙化草地较其他草地类型更高,这可能与它们对环境的较强适应性有关[39]. ...
Diversity,ecological characteristics and identification of some problematic phytopathogenic fusarium in soil: a review
1
2023
... 尽管不同草地类型与碳氮循环相关的微生物功能群结构存在显著差异(图3),但仍有近一半或以上的微生物功能群被所有草地类型所共有(图2).其中,放线菌门和变形菌门在所有草地类型中均占据主导地位,表明这类微生物在碳氮循环中,尤其是在碳的固定与分解和氮转化过程中均扮演着关键角色[32-33],因此其群落结构的构建和功能是今后研究中需要关注的重点.值得注意的是,草地沙化后放线菌门的相对丰度增加,而变形菌门的相对丰度却明显降低,人工植被重建后其变化则恰好相反,这一发现支持了两类微生物对营养型偏好的差异[34-35].此外,绿弯菌门和酸杆菌门在碳循环中也占有一定比例[36].奇古菌门在天然草地中的丰度比其他草地类型更高,这类古菌通过催化氨氧化获取能量并进行自养生长的代谢[37],天然草地中较高的有机质含量和适宜的环境条件可能有利于氨氧化古菌的生长[38].浮霉菌门的相对丰度在沙化草地较其他草地类型更高,这可能与它们对环境的较强适应性有关[39]. ...
Grassland soil carbon sequestration: current understanding,challenges,and solutions
1
2022
... 尽管不同草地类型与碳氮循环相关的微生物功能群结构存在显著差异(图3),但仍有近一半或以上的微生物功能群被所有草地类型所共有(图2).其中,放线菌门和变形菌门在所有草地类型中均占据主导地位,表明这类微生物在碳氮循环中,尤其是在碳的固定与分解和氮转化过程中均扮演着关键角色[32-33],因此其群落结构的构建和功能是今后研究中需要关注的重点.值得注意的是,草地沙化后放线菌门的相对丰度增加,而变形菌门的相对丰度却明显降低,人工植被重建后其变化则恰好相反,这一发现支持了两类微生物对营养型偏好的差异[34-35].此外,绿弯菌门和酸杆菌门在碳循环中也占有一定比例[36].奇古菌门在天然草地中的丰度比其他草地类型更高,这类古菌通过催化氨氧化获取能量并进行自养生长的代谢[37],天然草地中较高的有机质含量和适宜的环境条件可能有利于氨氧化古菌的生长[38].浮霉菌门的相对丰度在沙化草地较其他草地类型更高,这可能与它们对环境的较强适应性有关[39]. ...
Responses of soil microbial metabolic activity and community structure to different degraded and restored grassland gradients of the Tibetan Plateau
1
2022
... 尽管不同草地类型与碳氮循环相关的微生物功能群结构存在显著差异(图3),但仍有近一半或以上的微生物功能群被所有草地类型所共有(图2).其中,放线菌门和变形菌门在所有草地类型中均占据主导地位,表明这类微生物在碳氮循环中,尤其是在碳的固定与分解和氮转化过程中均扮演着关键角色[32-33],因此其群落结构的构建和功能是今后研究中需要关注的重点.值得注意的是,草地沙化后放线菌门的相对丰度增加,而变形菌门的相对丰度却明显降低,人工植被重建后其变化则恰好相反,这一发现支持了两类微生物对营养型偏好的差异[34-35].此外,绿弯菌门和酸杆菌门在碳循环中也占有一定比例[36].奇古菌门在天然草地中的丰度比其他草地类型更高,这类古菌通过催化氨氧化获取能量并进行自养生长的代谢[37],天然草地中较高的有机质含量和适宜的环境条件可能有利于氨氧化古菌的生长[38].浮霉菌门的相对丰度在沙化草地较其他草地类型更高,这可能与它们对环境的较强适应性有关[39]. ...
土地利用驱动的土壤性状变化影响微生物群落结构和功能
1
2021
... 尽管不同草地类型与碳氮循环相关的微生物功能群结构存在显著差异(图3),但仍有近一半或以上的微生物功能群被所有草地类型所共有(图2).其中,放线菌门和变形菌门在所有草地类型中均占据主导地位,表明这类微生物在碳氮循环中,尤其是在碳的固定与分解和氮转化过程中均扮演着关键角色[32-33],因此其群落结构的构建和功能是今后研究中需要关注的重点.值得注意的是,草地沙化后放线菌门的相对丰度增加,而变形菌门的相对丰度却明显降低,人工植被重建后其变化则恰好相反,这一发现支持了两类微生物对营养型偏好的差异[34-35].此外,绿弯菌门和酸杆菌门在碳循环中也占有一定比例[36].奇古菌门在天然草地中的丰度比其他草地类型更高,这类古菌通过催化氨氧化获取能量并进行自养生长的代谢[37],天然草地中较高的有机质含量和适宜的环境条件可能有利于氨氧化古菌的生长[38].浮霉菌门的相对丰度在沙化草地较其他草地类型更高,这可能与它们对环境的较强适应性有关[39]. ...
Progressive nitrogen limitation of ecosystem responses to rising atmospheric carbon dioxide
1
2004
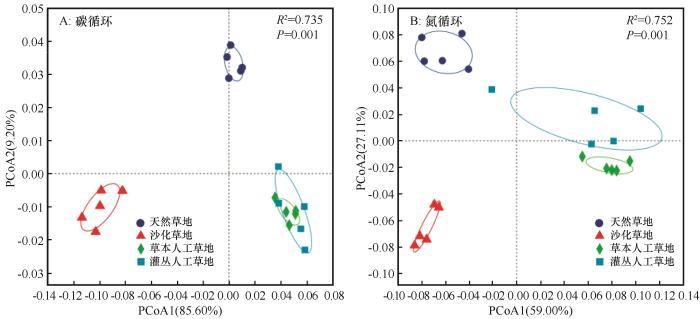
... 不同草地类型之间与碳氮循环相关的微生物功能群在结构上差异显著(图3),草本人工草地与灌丛人工草地之间的碳氮循环相关的微生物功能群结构更为相似,但二者之间仍存在显著差异.这表明草地退化和恢复均能有效地重塑此类功能微生物的结构而导致其潜在生理生态代谢功能和能量产生方面的差异(图4),这些变化与不同草地类型中植物组成和微生物功能群的生长状况密切相关[40].然而,即使是在长达22年的生态恢复实践后,不同植被类型的碳氮循环相关微生物功能群依然与天然草地存在显著差异.因此,保护青藏高原高寒草地,防治其退化对于维持土壤微生物功能群的原真性和完整性具有重要意义[41]. ...
腾格里沙漠东南缘藻结皮与藓结皮放线菌多样性及其潜在代谢功能
1
2020
... 不同草地类型之间与碳氮循环相关的微生物功能群在结构上差异显著(图3),草本人工草地与灌丛人工草地之间的碳氮循环相关的微生物功能群结构更为相似,但二者之间仍存在显著差异.这表明草地退化和恢复均能有效地重塑此类功能微生物的结构而导致其潜在生理生态代谢功能和能量产生方面的差异(图4),这些变化与不同草地类型中植物组成和微生物功能群的生长状况密切相关[40].然而,即使是在长达22年的生态恢复实践后,不同植被类型的碳氮循环相关微生物功能群依然与天然草地存在显著差异.因此,保护青藏高原高寒草地,防治其退化对于维持土壤微生物功能群的原真性和完整性具有重要意义[41]. ...
草地土壤N2O排放对人为干扰的响应研究进展
1
2025
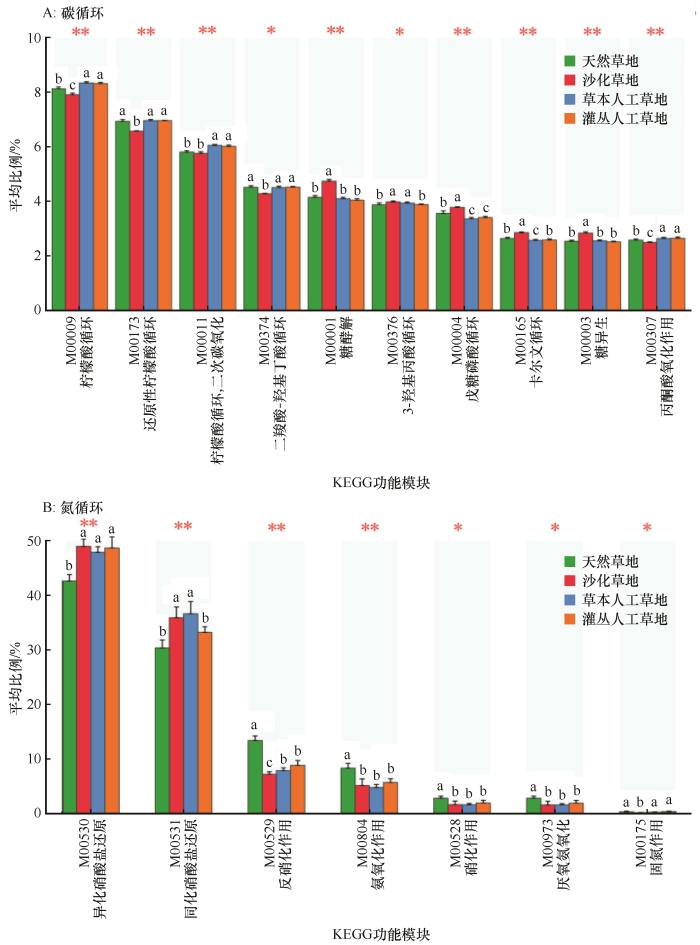
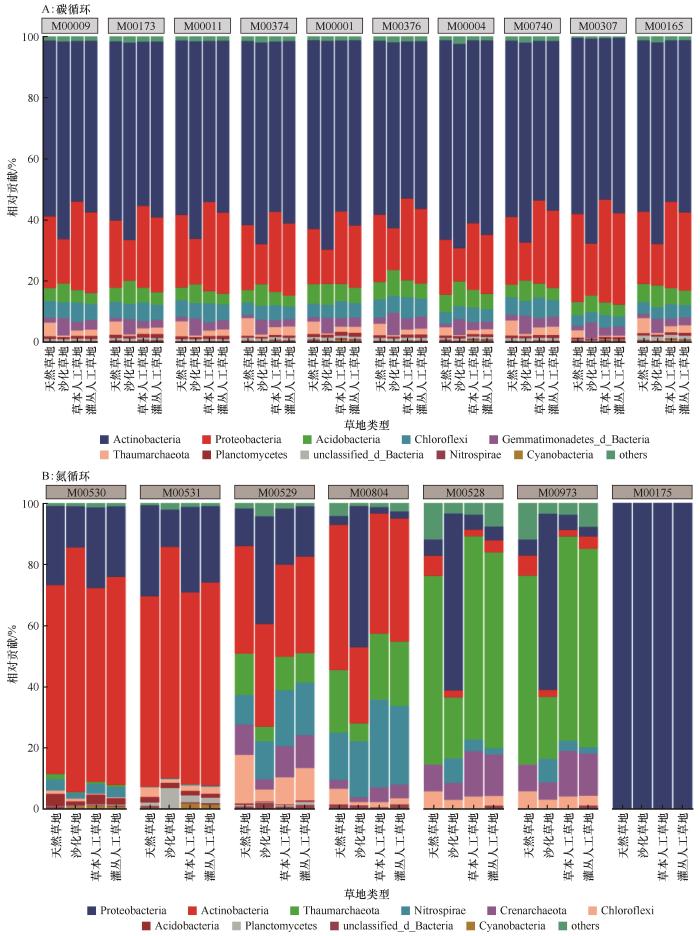
... 草地沙化后其碳循环相关微生物功能群在有机酸氧化(如柠檬酸循环、二羧基-羟基丁酸循环和丙酮酸氧化)方面的潜力明显减弱,而其在糖酵解、卡尔文循环和糖异生作用方面的潜能显著增加(图4),这可能是微生物对土壤中可利用性碳的降低及其环境恶化的生理生态响应[42].然而,两类人工草地的绝大多数碳氮循环相关功能模块的相对丰度并没有差异,且一些关键的碳循环功能模块(如柠檬酸循环)的丰度甚至超过了天然草地,表明不同植被恢复措施在碳循环关键环节的潜在功能可能也没有差异,也预示着人工植被重建在加速退化草地碳循环关键功能方面具有很好的潜力.尽管人工草地中的固氮作用已恢复到了天然草地的水平,但沙化草地和人工草地的硝酸盐还原能力仍高于天然草地,表明其将土壤中的硝酸盐还原为亚硝酸、氨和氮气的能力更强,从而可能加剧生态系统的氮限制[43].同时,人工草地的氨氧化作用、硝化作用和反硝化作用的相对丰度仍然显著低于天然草地,表明土壤氮素转化潜能依然没有得到较好的恢复.由此可见,大多数情况下两种恢复措施对高寒沙化草地碳氮循环关键功能的恢复没有显著差异,但却是不同步的,碳循环相关功能的恢复优于氮循环功能.放线菌门和变形菌门是碳氮循环重要功能模块的主要贡献者,草地沙化增加了放线菌门对多个碳循环功能模块的贡献度,却降低了变形菌门的贡献度(图5),可能与两个功能类群不同的营养偏好有关[44].虽然不同微生物类群对关键碳氮循环功能模块的贡献度因草地类型的不同而异,人工草地和沙化草地之间大多数氮循环关键功能的丰度并没有差异,这在很大程度上归因于微生物的功能冗余[45]. ...
Land use modified impacts of global change factors on soil microbial structure and function:a global hierarchical meta-analysis
1
2024
... 草地沙化后其碳循环相关微生物功能群在有机酸氧化(如柠檬酸循环、二羧基-羟基丁酸循环和丙酮酸氧化)方面的潜力明显减弱,而其在糖酵解、卡尔文循环和糖异生作用方面的潜能显著增加(图4),这可能是微生物对土壤中可利用性碳的降低及其环境恶化的生理生态响应[42].然而,两类人工草地的绝大多数碳氮循环相关功能模块的相对丰度并没有差异,且一些关键的碳循环功能模块(如柠檬酸循环)的丰度甚至超过了天然草地,表明不同植被恢复措施在碳循环关键环节的潜在功能可能也没有差异,也预示着人工植被重建在加速退化草地碳循环关键功能方面具有很好的潜力.尽管人工草地中的固氮作用已恢复到了天然草地的水平,但沙化草地和人工草地的硝酸盐还原能力仍高于天然草地,表明其将土壤中的硝酸盐还原为亚硝酸、氨和氮气的能力更强,从而可能加剧生态系统的氮限制[43].同时,人工草地的氨氧化作用、硝化作用和反硝化作用的相对丰度仍然显著低于天然草地,表明土壤氮素转化潜能依然没有得到较好的恢复.由此可见,大多数情况下两种恢复措施对高寒沙化草地碳氮循环关键功能的恢复没有显著差异,但却是不同步的,碳循环相关功能的恢复优于氮循环功能.放线菌门和变形菌门是碳氮循环重要功能模块的主要贡献者,草地沙化增加了放线菌门对多个碳循环功能模块的贡献度,却降低了变形菌门的贡献度(图5),可能与两个功能类群不同的营养偏好有关[44].虽然不同微生物类群对关键碳氮循环功能模块的贡献度因草地类型的不同而异,人工草地和沙化草地之间大多数氮循环关键功能的丰度并没有差异,这在很大程度上归因于微生物的功能冗余[45]. ...
Regulation of soil nitrogen cycling by shrubs in grasslands
1
2024
... 草地沙化后其碳循环相关微生物功能群在有机酸氧化(如柠檬酸循环、二羧基-羟基丁酸循环和丙酮酸氧化)方面的潜力明显减弱,而其在糖酵解、卡尔文循环和糖异生作用方面的潜能显著增加(图4),这可能是微生物对土壤中可利用性碳的降低及其环境恶化的生理生态响应[42].然而,两类人工草地的绝大多数碳氮循环相关功能模块的相对丰度并没有差异,且一些关键的碳循环功能模块(如柠檬酸循环)的丰度甚至超过了天然草地,表明不同植被恢复措施在碳循环关键环节的潜在功能可能也没有差异,也预示着人工植被重建在加速退化草地碳循环关键功能方面具有很好的潜力.尽管人工草地中的固氮作用已恢复到了天然草地的水平,但沙化草地和人工草地的硝酸盐还原能力仍高于天然草地,表明其将土壤中的硝酸盐还原为亚硝酸、氨和氮气的能力更强,从而可能加剧生态系统的氮限制[43].同时,人工草地的氨氧化作用、硝化作用和反硝化作用的相对丰度仍然显著低于天然草地,表明土壤氮素转化潜能依然没有得到较好的恢复.由此可见,大多数情况下两种恢复措施对高寒沙化草地碳氮循环关键功能的恢复没有显著差异,但却是不同步的,碳循环相关功能的恢复优于氮循环功能.放线菌门和变形菌门是碳氮循环重要功能模块的主要贡献者,草地沙化增加了放线菌门对多个碳循环功能模块的贡献度,却降低了变形菌门的贡献度(图5),可能与两个功能类群不同的营养偏好有关[44].虽然不同微生物类群对关键碳氮循环功能模块的贡献度因草地类型的不同而异,人工草地和沙化草地之间大多数氮循环关键功能的丰度并没有差异,这在很大程度上归因于微生物的功能冗余[45]. ...
Root exudates facilitate the regulation of soil microbial community function in the genus Haloxylon
1
2024
... 草地沙化后其碳循环相关微生物功能群在有机酸氧化(如柠檬酸循环、二羧基-羟基丁酸循环和丙酮酸氧化)方面的潜力明显减弱,而其在糖酵解、卡尔文循环和糖异生作用方面的潜能显著增加(图4),这可能是微生物对土壤中可利用性碳的降低及其环境恶化的生理生态响应[42].然而,两类人工草地的绝大多数碳氮循环相关功能模块的相对丰度并没有差异,且一些关键的碳循环功能模块(如柠檬酸循环)的丰度甚至超过了天然草地,表明不同植被恢复措施在碳循环关键环节的潜在功能可能也没有差异,也预示着人工植被重建在加速退化草地碳循环关键功能方面具有很好的潜力.尽管人工草地中的固氮作用已恢复到了天然草地的水平,但沙化草地和人工草地的硝酸盐还原能力仍高于天然草地,表明其将土壤中的硝酸盐还原为亚硝酸、氨和氮气的能力更强,从而可能加剧生态系统的氮限制[43].同时,人工草地的氨氧化作用、硝化作用和反硝化作用的相对丰度仍然显著低于天然草地,表明土壤氮素转化潜能依然没有得到较好的恢复.由此可见,大多数情况下两种恢复措施对高寒沙化草地碳氮循环关键功能的恢复没有显著差异,但却是不同步的,碳循环相关功能的恢复优于氮循环功能.放线菌门和变形菌门是碳氮循环重要功能模块的主要贡献者,草地沙化增加了放线菌门对多个碳循环功能模块的贡献度,却降低了变形菌门的贡献度(图5),可能与两个功能类群不同的营养偏好有关[44].虽然不同微生物类群对关键碳氮循环功能模块的贡献度因草地类型的不同而异,人工草地和沙化草地之间大多数氮循环关键功能的丰度并没有差异,这在很大程度上归因于微生物的功能冗余[45]. ...
Changes in soil microbial community structure and function following degradation in a temperate grassland
1
2021
... 目前,土壤微生物结构和功能与环境因子之间密切相关已达成广泛共识[46].草地沙化和植被重建往往通过改变土壤的理化属性来重塑高寒草地土壤微生物的群落结构[15-16].类似地,本研究也发现与碳氮循环相关的微生物功能群结构与绝大多数环境因子之间存在正相关关系(表3),环境因子对这类功能群结构变异的解释度高达50%,表明植被和土壤质量的改善是高寒草甸稳定发挥其碳氮循环功能的关键,也是退化草地进行恢复实践所要关注的重点.植被盖度、植物物种多样性与碳氮循环的相关微生物功能群结构显著正相关,反映了草地生产力和群落结构的稳定性对于碳氮循环微生物功能群的积极影响.一方面,高的植被盖度和多样性会增加植物的光合作用和生物量的积累,从而为相关功能微生物提供更多的碳源和氮源[47].另一方面,植物根系分泌物的输入和根际微生物的定居也会协同促进土壤中碳氮的积累和转化[48].较高的物种多样性也可能会提高微生物群落对环境变化的适应性,从而有利于土壤的碳氮循环过程[49].土壤水分不仅直接影响微生物的活性,还间接调控植物的水分吸收和生长状态,进而又间接影响土壤中与碳氮循环相关的微生物功能群的结构和活性[21].土壤全氮和总有机碳水平反映了其碳氮的储存和供应能力,这些因子会进一步通过影响微生物的代谢活性来改变碳氮循环的效率.然而,一些指标(如pH、容重、全磷和铵态氮)与碳氮循环相关微生物功能群结构并不相关,这说明环境因子对微生物功能群的相对重要性存在差异,并因微生物功能群的不同而异. ...





 甘公网安备 62010202000688号
甘公网安备 62010202000688号