Annual fluxes of carbon from deforestation and regrowth in the Brazilian Amazon
1
2000
... 土壤是陆地生态系统中最大、最活跃的碳库,其碳储量分别为植被和大气碳库储量的约3倍和2倍[1],在缓解大气温室气体浓度升高方面具有显著潜力[2].植物可通过光合作用将CO2转化为有机质,并以凋落物、根系分泌物等形式输入土壤,是土壤有机碳(SOC)的重要来源[3].与此同时,除了植物外,土壤微生物也具有固定CO2的能力,虽固碳量低于植物,但微生物种类多、分布范围广,尤其在碳限制型生态系统中,微生物固碳对维持自身功能多样性以及生态系统碳循环过程具有重要意义[4].与植物源碳相比,微生物固定的碳可被微生物直接同化,并在微生物死亡后以微生物残体碳(MNC)等更稳定的形式存储于土壤,有利于土壤碳固存和累积[5].因此,系统解析土壤固碳微生物的类群组成、代谢特性及其固碳机制,不仅有助于完善陆地碳循环理论体系,也可以为开发基于微生物调控的碳汇增强技术提供科学依据. ...
从生物地球化学视角理解土壤碳封存的机制和潜在途径
1
2024
... 土壤是陆地生态系统中最大、最活跃的碳库,其碳储量分别为植被和大气碳库储量的约3倍和2倍[1],在缓解大气温室气体浓度升高方面具有显著潜力[2].植物可通过光合作用将CO2转化为有机质,并以凋落物、根系分泌物等形式输入土壤,是土壤有机碳(SOC)的重要来源[3].与此同时,除了植物外,土壤微生物也具有固定CO2的能力,虽固碳量低于植物,但微生物种类多、分布范围广,尤其在碳限制型生态系统中,微生物固碳对维持自身功能多样性以及生态系统碳循环过程具有重要意义[4].与植物源碳相比,微生物固定的碳可被微生物直接同化,并在微生物死亡后以微生物残体碳(MNC)等更稳定的形式存储于土壤,有利于土壤碳固存和累积[5].因此,系统解析土壤固碳微生物的类群组成、代谢特性及其固碳机制,不仅有助于完善陆地碳循环理论体系,也可以为开发基于微生物调控的碳汇增强技术提供科学依据. ...
Divergent accumulation of microbial necromass and plant lignin components in grassland soils
1
2018
... 土壤是陆地生态系统中最大、最活跃的碳库,其碳储量分别为植被和大气碳库储量的约3倍和2倍[1],在缓解大气温室气体浓度升高方面具有显著潜力[2].植物可通过光合作用将CO2转化为有机质,并以凋落物、根系分泌物等形式输入土壤,是土壤有机碳(SOC)的重要来源[3].与此同时,除了植物外,土壤微生物也具有固定CO2的能力,虽固碳量低于植物,但微生物种类多、分布范围广,尤其在碳限制型生态系统中,微生物固碳对维持自身功能多样性以及生态系统碳循环过程具有重要意义[4].与植物源碳相比,微生物固定的碳可被微生物直接同化,并在微生物死亡后以微生物残体碳(MNC)等更稳定的形式存储于土壤,有利于土壤碳固存和累积[5].因此,系统解析土壤固碳微生物的类群组成、代谢特性及其固碳机制,不仅有助于完善陆地碳循环理论体系,也可以为开发基于微生物调控的碳汇增强技术提供科学依据. ...
Using prokaryotes for carbon capture storage
1
2017
... 土壤是陆地生态系统中最大、最活跃的碳库,其碳储量分别为植被和大气碳库储量的约3倍和2倍[1],在缓解大气温室气体浓度升高方面具有显著潜力[2].植物可通过光合作用将CO2转化为有机质,并以凋落物、根系分泌物等形式输入土壤,是土壤有机碳(SOC)的重要来源[3].与此同时,除了植物外,土壤微生物也具有固定CO2的能力,虽固碳量低于植物,但微生物种类多、分布范围广,尤其在碳限制型生态系统中,微生物固碳对维持自身功能多样性以及生态系统碳循环过程具有重要意义[4].与植物源碳相比,微生物固定的碳可被微生物直接同化,并在微生物死亡后以微生物残体碳(MNC)等更稳定的形式存储于土壤,有利于土壤碳固存和累积[5].因此,系统解析土壤固碳微生物的类群组成、代谢特性及其固碳机制,不仅有助于完善陆地碳循环理论体系,也可以为开发基于微生物调控的碳汇增强技术提供科学依据. ...
Direct observation of permafrost degradation and rapid soil carbon loss in tundra
2
2019
... 土壤是陆地生态系统中最大、最活跃的碳库,其碳储量分别为植被和大气碳库储量的约3倍和2倍[1],在缓解大气温室气体浓度升高方面具有显著潜力[2].植物可通过光合作用将CO2转化为有机质,并以凋落物、根系分泌物等形式输入土壤,是土壤有机碳(SOC)的重要来源[3].与此同时,除了植物外,土壤微生物也具有固定CO2的能力,虽固碳量低于植物,但微生物种类多、分布范围广,尤其在碳限制型生态系统中,微生物固碳对维持自身功能多样性以及生态系统碳循环过程具有重要意义[4].与植物源碳相比,微生物固定的碳可被微生物直接同化,并在微生物死亡后以微生物残体碳(MNC)等更稳定的形式存储于土壤,有利于土壤碳固存和累积[5].因此,系统解析土壤固碳微生物的类群组成、代谢特性及其固碳机制,不仅有助于完善陆地碳循环理论体系,也可以为开发基于微生物调控的碳汇增强技术提供科学依据. ...
... 荒漠生态系统因其干旱胁迫与养分匮乏的生境条件,限制了植物源有机碳输入,导致荒漠区SOC储量较低[6].作为荒漠生态系统的重要组分,生物土壤结皮(简称生物结皮,BSCs)能够有效增加表层SOC含量[7].BSCs是由藻类、苔藓、固碳微生物等自养生物和细菌、真菌等异养生物,通过菌丝体、假根和多聚糖等分泌物与土壤表层颗粒胶结形成的复合体,依据物种组成可分为藻结皮、地衣结皮和苔藓结皮[8].BSCs常在灌草群落下方及植被间空地广泛发育,其盖度在荒漠区为40%~70%,约占陆地面积的12%[9-10].研究发现,除藻类和苔藓外,BSCs中还存在丰富的光能自养型和化能自养型固碳微生物类群,并具有可观的固碳潜能.然而,不同BSCs类型的优势固碳微生物具有显著差异,藻结皮中的优势类群是蓝藻门(Cyanobacteria)、绿藻门(Chlorophyta)、亚硝化单胞菌目(Nitrosomonas)和红螺菌目(Rhodospirillales),地衣结皮中的优势类群是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门和酸杆菌门(Acidobacteria),苔藓结皮中的优势类群是变形菌门和硅藻门(Bacillariophyta)[11-13].以上自养型微生物通过卡尔文循环(CBB)、还原性三羧酸循环(rTCA)等固碳途径实现碳同化,其固碳产物可通过微生物残体稳定化途径形成持久性土壤碳库[5],从而突破传统荒漠生态系统碳汇形成的植物依赖性限制. ...
中国西部干旱区土壤有机碳储量估算
1
2018
... 荒漠生态系统因其干旱胁迫与养分匮乏的生境条件,限制了植物源有机碳输入,导致荒漠区SOC储量较低[6].作为荒漠生态系统的重要组分,生物土壤结皮(简称生物结皮,BSCs)能够有效增加表层SOC含量[7].BSCs是由藻类、苔藓、固碳微生物等自养生物和细菌、真菌等异养生物,通过菌丝体、假根和多聚糖等分泌物与土壤表层颗粒胶结形成的复合体,依据物种组成可分为藻结皮、地衣结皮和苔藓结皮[8].BSCs常在灌草群落下方及植被间空地广泛发育,其盖度在荒漠区为40%~70%,约占陆地面积的12%[9-10].研究发现,除藻类和苔藓外,BSCs中还存在丰富的光能自养型和化能自养型固碳微生物类群,并具有可观的固碳潜能.然而,不同BSCs类型的优势固碳微生物具有显著差异,藻结皮中的优势类群是蓝藻门(Cyanobacteria)、绿藻门(Chlorophyta)、亚硝化单胞菌目(Nitrosomonas)和红螺菌目(Rhodospirillales),地衣结皮中的优势类群是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门和酸杆菌门(Acidobacteria),苔藓结皮中的优势类群是变形菌门和硅藻门(Bacillariophyta)[11-13].以上自养型微生物通过卡尔文循环(CBB)、还原性三羧酸循环(rTCA)等固碳途径实现碳同化,其固碳产物可通过微生物残体稳定化途径形成持久性土壤碳库[5],从而突破传统荒漠生态系统碳汇形成的植物依赖性限制. ...
Soil nitrogen and climate drive the positive effect of biological soil crusts on soil organic carbon sequestration in drylands:a meta-analysis
1
2022
... 荒漠生态系统因其干旱胁迫与养分匮乏的生境条件,限制了植物源有机碳输入,导致荒漠区SOC储量较低[6].作为荒漠生态系统的重要组分,生物土壤结皮(简称生物结皮,BSCs)能够有效增加表层SOC含量[7].BSCs是由藻类、苔藓、固碳微生物等自养生物和细菌、真菌等异养生物,通过菌丝体、假根和多聚糖等分泌物与土壤表层颗粒胶结形成的复合体,依据物种组成可分为藻结皮、地衣结皮和苔藓结皮[8].BSCs常在灌草群落下方及植被间空地广泛发育,其盖度在荒漠区为40%~70%,约占陆地面积的12%[9-10].研究发现,除藻类和苔藓外,BSCs中还存在丰富的光能自养型和化能自养型固碳微生物类群,并具有可观的固碳潜能.然而,不同BSCs类型的优势固碳微生物具有显著差异,藻结皮中的优势类群是蓝藻门(Cyanobacteria)、绿藻门(Chlorophyta)、亚硝化单胞菌目(Nitrosomonas)和红螺菌目(Rhodospirillales),地衣结皮中的优势类群是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门和酸杆菌门(Acidobacteria),苔藓结皮中的优势类群是变形菌门和硅藻门(Bacillariophyta)[11-13].以上自养型微生物通过卡尔文循环(CBB)、还原性三羧酸循环(rTCA)等固碳途径实现碳同化,其固碳产物可通过微生物残体稳定化途径形成持久性土壤碳库[5],从而突破传统荒漠生态系统碳汇形成的植物依赖性限制. ...
中国荒漠与沙地生物土壤结皮研究
1
2018
... 荒漠生态系统因其干旱胁迫与养分匮乏的生境条件,限制了植物源有机碳输入,导致荒漠区SOC储量较低[6].作为荒漠生态系统的重要组分,生物土壤结皮(简称生物结皮,BSCs)能够有效增加表层SOC含量[7].BSCs是由藻类、苔藓、固碳微生物等自养生物和细菌、真菌等异养生物,通过菌丝体、假根和多聚糖等分泌物与土壤表层颗粒胶结形成的复合体,依据物种组成可分为藻结皮、地衣结皮和苔藓结皮[8].BSCs常在灌草群落下方及植被间空地广泛发育,其盖度在荒漠区为40%~70%,约占陆地面积的12%[9-10].研究发现,除藻类和苔藓外,BSCs中还存在丰富的光能自养型和化能自养型固碳微生物类群,并具有可观的固碳潜能.然而,不同BSCs类型的优势固碳微生物具有显著差异,藻结皮中的优势类群是蓝藻门(Cyanobacteria)、绿藻门(Chlorophyta)、亚硝化单胞菌目(Nitrosomonas)和红螺菌目(Rhodospirillales),地衣结皮中的优势类群是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门和酸杆菌门(Acidobacteria),苔藓结皮中的优势类群是变形菌门和硅藻门(Bacillariophyta)[11-13].以上自养型微生物通过卡尔文循环(CBB)、还原性三羧酸循环(rTCA)等固碳途径实现碳同化,其固碳产物可通过微生物残体稳定化途径形成持久性土壤碳库[5],从而突破传统荒漠生态系统碳汇形成的植物依赖性限制. ...
The spatial distribution patterns of biological soil crusts in the Gurbantunggut Desert, Northern Xinjiang,China
1
2007
... 荒漠生态系统因其干旱胁迫与养分匮乏的生境条件,限制了植物源有机碳输入,导致荒漠区SOC储量较低[6].作为荒漠生态系统的重要组分,生物土壤结皮(简称生物结皮,BSCs)能够有效增加表层SOC含量[7].BSCs是由藻类、苔藓、固碳微生物等自养生物和细菌、真菌等异养生物,通过菌丝体、假根和多聚糖等分泌物与土壤表层颗粒胶结形成的复合体,依据物种组成可分为藻结皮、地衣结皮和苔藓结皮[8].BSCs常在灌草群落下方及植被间空地广泛发育,其盖度在荒漠区为40%~70%,约占陆地面积的12%[9-10].研究发现,除藻类和苔藓外,BSCs中还存在丰富的光能自养型和化能自养型固碳微生物类群,并具有可观的固碳潜能.然而,不同BSCs类型的优势固碳微生物具有显著差异,藻结皮中的优势类群是蓝藻门(Cyanobacteria)、绿藻门(Chlorophyta)、亚硝化单胞菌目(Nitrosomonas)和红螺菌目(Rhodospirillales),地衣结皮中的优势类群是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门和酸杆菌门(Acidobacteria),苔藓结皮中的优势类群是变形菌门和硅藻门(Bacillariophyta)[11-13].以上自养型微生物通过卡尔文循环(CBB)、还原性三羧酸循环(rTCA)等固碳途径实现碳同化,其固碳产物可通过微生物残体稳定化途径形成持久性土壤碳库[5],从而突破传统荒漠生态系统碳汇形成的植物依赖性限制. ...
Disturbance of biological soil crusts: impacts on potential wind erodibility of sandy desert soils in Southeastern Utah
1
1997
... 荒漠生态系统因其干旱胁迫与养分匮乏的生境条件,限制了植物源有机碳输入,导致荒漠区SOC储量较低[6].作为荒漠生态系统的重要组分,生物土壤结皮(简称生物结皮,BSCs)能够有效增加表层SOC含量[7].BSCs是由藻类、苔藓、固碳微生物等自养生物和细菌、真菌等异养生物,通过菌丝体、假根和多聚糖等分泌物与土壤表层颗粒胶结形成的复合体,依据物种组成可分为藻结皮、地衣结皮和苔藓结皮[8].BSCs常在灌草群落下方及植被间空地广泛发育,其盖度在荒漠区为40%~70%,约占陆地面积的12%[9-10].研究发现,除藻类和苔藓外,BSCs中还存在丰富的光能自养型和化能自养型固碳微生物类群,并具有可观的固碳潜能.然而,不同BSCs类型的优势固碳微生物具有显著差异,藻结皮中的优势类群是蓝藻门(Cyanobacteria)、绿藻门(Chlorophyta)、亚硝化单胞菌目(Nitrosomonas)和红螺菌目(Rhodospirillales),地衣结皮中的优势类群是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门和酸杆菌门(Acidobacteria),苔藓结皮中的优势类群是变形菌门和硅藻门(Bacillariophyta)[11-13].以上自养型微生物通过卡尔文循环(CBB)、还原性三羧酸循环(rTCA)等固碳途径实现碳同化,其固碳产物可通过微生物残体稳定化途径形成持久性土壤碳库[5],从而突破传统荒漠生态系统碳汇形成的植物依赖性限制. ...
古尔班通古特沙漠不同区域藻类结皮微生物结构和潜在功能
1
2024
... 荒漠生态系统因其干旱胁迫与养分匮乏的生境条件,限制了植物源有机碳输入,导致荒漠区SOC储量较低[6].作为荒漠生态系统的重要组分,生物土壤结皮(简称生物结皮,BSCs)能够有效增加表层SOC含量[7].BSCs是由藻类、苔藓、固碳微生物等自养生物和细菌、真菌等异养生物,通过菌丝体、假根和多聚糖等分泌物与土壤表层颗粒胶结形成的复合体,依据物种组成可分为藻结皮、地衣结皮和苔藓结皮[8].BSCs常在灌草群落下方及植被间空地广泛发育,其盖度在荒漠区为40%~70%,约占陆地面积的12%[9-10].研究发现,除藻类和苔藓外,BSCs中还存在丰富的光能自养型和化能自养型固碳微生物类群,并具有可观的固碳潜能.然而,不同BSCs类型的优势固碳微生物具有显著差异,藻结皮中的优势类群是蓝藻门(Cyanobacteria)、绿藻门(Chlorophyta)、亚硝化单胞菌目(Nitrosomonas)和红螺菌目(Rhodospirillales),地衣结皮中的优势类群是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门和酸杆菌门(Acidobacteria),苔藓结皮中的优势类群是变形菌门和硅藻门(Bacillariophyta)[11-13].以上自养型微生物通过卡尔文循环(CBB)、还原性三羧酸循环(rTCA)等固碳途径实现碳同化,其固碳产物可通过微生物残体稳定化途径形成持久性土壤碳库[5],从而突破传统荒漠生态系统碳汇形成的植物依赖性限制. ...
Changes in functional gene structure and metabolic potential of the microbial community in biological soil crusts along a revegetation chronosequence in the Tengger Desert
0
2018
毛乌素沙地固碳功能菌群落随生物结皮发育阶段的演变特征
2
2024
... 荒漠生态系统因其干旱胁迫与养分匮乏的生境条件,限制了植物源有机碳输入,导致荒漠区SOC储量较低[6].作为荒漠生态系统的重要组分,生物土壤结皮(简称生物结皮,BSCs)能够有效增加表层SOC含量[7].BSCs是由藻类、苔藓、固碳微生物等自养生物和细菌、真菌等异养生物,通过菌丝体、假根和多聚糖等分泌物与土壤表层颗粒胶结形成的复合体,依据物种组成可分为藻结皮、地衣结皮和苔藓结皮[8].BSCs常在灌草群落下方及植被间空地广泛发育,其盖度在荒漠区为40%~70%,约占陆地面积的12%[9-10].研究发现,除藻类和苔藓外,BSCs中还存在丰富的光能自养型和化能自养型固碳微生物类群,并具有可观的固碳潜能.然而,不同BSCs类型的优势固碳微生物具有显著差异,藻结皮中的优势类群是蓝藻门(Cyanobacteria)、绿藻门(Chlorophyta)、亚硝化单胞菌目(Nitrosomonas)和红螺菌目(Rhodospirillales),地衣结皮中的优势类群是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝藻门和酸杆菌门(Acidobacteria),苔藓结皮中的优势类群是变形菌门和硅藻门(Bacillariophyta)[11-13].以上自养型微生物通过卡尔文循环(CBB)、还原性三羧酸循环(rTCA)等固碳途径实现碳同化,其固碳产物可通过微生物残体稳定化途径形成持久性土壤碳库[5],从而突破传统荒漠生态系统碳汇形成的植物依赖性限制. ...
... 研究结果表明,毛乌素沙地BSCs中含有较多可培养的化能自养型菌株(表1).筛选出的18株固碳菌中,优势菌群为放线菌门的链霉菌属(占比55.56%),其次为放线菌门的糖丝菌属(占比16.67%),其他还包括少量红球菌属、节杆菌属、游动放线菌属以及变形菌门的甲基杆菌属和不动杆菌属.该研究结果与毛乌素沙地和古尔班通古特沙漠BSCs中利用高通量测序解析的潜在固碳微生物类群结果相似[13,37-38].高通量测序技术可快速明晰土壤中潜在的固碳菌类群,但该结果并不能够直接反映菌株功能基因是否表达及其可培养性.本研究利用无碳源无机培养基分离筛选固碳菌株,并进一步解析其固碳途径和能力,为固碳菌株的实践应用提供了理论支持,并且首次分离出具有固碳能力的糖丝菌属和游动放线菌属细菌.糖丝菌属和游动放线菌属同属于放线菌门,多存在于半干旱荒漠区,在45 ℃高温、5% NaCl浓度及UV-B辐射胁迫下仍保持>70%的存活率,具有抗旱、耐高温、耐辐射的特点,且均能产生萜类、酯类和糖苷类细胞代谢物[39-40].此类次生代谢产物对灰霉病菌(Botrytis cinerea)和镰刀菌(Fusarium oxysporum)的抑制率分别约为62.3%和58.7%,在防治虫害和植物病原真菌方面具有一定的应用价值[41]. ...
Microbial fixation of CO2 in water bodies and in drylands to combat climate change, soil loss and desertification
1
2015
... 近年来,荒漠区固碳微生物的研究与应用主要在光合固碳领域,尤以藻结皮中蓝藻类群为典型代表.相关研究表明,蓝藻类群在水分及营养条件适宜时,生物量积累速率是高等植物的50倍,可以更高效地固定CO2[14].基于此开展的试验显示,在伊朗马赞达拉省半干旱区进行蓝藻接种后,试验区可增加3.11~3.93 t·a-1·hm-2 CO2,约是对照组的2.8倍[15].在古尔班通古特和腾格里沙漠,蓝藻的接种还会对藻类生物量、结皮厚度、土壤酶活性和生物多样性恢复有促进作用[16-17].尽管如此,受限于光照、水分和营养特殊性,蓝藻也具有一定的局限性.其一,在BSCs形成初期阶段,流沙易于覆盖藻结皮表面导致光能捕获率降低40%~65%,从而阻碍蓝藻进行光合作用以固定碳元素[18].其二,水分对于BSCs的形成和发育起着至关重要的作用,当表层土壤含水量低于3.5%时,可完全抑制其光能自养活性,蓝藻生物量呈指数级衰减,甚至死亡[19].其三,蓝藻定殖过程对土壤基质条件有着较高依赖性,初期土壤中的有机质、全氮及全磷含量低,不利于蓝藻的定殖和存活[20].相比之下,化能自养微生物的寡营养适应机制(C∶N∶P需求比为100∶3∶0.3)与耐脱水特性(存活含水量阈值>1.5%)使其更有利于在荒漠生境中存活[21].研究显示,在BSCs形成之前,化能自养微生物可作为先锋物种通过分泌胞外聚合物(EPS)促进土壤团聚体形成,使表层微环境持水能力提升15%~20%,同时输入2.8~4.6 g·m-2·a-1初始有机碳(C),为后续蓝藻定殖创造必要的微环境[22].然而,目前对荒漠区化能自养微生物分离筛选及应用的研究十分有限,严重制约微生物资源在干旱区碳增汇技术中的应用转化. ...
Increasing soil potential for carbon sequestration using microbes from biological soil crusts
1
2020
... 近年来,荒漠区固碳微生物的研究与应用主要在光合固碳领域,尤以藻结皮中蓝藻类群为典型代表.相关研究表明,蓝藻类群在水分及营养条件适宜时,生物量积累速率是高等植物的50倍,可以更高效地固定CO2[14].基于此开展的试验显示,在伊朗马赞达拉省半干旱区进行蓝藻接种后,试验区可增加3.11~3.93 t·a-1·hm-2 CO2,约是对照组的2.8倍[15].在古尔班通古特和腾格里沙漠,蓝藻的接种还会对藻类生物量、结皮厚度、土壤酶活性和生物多样性恢复有促进作用[16-17].尽管如此,受限于光照、水分和营养特殊性,蓝藻也具有一定的局限性.其一,在BSCs形成初期阶段,流沙易于覆盖藻结皮表面导致光能捕获率降低40%~65%,从而阻碍蓝藻进行光合作用以固定碳元素[18].其二,水分对于BSCs的形成和发育起着至关重要的作用,当表层土壤含水量低于3.5%时,可完全抑制其光能自养活性,蓝藻生物量呈指数级衰减,甚至死亡[19].其三,蓝藻定殖过程对土壤基质条件有着较高依赖性,初期土壤中的有机质、全氮及全磷含量低,不利于蓝藻的定殖和存活[20].相比之下,化能自养微生物的寡营养适应机制(C∶N∶P需求比为100∶3∶0.3)与耐脱水特性(存活含水量阈值>1.5%)使其更有利于在荒漠生境中存活[21].研究显示,在BSCs形成之前,化能自养微生物可作为先锋物种通过分泌胞外聚合物(EPS)促进土壤团聚体形成,使表层微环境持水能力提升15%~20%,同时输入2.8~4.6 g·m-2·a-1初始有机碳(C),为后续蓝藻定殖创造必要的微环境[22].然而,目前对荒漠区化能自养微生物分离筛选及应用的研究十分有限,严重制约微生物资源在干旱区碳增汇技术中的应用转化. ...
具鞘微鞘藻在荒漠藻结皮形成过程中的作用
1
2010
... 近年来,荒漠区固碳微生物的研究与应用主要在光合固碳领域,尤以藻结皮中蓝藻类群为典型代表.相关研究表明,蓝藻类群在水分及营养条件适宜时,生物量积累速率是高等植物的50倍,可以更高效地固定CO2[14].基于此开展的试验显示,在伊朗马赞达拉省半干旱区进行蓝藻接种后,试验区可增加3.11~3.93 t·a-1·hm-2 CO2,约是对照组的2.8倍[15].在古尔班通古特和腾格里沙漠,蓝藻的接种还会对藻类生物量、结皮厚度、土壤酶活性和生物多样性恢复有促进作用[16-17].尽管如此,受限于光照、水分和营养特殊性,蓝藻也具有一定的局限性.其一,在BSCs形成初期阶段,流沙易于覆盖藻结皮表面导致光能捕获率降低40%~65%,从而阻碍蓝藻进行光合作用以固定碳元素[18].其二,水分对于BSCs的形成和发育起着至关重要的作用,当表层土壤含水量低于3.5%时,可完全抑制其光能自养活性,蓝藻生物量呈指数级衰减,甚至死亡[19].其三,蓝藻定殖过程对土壤基质条件有着较高依赖性,初期土壤中的有机质、全氮及全磷含量低,不利于蓝藻的定殖和存活[20].相比之下,化能自养微生物的寡营养适应机制(C∶N∶P需求比为100∶3∶0.3)与耐脱水特性(存活含水量阈值>1.5%)使其更有利于在荒漠生境中存活[21].研究显示,在BSCs形成之前,化能自养微生物可作为先锋物种通过分泌胞外聚合物(EPS)促进土壤团聚体形成,使表层微环境持水能力提升15%~20%,同时输入2.8~4.6 g·m-2·a-1初始有机碳(C),为后续蓝藻定殖创造必要的微环境[22].然而,目前对荒漠区化能自养微生物分离筛选及应用的研究十分有限,严重制约微生物资源在干旱区碳增汇技术中的应用转化. ...
人工蓝藻结皮对沙区表层土壤酶活性及其恢复速率的影响
1
2023
... 近年来,荒漠区固碳微生物的研究与应用主要在光合固碳领域,尤以藻结皮中蓝藻类群为典型代表.相关研究表明,蓝藻类群在水分及营养条件适宜时,生物量积累速率是高等植物的50倍,可以更高效地固定CO2[14].基于此开展的试验显示,在伊朗马赞达拉省半干旱区进行蓝藻接种后,试验区可增加3.11~3.93 t·a-1·hm-2 CO2,约是对照组的2.8倍[15].在古尔班通古特和腾格里沙漠,蓝藻的接种还会对藻类生物量、结皮厚度、土壤酶活性和生物多样性恢复有促进作用[16-17].尽管如此,受限于光照、水分和营养特殊性,蓝藻也具有一定的局限性.其一,在BSCs形成初期阶段,流沙易于覆盖藻结皮表面导致光能捕获率降低40%~65%,从而阻碍蓝藻进行光合作用以固定碳元素[18].其二,水分对于BSCs的形成和发育起着至关重要的作用,当表层土壤含水量低于3.5%时,可完全抑制其光能自养活性,蓝藻生物量呈指数级衰减,甚至死亡[19].其三,蓝藻定殖过程对土壤基质条件有着较高依赖性,初期土壤中的有机质、全氮及全磷含量低,不利于蓝藻的定殖和存活[20].相比之下,化能自养微生物的寡营养适应机制(C∶N∶P需求比为100∶3∶0.3)与耐脱水特性(存活含水量阈值>1.5%)使其更有利于在荒漠生境中存活[21].研究显示,在BSCs形成之前,化能自养微生物可作为先锋物种通过分泌胞外聚合物(EPS)促进土壤团聚体形成,使表层微环境持水能力提升15%~20%,同时输入2.8~4.6 g·m-2·a-1初始有机碳(C),为后续蓝藻定殖创造必要的微环境[22].然而,目前对荒漠区化能自养微生物分离筛选及应用的研究十分有限,严重制约微生物资源在干旱区碳增汇技术中的应用转化. ...
生物土壤结皮结构、功能及人工恢复技术
1
2021
... 近年来,荒漠区固碳微生物的研究与应用主要在光合固碳领域,尤以藻结皮中蓝藻类群为典型代表.相关研究表明,蓝藻类群在水分及营养条件适宜时,生物量积累速率是高等植物的50倍,可以更高效地固定CO2[14].基于此开展的试验显示,在伊朗马赞达拉省半干旱区进行蓝藻接种后,试验区可增加3.11~3.93 t·a-1·hm-2 CO2,约是对照组的2.8倍[15].在古尔班通古特和腾格里沙漠,蓝藻的接种还会对藻类生物量、结皮厚度、土壤酶活性和生物多样性恢复有促进作用[16-17].尽管如此,受限于光照、水分和营养特殊性,蓝藻也具有一定的局限性.其一,在BSCs形成初期阶段,流沙易于覆盖藻结皮表面导致光能捕获率降低40%~65%,从而阻碍蓝藻进行光合作用以固定碳元素[18].其二,水分对于BSCs的形成和发育起着至关重要的作用,当表层土壤含水量低于3.5%时,可完全抑制其光能自养活性,蓝藻生物量呈指数级衰减,甚至死亡[19].其三,蓝藻定殖过程对土壤基质条件有着较高依赖性,初期土壤中的有机质、全氮及全磷含量低,不利于蓝藻的定殖和存活[20].相比之下,化能自养微生物的寡营养适应机制(C∶N∶P需求比为100∶3∶0.3)与耐脱水特性(存活含水量阈值>1.5%)使其更有利于在荒漠生境中存活[21].研究显示,在BSCs形成之前,化能自养微生物可作为先锋物种通过分泌胞外聚合物(EPS)促进土壤团聚体形成,使表层微环境持水能力提升15%~20%,同时输入2.8~4.6 g·m-2·a-1初始有机碳(C),为后续蓝藻定殖创造必要的微环境[22].然而,目前对荒漠区化能自养微生物分离筛选及应用的研究十分有限,严重制约微生物资源在干旱区碳增汇技术中的应用转化. ...
水分对具鞘微鞘藻构建人工藻结皮的作用
1
2013
... 近年来,荒漠区固碳微生物的研究与应用主要在光合固碳领域,尤以藻结皮中蓝藻类群为典型代表.相关研究表明,蓝藻类群在水分及营养条件适宜时,生物量积累速率是高等植物的50倍,可以更高效地固定CO2[14].基于此开展的试验显示,在伊朗马赞达拉省半干旱区进行蓝藻接种后,试验区可增加3.11~3.93 t·a-1·hm-2 CO2,约是对照组的2.8倍[15].在古尔班通古特和腾格里沙漠,蓝藻的接种还会对藻类生物量、结皮厚度、土壤酶活性和生物多样性恢复有促进作用[16-17].尽管如此,受限于光照、水分和营养特殊性,蓝藻也具有一定的局限性.其一,在BSCs形成初期阶段,流沙易于覆盖藻结皮表面导致光能捕获率降低40%~65%,从而阻碍蓝藻进行光合作用以固定碳元素[18].其二,水分对于BSCs的形成和发育起着至关重要的作用,当表层土壤含水量低于3.5%时,可完全抑制其光能自养活性,蓝藻生物量呈指数级衰减,甚至死亡[19].其三,蓝藻定殖过程对土壤基质条件有着较高依赖性,初期土壤中的有机质、全氮及全磷含量低,不利于蓝藻的定殖和存活[20].相比之下,化能自养微生物的寡营养适应机制(C∶N∶P需求比为100∶3∶0.3)与耐脱水特性(存活含水量阈值>1.5%)使其更有利于在荒漠生境中存活[21].研究显示,在BSCs形成之前,化能自养微生物可作为先锋物种通过分泌胞外聚合物(EPS)促进土壤团聚体形成,使表层微环境持水能力提升15%~20%,同时输入2.8~4.6 g·m-2·a-1初始有机碳(C),为后续蓝藻定殖创造必要的微环境[22].然而,目前对荒漠区化能自养微生物分离筛选及应用的研究十分有限,严重制约微生物资源在干旱区碳增汇技术中的应用转化. ...
微生物在沙化土壤修复中的应用研究进展
1
2022
... 近年来,荒漠区固碳微生物的研究与应用主要在光合固碳领域,尤以藻结皮中蓝藻类群为典型代表.相关研究表明,蓝藻类群在水分及营养条件适宜时,生物量积累速率是高等植物的50倍,可以更高效地固定CO2[14].基于此开展的试验显示,在伊朗马赞达拉省半干旱区进行蓝藻接种后,试验区可增加3.11~3.93 t·a-1·hm-2 CO2,约是对照组的2.8倍[15].在古尔班通古特和腾格里沙漠,蓝藻的接种还会对藻类生物量、结皮厚度、土壤酶活性和生物多样性恢复有促进作用[16-17].尽管如此,受限于光照、水分和营养特殊性,蓝藻也具有一定的局限性.其一,在BSCs形成初期阶段,流沙易于覆盖藻结皮表面导致光能捕获率降低40%~65%,从而阻碍蓝藻进行光合作用以固定碳元素[18].其二,水分对于BSCs的形成和发育起着至关重要的作用,当表层土壤含水量低于3.5%时,可完全抑制其光能自养活性,蓝藻生物量呈指数级衰减,甚至死亡[19].其三,蓝藻定殖过程对土壤基质条件有着较高依赖性,初期土壤中的有机质、全氮及全磷含量低,不利于蓝藻的定殖和存活[20].相比之下,化能自养微生物的寡营养适应机制(C∶N∶P需求比为100∶3∶0.3)与耐脱水特性(存活含水量阈值>1.5%)使其更有利于在荒漠生境中存活[21].研究显示,在BSCs形成之前,化能自养微生物可作为先锋物种通过分泌胞外聚合物(EPS)促进土壤团聚体形成,使表层微环境持水能力提升15%~20%,同时输入2.8~4.6 g·m-2·a-1初始有机碳(C),为后续蓝藻定殖创造必要的微环境[22].然而,目前对荒漠区化能自养微生物分离筛选及应用的研究十分有限,严重制约微生物资源在干旱区碳增汇技术中的应用转化. ...
寡营养细菌及其生态作用和应用的研究进展
1
2012
... 近年来,荒漠区固碳微生物的研究与应用主要在光合固碳领域,尤以藻结皮中蓝藻类群为典型代表.相关研究表明,蓝藻类群在水分及营养条件适宜时,生物量积累速率是高等植物的50倍,可以更高效地固定CO2[14].基于此开展的试验显示,在伊朗马赞达拉省半干旱区进行蓝藻接种后,试验区可增加3.11~3.93 t·a-1·hm-2 CO2,约是对照组的2.8倍[15].在古尔班通古特和腾格里沙漠,蓝藻的接种还会对藻类生物量、结皮厚度、土壤酶活性和生物多样性恢复有促进作用[16-17].尽管如此,受限于光照、水分和营养特殊性,蓝藻也具有一定的局限性.其一,在BSCs形成初期阶段,流沙易于覆盖藻结皮表面导致光能捕获率降低40%~65%,从而阻碍蓝藻进行光合作用以固定碳元素[18].其二,水分对于BSCs的形成和发育起着至关重要的作用,当表层土壤含水量低于3.5%时,可完全抑制其光能自养活性,蓝藻生物量呈指数级衰减,甚至死亡[19].其三,蓝藻定殖过程对土壤基质条件有着较高依赖性,初期土壤中的有机质、全氮及全磷含量低,不利于蓝藻的定殖和存活[20].相比之下,化能自养微生物的寡营养适应机制(C∶N∶P需求比为100∶3∶0.3)与耐脱水特性(存活含水量阈值>1.5%)使其更有利于在荒漠生境中存活[21].研究显示,在BSCs形成之前,化能自养微生物可作为先锋物种通过分泌胞外聚合物(EPS)促进土壤团聚体形成,使表层微环境持水能力提升15%~20%,同时输入2.8~4.6 g·m-2·a-1初始有机碳(C),为后续蓝藻定殖创造必要的微环境[22].然而,目前对荒漠区化能自养微生物分离筛选及应用的研究十分有限,严重制约微生物资源在干旱区碳增汇技术中的应用转化. ...
The autotrophic community across developmental stages of biocrusts in the Gurbantunggut Desert
1
2021
... 近年来,荒漠区固碳微生物的研究与应用主要在光合固碳领域,尤以藻结皮中蓝藻类群为典型代表.相关研究表明,蓝藻类群在水分及营养条件适宜时,生物量积累速率是高等植物的50倍,可以更高效地固定CO2[14].基于此开展的试验显示,在伊朗马赞达拉省半干旱区进行蓝藻接种后,试验区可增加3.11~3.93 t·a-1·hm-2 CO2,约是对照组的2.8倍[15].在古尔班通古特和腾格里沙漠,蓝藻的接种还会对藻类生物量、结皮厚度、土壤酶活性和生物多样性恢复有促进作用[16-17].尽管如此,受限于光照、水分和营养特殊性,蓝藻也具有一定的局限性.其一,在BSCs形成初期阶段,流沙易于覆盖藻结皮表面导致光能捕获率降低40%~65%,从而阻碍蓝藻进行光合作用以固定碳元素[18].其二,水分对于BSCs的形成和发育起着至关重要的作用,当表层土壤含水量低于3.5%时,可完全抑制其光能自养活性,蓝藻生物量呈指数级衰减,甚至死亡[19].其三,蓝藻定殖过程对土壤基质条件有着较高依赖性,初期土壤中的有机质、全氮及全磷含量低,不利于蓝藻的定殖和存活[20].相比之下,化能自养微生物的寡营养适应机制(C∶N∶P需求比为100∶3∶0.3)与耐脱水特性(存活含水量阈值>1.5%)使其更有利于在荒漠生境中存活[21].研究显示,在BSCs形成之前,化能自养微生物可作为先锋物种通过分泌胞外聚合物(EPS)促进土壤团聚体形成,使表层微环境持水能力提升15%~20%,同时输入2.8~4.6 g·m-2·a-1初始有机碳(C),为后续蓝藻定殖创造必要的微环境[22].然而,目前对荒漠区化能自养微生物分离筛选及应用的研究十分有限,严重制约微生物资源在干旱区碳增汇技术中的应用转化. ...
毛乌素沙地1990-2014年景观格局变化及驱动力
1
2017
... 毛乌素沙地地处半干旱荒漠区,生态环境脆弱、资源匮乏,得益于近几十年来防沙治沙工程的开展,该区域BSCs总体平均盖度已达30%,BSCs层及其下伏土层0~5 cm的总碳储量显著高于裸沙地,拥有丰富的固碳微生物资源[23-24].基于此,本文以毛乌素沙地BSCs为研究对象,采用无碳源无机培养基筛选固碳菌株,对菌株固碳酶活性和有机碳含量进行测定,利用功能基因进行验证,明确菌株固碳途径和能力,筛选出固碳能力强具有应用价值的化能自养型菌株,以期通过人工调控开发基于菌群互作的快速形成BSCs的新技术,为实现荒漠生态系统碳汇功能提升和退化土壤生物修复提供理论支撑与微生物资源. ...
毛乌素沙地生物结皮及其下伏土壤的养分特征与碳储量研究
1
2018
... 毛乌素沙地地处半干旱荒漠区,生态环境脆弱、资源匮乏,得益于近几十年来防沙治沙工程的开展,该区域BSCs总体平均盖度已达30%,BSCs层及其下伏土层0~5 cm的总碳储量显著高于裸沙地,拥有丰富的固碳微生物资源[23-24].基于此,本文以毛乌素沙地BSCs为研究对象,采用无碳源无机培养基筛选固碳菌株,对菌株固碳酶活性和有机碳含量进行测定,利用功能基因进行验证,明确菌株固碳途径和能力,筛选出固碳能力强具有应用价值的化能自养型菌株,以期通过人工调控开发基于菌群互作的快速形成BSCs的新技术,为实现荒漠生态系统碳汇功能提升和退化土壤生物修复提供理论支撑与微生物资源. ...
固沙灌木林地土壤微生物群落特征对土壤多功能性的影响
1
2023
... 本研究在宁夏盐池毛乌素沙地生态系统国家定位观测研究站(37°04′—38°10′N、106°30′—107°41′E,海拔1 530 m)进行,站区位于毛乌素沙地的西南边缘.研究区是干旱区与半干旱区的过渡地带,属于典型中温带大陆性季风气候,多年平均气温和降水量分别为8.1 ℃和292 mm[25].土壤类型以风沙土为主,其次是黑垆土与灰钙土,土壤结构松散,肥力较低,易受侵蚀[26-27].植被以沙生、旱生植物为主,主要包括黑沙蒿(Artemisia ordosica)、北沙柳(Salix psammophila)、赖草(Leymus secalinus)和阿尔泰狗娃花(Aster altaicus)等[28].BSCs是研究区常见的地被物,总体盖度大于30%,主要类型包括藻结皮、地衣结皮和苔藓结皮,对应的优势种分别为具鞘微鞘藻(Microcoleus vaginatus)、坚韧胶衣(Collema tenax)和银叶真藓(Bryum argenteum),其中藻结皮和地衣结皮多在灌丛间发育,而苔藓结皮多分布于灌丛下[29]. ...
毛乌素沙地黑沙蒿水分利用效率环境调控:从叶片到生态系统
1
2024
... 本研究在宁夏盐池毛乌素沙地生态系统国家定位观测研究站(37°04′—38°10′N、106°30′—107°41′E,海拔1 530 m)进行,站区位于毛乌素沙地的西南边缘.研究区是干旱区与半干旱区的过渡地带,属于典型中温带大陆性季风气候,多年平均气温和降水量分别为8.1 ℃和292 mm[25].土壤类型以风沙土为主,其次是黑垆土与灰钙土,土壤结构松散,肥力较低,易受侵蚀[26-27].植被以沙生、旱生植物为主,主要包括黑沙蒿(Artemisia ordosica)、北沙柳(Salix psammophila)、赖草(Leymus secalinus)和阿尔泰狗娃花(Aster altaicus)等[28].BSCs是研究区常见的地被物,总体盖度大于30%,主要类型包括藻结皮、地衣结皮和苔藓结皮,对应的优势种分别为具鞘微鞘藻(Microcoleus vaginatus)、坚韧胶衣(Collema tenax)和银叶真藓(Bryum argenteum),其中藻结皮和地衣结皮多在灌丛间发育,而苔藓结皮多分布于灌丛下[29]. ...
中分辨率遥感像元尺度生物土壤结皮覆盖与植被及土壤间的交互关系
1
2022
... 本研究在宁夏盐池毛乌素沙地生态系统国家定位观测研究站(37°04′—38°10′N、106°30′—107°41′E,海拔1 530 m)进行,站区位于毛乌素沙地的西南边缘.研究区是干旱区与半干旱区的过渡地带,属于典型中温带大陆性季风气候,多年平均气温和降水量分别为8.1 ℃和292 mm[25].土壤类型以风沙土为主,其次是黑垆土与灰钙土,土壤结构松散,肥力较低,易受侵蚀[26-27].植被以沙生、旱生植物为主,主要包括黑沙蒿(Artemisia ordosica)、北沙柳(Salix psammophila)、赖草(Leymus secalinus)和阿尔泰狗娃花(Aster altaicus)等[28].BSCs是研究区常见的地被物,总体盖度大于30%,主要类型包括藻结皮、地衣结皮和苔藓结皮,对应的优势种分别为具鞘微鞘藻(Microcoleus vaginatus)、坚韧胶衣(Collema tenax)和银叶真藓(Bryum argenteum),其中藻结皮和地衣结皮多在灌丛间发育,而苔藓结皮多分布于灌丛下[29]. ...
Soil microbial interactions modulate the effect of Artemisia ordosica on herbaceous species in a desert ecosystem, Northern China
1
2020
... 本研究在宁夏盐池毛乌素沙地生态系统国家定位观测研究站(37°04′—38°10′N、106°30′—107°41′E,海拔1 530 m)进行,站区位于毛乌素沙地的西南边缘.研究区是干旱区与半干旱区的过渡地带,属于典型中温带大陆性季风气候,多年平均气温和降水量分别为8.1 ℃和292 mm[25].土壤类型以风沙土为主,其次是黑垆土与灰钙土,土壤结构松散,肥力较低,易受侵蚀[26-27].植被以沙生、旱生植物为主,主要包括黑沙蒿(Artemisia ordosica)、北沙柳(Salix psammophila)、赖草(Leymus secalinus)和阿尔泰狗娃花(Aster altaicus)等[28].BSCs是研究区常见的地被物,总体盖度大于30%,主要类型包括藻结皮、地衣结皮和苔藓结皮,对应的优势种分别为具鞘微鞘藻(Microcoleus vaginatus)、坚韧胶衣(Collema tenax)和银叶真藓(Bryum argenteum),其中藻结皮和地衣结皮多在灌丛间发育,而苔藓结皮多分布于灌丛下[29]. ...
生物土壤结皮对毛乌素沙地油蒿群落土壤水分的影响
1
2017
... 本研究在宁夏盐池毛乌素沙地生态系统国家定位观测研究站(37°04′—38°10′N、106°30′—107°41′E,海拔1 530 m)进行,站区位于毛乌素沙地的西南边缘.研究区是干旱区与半干旱区的过渡地带,属于典型中温带大陆性季风气候,多年平均气温和降水量分别为8.1 ℃和292 mm[25].土壤类型以风沙土为主,其次是黑垆土与灰钙土,土壤结构松散,肥力较低,易受侵蚀[26-27].植被以沙生、旱生植物为主,主要包括黑沙蒿(Artemisia ordosica)、北沙柳(Salix psammophila)、赖草(Leymus secalinus)和阿尔泰狗娃花(Aster altaicus)等[28].BSCs是研究区常见的地被物,总体盖度大于30%,主要类型包括藻结皮、地衣结皮和苔藓结皮,对应的优势种分别为具鞘微鞘藻(Microcoleus vaginatus)、坚韧胶衣(Collema tenax)和银叶真藓(Bryum argenteum),其中藻结皮和地衣结皮多在灌丛间发育,而苔藓结皮多分布于灌丛下[29]. ...
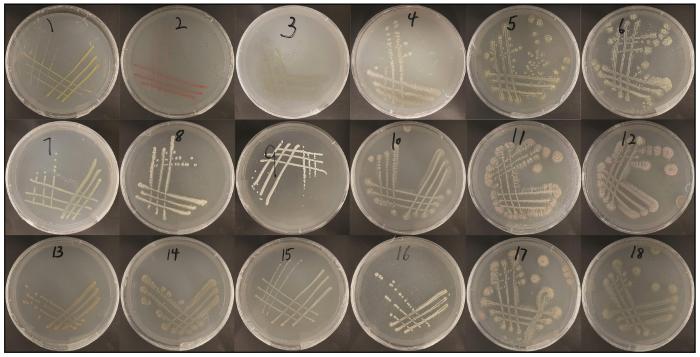
固碳微生物菌株的分离鉴定及其固碳能力测定
1
2019
... 无碳源无机培养基(g·L-1):MnSO4 1 g,Na2HPO4 0.5 g,KH2PO4 0.5 g,MgSO4 1 g,CaCl2 0.2 g,NaHCO3 1 g,NH4Cl 0.5 g,KNO3 1 g,NaCl 0.4 g,微量元素溶液2 mL.微量元素溶液的配制为:FeCl3 0.3 g,FeSO4·7H2O 0.3 g,MnSO4·H2O 0.15 g,ZnSO4 0.14 g,CoCl2 0.2 g,微量元素过0.22 μm滤膜除菌[30].pH值7.5,琼脂20 g(液体培养基不加),121 ℃灭菌20 min,用于固碳菌株的筛选、菌液固碳酶活性和相关碳含量测定. ...
解淀粉芽胞杆菌MH71摇瓶发酵培养基及发酵条件优化
1
2015
... Luria-Bertani(LB)培养基(g·L-1):酵母提取物5 g,NaCl 10 g,胰蛋白胨10 g,pH值7.2~7.4,琼脂20 g(液体培养基不加),121 ℃灭菌15 min,用于菌株保藏和生长情况测定[31]. ...
3
2010
... 营养培养基(g·L-1):蛋白胨10 g,NaCl 5 g,牛肉膏粉3 g,pH值7.1~7.5,琼脂20 g(液体培养基不加),121 ℃灭菌15 min,用于菌株淀粉和尿素水解能力测定[32]. ...
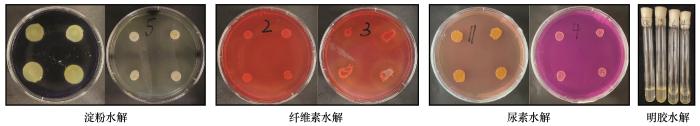
... 明胶培养基(g·L-1):蛋白胨5 g,明胶120 g,pH值7.2~7.4,琼脂20 g(液体培养基不加),115 ℃灭菌20 min,用于菌株明胶水解能力测定[32]. ...
... 具体培养基配置方法参照相关文献[32].取处于对数生长期的菌液10 μL,点植于相关功能性培养基中,明胶水解则用穿刺法接种,同时以未接菌为对照,每组4个重复.淀粉和纤维素培养基培养4 d后滴加相关试剂,根据水解圈R(D/d,D为透明圈直径,d为菌落直径)的大小判定水解能力,而尿素和明胶水解能力则是根据出现变红和液化现象时间长短判定. ...
黑曲霉Sta-122菌株产纤维素酶的研究
1
1991
... 羧甲基纤维素钠培养基(g·L-1):羧甲基纤维素钠10 g,Na2HPO4 2.5 g,KH2PO4 1.5 g,蛋白胨2.5 g,酵母膏0.5 g,pH值7.0~7.4,琼脂20 g(液体培养基不加),121 ℃灭菌25 min,用于菌株纤维素水解能力测定[33]. ...
秸秆降解菌株的筛选、鉴定及生物学特性研究
1
2018
... 按照离心柱型细菌基因组DNA提取试剂盒(天根生化科技有限公司)的提取步骤,提取不同菌株的基因组DNA.以提取细菌组总DNA为模板,进行PCR反应扩增,通用引物上下游序列分别为27 F:5’-AGAGTTTGATCCTGGCTCAG-3’和1492 R:5’-CGGTTACCTTGTTACGACTT-3’,PCR体系及反应循环按照试剂盒(生工)进行设置[34].PCR产物经1%琼脂糖核酸凝胶电泳检测后送至公司(睿博兴科)测序,测序结果在NCBI库中进行BlAST比对,并绘制系统发育树. ...
达乌里胡枝子四株耐盐碱根际促生菌的鉴定及其促生作用
1
2023
... 使用一次性接种环,每菌株取一环的量,将筛选后的菌株分别接种于20 mL LB液体培养基中进行摇床培养,同时设置空白对照,每组3个重复.摇床条件设置为30 ℃、150 r·min-1、黑暗,每隔2 h使用酶标仪对菌液浓度进行测定,直至菌株到达生长末期,并绘制生长曲线[35]. ...
一株高产DHA菌株的筛选及其发酵条件优化
1
2016
... 将在LB液体培养基中处于稳定期时的菌液离心去上清液,无菌水洗涤2次,洗去残余培养基后,用封口膜密封,置于烘箱中烘干,随后测定菌体干重[36]. ...
毛乌素沙地地衣结皮层微生物的群落结构及其固碳功能
2
2019
... 研究结果表明,毛乌素沙地BSCs中含有较多可培养的化能自养型菌株(表1).筛选出的18株固碳菌中,优势菌群为放线菌门的链霉菌属(占比55.56%),其次为放线菌门的糖丝菌属(占比16.67%),其他还包括少量红球菌属、节杆菌属、游动放线菌属以及变形菌门的甲基杆菌属和不动杆菌属.该研究结果与毛乌素沙地和古尔班通古特沙漠BSCs中利用高通量测序解析的潜在固碳微生物类群结果相似[13,37-38].高通量测序技术可快速明晰土壤中潜在的固碳菌类群,但该结果并不能够直接反映菌株功能基因是否表达及其可培养性.本研究利用无碳源无机培养基分离筛选固碳菌株,并进一步解析其固碳途径和能力,为固碳菌株的实践应用提供了理论支持,并且首次分离出具有固碳能力的糖丝菌属和游动放线菌属细菌.糖丝菌属和游动放线菌属同属于放线菌门,多存在于半干旱荒漠区,在45 ℃高温、5% NaCl浓度及UV-B辐射胁迫下仍保持>70%的存活率,具有抗旱、耐高温、耐辐射的特点,且均能产生萜类、酯类和糖苷类细胞代谢物[39-40].此类次生代谢产物对灰霉病菌(Botrytis cinerea)和镰刀菌(Fusarium oxysporum)的抑制率分别约为62.3%和58.7%,在防治虫害和植物病原真菌方面具有一定的应用价值[41]. ...
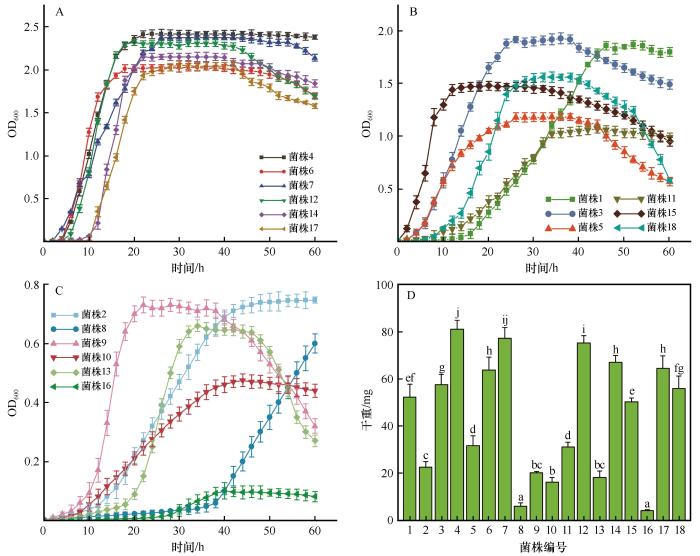
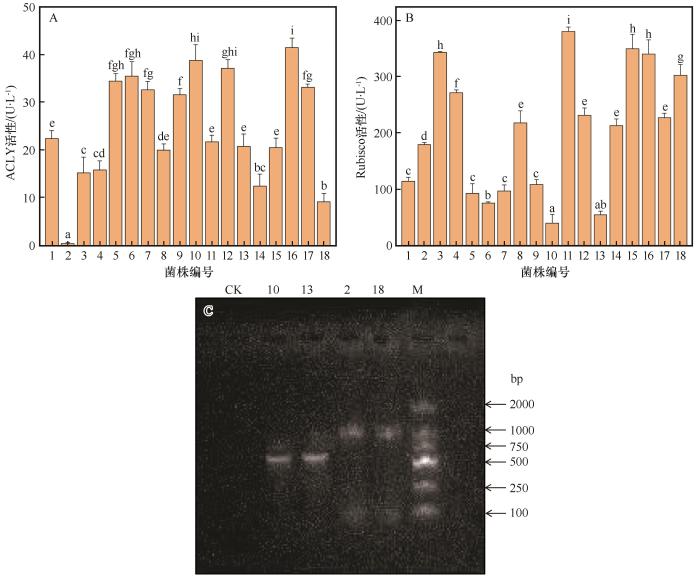
... 前期研究表明,毛乌素沙地裸沙地和BSCs中微生物固碳途径有6种:卡尔文循环途径(CBB)、还原性三羧酸循环途径(rTCA)、还原性乙酰辅酶A循环途径(WL)、3-羟基丙酸循环途径(3-HP)、3-羟基丙酸/4-羟基丁酸循环途径(3-HP/4-HB)和二羧酸/4-羟基丁酸循环途径(DC/4-HB).其中,rTCA途径的丰度最高,次之为CBB途径,其他固碳途径丰度较低[37,52].在干旱区,微生物固碳速率与编码CBB途径的关键酶基因丰度无显著相关性,而在稻田土壤中,两者具有显著的正相关,导致这种差异的原因可能是不同微生物类群的优势固碳途径存在差异[53].rTCA固碳途径耗能较少,在养分限制的荒漠区占优势,CBB固碳途径耗能较高,在稻田、污泥和湿地等土壤中占优势[52,54-55].因此,只利用单一酶活性解析荒漠区微生物的固碳能力并不全面.基于上述内容,本研究分别利用CBB途径限速酶(RubisCO酶)和rTCA途径限速酶(ACLY酶)解析固碳菌株的固碳能力.发现ACLY酶活性相对较高的菌株共9株,分别为菌株1、5、6、7、9、10、12、16和17,意味着这些菌株可能以rTCA循环途径固碳为主;RubisCO酶活性相对较高的菌株共8株,分别为菌株3、4、8、11、12、15、16和18,意味着这些菌株可能以CBB循环途径固碳为主.因此,在后期应用时,可先将ACLY酶活性相对较高的固碳菌株施入裸沙地,待SOC积累一段时间后,再施入RubisCO酶活性相对较高的固碳菌株.除此之外,还发现同一菌株同时拥有两种较高的固碳酶活性,如菌株16,说明同一菌株存在通过多种途径进行固碳的可能. ...
古尔班通古特沙漠生物结皮中土壤微生物垂直分布特征
1
2005
... 研究结果表明,毛乌素沙地BSCs中含有较多可培养的化能自养型菌株(表1).筛选出的18株固碳菌中,优势菌群为放线菌门的链霉菌属(占比55.56%),其次为放线菌门的糖丝菌属(占比16.67%),其他还包括少量红球菌属、节杆菌属、游动放线菌属以及变形菌门的甲基杆菌属和不动杆菌属.该研究结果与毛乌素沙地和古尔班通古特沙漠BSCs中利用高通量测序解析的潜在固碳微生物类群结果相似[13,37-38].高通量测序技术可快速明晰土壤中潜在的固碳菌类群,但该结果并不能够直接反映菌株功能基因是否表达及其可培养性.本研究利用无碳源无机培养基分离筛选固碳菌株,并进一步解析其固碳途径和能力,为固碳菌株的实践应用提供了理论支持,并且首次分离出具有固碳能力的糖丝菌属和游动放线菌属细菌.糖丝菌属和游动放线菌属同属于放线菌门,多存在于半干旱荒漠区,在45 ℃高温、5% NaCl浓度及UV-B辐射胁迫下仍保持>70%的存活率,具有抗旱、耐高温、耐辐射的特点,且均能产生萜类、酯类和糖苷类细胞代谢物[39-40].此类次生代谢产物对灰霉病菌(Botrytis cinerea)和镰刀菌(Fusarium oxysporum)的抑制率分别约为62.3%和58.7%,在防治虫害和植物病原真菌方面具有一定的应用价值[41]. ...
Changes in bacterial community composition and soil properties altered the response of soil respiration to rain addition in desert biological soil crusts
1
2022
... 研究结果表明,毛乌素沙地BSCs中含有较多可培养的化能自养型菌株(表1).筛选出的18株固碳菌中,优势菌群为放线菌门的链霉菌属(占比55.56%),其次为放线菌门的糖丝菌属(占比16.67%),其他还包括少量红球菌属、节杆菌属、游动放线菌属以及变形菌门的甲基杆菌属和不动杆菌属.该研究结果与毛乌素沙地和古尔班通古特沙漠BSCs中利用高通量测序解析的潜在固碳微生物类群结果相似[13,37-38].高通量测序技术可快速明晰土壤中潜在的固碳菌类群,但该结果并不能够直接反映菌株功能基因是否表达及其可培养性.本研究利用无碳源无机培养基分离筛选固碳菌株,并进一步解析其固碳途径和能力,为固碳菌株的实践应用提供了理论支持,并且首次分离出具有固碳能力的糖丝菌属和游动放线菌属细菌.糖丝菌属和游动放线菌属同属于放线菌门,多存在于半干旱荒漠区,在45 ℃高温、5% NaCl浓度及UV-B辐射胁迫下仍保持>70%的存活率,具有抗旱、耐高温、耐辐射的特点,且均能产生萜类、酯类和糖苷类细胞代谢物[39-40].此类次生代谢产物对灰霉病菌(Botrytis cinerea)和镰刀菌(Fusarium oxysporum)的抑制率分别约为62.3%和58.7%,在防治虫害和植物病原真菌方面具有一定的应用价值[41]. ...
腾格里沙漠东南缘藻结皮与藓结皮放线菌多样性及其潜在代谢功能
1
2020
... 研究结果表明,毛乌素沙地BSCs中含有较多可培养的化能自养型菌株(表1).筛选出的18株固碳菌中,优势菌群为放线菌门的链霉菌属(占比55.56%),其次为放线菌门的糖丝菌属(占比16.67%),其他还包括少量红球菌属、节杆菌属、游动放线菌属以及变形菌门的甲基杆菌属和不动杆菌属.该研究结果与毛乌素沙地和古尔班通古特沙漠BSCs中利用高通量测序解析的潜在固碳微生物类群结果相似[13,37-38].高通量测序技术可快速明晰土壤中潜在的固碳菌类群,但该结果并不能够直接反映菌株功能基因是否表达及其可培养性.本研究利用无碳源无机培养基分离筛选固碳菌株,并进一步解析其固碳途径和能力,为固碳菌株的实践应用提供了理论支持,并且首次分离出具有固碳能力的糖丝菌属和游动放线菌属细菌.糖丝菌属和游动放线菌属同属于放线菌门,多存在于半干旱荒漠区,在45 ℃高温、5% NaCl浓度及UV-B辐射胁迫下仍保持>70%的存活率,具有抗旱、耐高温、耐辐射的特点,且均能产生萜类、酯类和糖苷类细胞代谢物[39-40].此类次生代谢产物对灰霉病菌(Botrytis cinerea)和镰刀菌(Fusarium oxysporum)的抑制率分别约为62.3%和58.7%,在防治虫害和植物病原真菌方面具有一定的应用价值[41]. ...
糖丝菌属放线菌研究进展
1
2022
... 研究结果表明,毛乌素沙地BSCs中含有较多可培养的化能自养型菌株(表1).筛选出的18株固碳菌中,优势菌群为放线菌门的链霉菌属(占比55.56%),其次为放线菌门的糖丝菌属(占比16.67%),其他还包括少量红球菌属、节杆菌属、游动放线菌属以及变形菌门的甲基杆菌属和不动杆菌属.该研究结果与毛乌素沙地和古尔班通古特沙漠BSCs中利用高通量测序解析的潜在固碳微生物类群结果相似[13,37-38].高通量测序技术可快速明晰土壤中潜在的固碳菌类群,但该结果并不能够直接反映菌株功能基因是否表达及其可培养性.本研究利用无碳源无机培养基分离筛选固碳菌株,并进一步解析其固碳途径和能力,为固碳菌株的实践应用提供了理论支持,并且首次分离出具有固碳能力的糖丝菌属和游动放线菌属细菌.糖丝菌属和游动放线菌属同属于放线菌门,多存在于半干旱荒漠区,在45 ℃高温、5% NaCl浓度及UV-B辐射胁迫下仍保持>70%的存活率,具有抗旱、耐高温、耐辐射的特点,且均能产生萜类、酯类和糖苷类细胞代谢物[39-40].此类次生代谢产物对灰霉病菌(Botrytis cinerea)和镰刀菌(Fusarium oxysporum)的抑制率分别约为62.3%和58.7%,在防治虫害和植物病原真菌方面具有一定的应用价值[41]. ...
Solirubrobacter ginsenosidimutans sp nov., isolated from soil of a ginseng field
1
2011
... 根据分离结果可知,BSCs宏基因组测序结果中丰度较高的固碳菌红杆菌属(Solirubrobacter)未被分离,这可能与该菌属对微量有机碳(>0.1 mM葡萄糖当量)及Fe³+螯合因子(如铁载体浓度>50 μM)具有严格依赖性有关,而本研究的无碳源无机培养基提供的生存环境无法满足红杆菌属的基本生命需求[42].在后期研究中,可通过改进培养基配方,使得更多的固碳菌株被分离.放线菌门的链霉菌属能够成为BSCs中优势固碳菌的原因如下:一是链霉菌对极端环境具有较强的耐受性,其产生的孢子能够抵抗不利的外界环境条件,分枝状菌丝体有利于土壤养分和水分迁移,同时能够降解纤维素和几丁质,增加土壤养分,有利于藻类的定殖和BSCs的演替[43-44].二是链霉菌可产生抗生素和溶菌酶等多种细胞代谢物质,抑制其他微生物生长,增强自身竞争能力[45].链霉菌的以上特性使其能够快速适应荒漠区干旱、能量供应胁迫的环境,导致其在沙地中能够维持较高的生存率和活性. ...
Streptomyces exploration: competition, volatile communication and new bacterial behaviours
1
2017
... 根据分离结果可知,BSCs宏基因组测序结果中丰度较高的固碳菌红杆菌属(Solirubrobacter)未被分离,这可能与该菌属对微量有机碳(>0.1 mM葡萄糖当量)及Fe³+螯合因子(如铁载体浓度>50 μM)具有严格依赖性有关,而本研究的无碳源无机培养基提供的生存环境无法满足红杆菌属的基本生命需求[42].在后期研究中,可通过改进培养基配方,使得更多的固碳菌株被分离.放线菌门的链霉菌属能够成为BSCs中优势固碳菌的原因如下:一是链霉菌对极端环境具有较强的耐受性,其产生的孢子能够抵抗不利的外界环境条件,分枝状菌丝体有利于土壤养分和水分迁移,同时能够降解纤维素和几丁质,增加土壤养分,有利于藻类的定殖和BSCs的演替[43-44].二是链霉菌可产生抗生素和溶菌酶等多种细胞代谢物质,抑制其他微生物生长,增强自身竞争能力[45].链霉菌的以上特性使其能够快速适应荒漠区干旱、能量供应胁迫的环境,导致其在沙地中能够维持较高的生存率和活性. ...
毛乌素沙地不同类型生物结皮细菌群落差异及其驱动因子
1
2023
... 根据分离结果可知,BSCs宏基因组测序结果中丰度较高的固碳菌红杆菌属(Solirubrobacter)未被分离,这可能与该菌属对微量有机碳(>0.1 mM葡萄糖当量)及Fe³+螯合因子(如铁载体浓度>50 μM)具有严格依赖性有关,而本研究的无碳源无机培养基提供的生存环境无法满足红杆菌属的基本生命需求[42].在后期研究中,可通过改进培养基配方,使得更多的固碳菌株被分离.放线菌门的链霉菌属能够成为BSCs中优势固碳菌的原因如下:一是链霉菌对极端环境具有较强的耐受性,其产生的孢子能够抵抗不利的外界环境条件,分枝状菌丝体有利于土壤养分和水分迁移,同时能够降解纤维素和几丁质,增加土壤养分,有利于藻类的定殖和BSCs的演替[43-44].二是链霉菌可产生抗生素和溶菌酶等多种细胞代谢物质,抑制其他微生物生长,增强自身竞争能力[45].链霉菌的以上特性使其能够快速适应荒漠区干旱、能量供应胁迫的环境,导致其在沙地中能够维持较高的生存率和活性. ...
链霉菌次级代谢物及其应用研究进展
1
2014
... 根据分离结果可知,BSCs宏基因组测序结果中丰度较高的固碳菌红杆菌属(Solirubrobacter)未被分离,这可能与该菌属对微量有机碳(>0.1 mM葡萄糖当量)及Fe³+螯合因子(如铁载体浓度>50 μM)具有严格依赖性有关,而本研究的无碳源无机培养基提供的生存环境无法满足红杆菌属的基本生命需求[42].在后期研究中,可通过改进培养基配方,使得更多的固碳菌株被分离.放线菌门的链霉菌属能够成为BSCs中优势固碳菌的原因如下:一是链霉菌对极端环境具有较强的耐受性,其产生的孢子能够抵抗不利的外界环境条件,分枝状菌丝体有利于土壤养分和水分迁移,同时能够降解纤维素和几丁质,增加土壤养分,有利于藻类的定殖和BSCs的演替[43-44].二是链霉菌可产生抗生素和溶菌酶等多种细胞代谢物质,抑制其他微生物生长,增强自身竞争能力[45].链霉菌的以上特性使其能够快速适应荒漠区干旱、能量供应胁迫的环境,导致其在沙地中能够维持较高的生存率和活性. ...
Desert soil bacteria deposit atmospheric carbon dioxide in carbonate precipitates
1
2018
... 在固碳菌株分离培养方面,从毛乌素沙地裸沙中分离出的固碳菌株分别隶属于红球菌属、链霉菌属、节杆菌属、动球菌属(Planococcus)和微杆菌属(Microbacterium)[46].在黄土高原森林草原区分离出的固碳菌株包括假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、链霉菌属、中华根瘤菌属(Sinorhizobium)、土壤杆菌属(Agrobacterium)、肠杆菌属(Enterobacter)、短波单胞菌属(Brevundimonas)、根瘤菌属(Rhizobium)和不动杆菌属,其中芽孢杆菌属隶属于厚壁菌门(Firmicutes)[47].在荔波喀斯特洞穴,从沉积物中分离出的固碳菌株隶属于假单胞菌属、不动杆菌属、节杆菌属、黄杆菌属(Flavobacterium sp.)、克罗诺杆菌属(Cronobacter)、剑菌属(Ensifer)、埃希氏杆菌属(Escherichia)、拟节杆菌属(Paenarthrobacter)、叶杆菌属(Phyllobacterium)、假黄色单胞菌属(Pseudoxanthomonas)、假节杆菌属(Pseudarthrobacter)、红球菌属、志贺氏菌属(Shigella)、寡养单胞菌属(Stenotrophomonas)、贪噬菌属(Variovorax)和气单胞菌属(Aeromonas),其中黄杆菌属隶属于拟杆菌门(Bacteroidetes)[48].造成分离菌株类群差异的原因可能是土壤微生物群落组成主要受土壤理化性质调控,在荒漠草原和农田中,可培养的微生物类群受pH值和土壤含水率影响[49].此外,荒漠区养分贫瘠,固碳菌以寡营养类群为主,这些微生物类群能够在养分匮乏、能量较低的生境中生存;农田和湿地养分含量较高,固碳菌可能以富营养类群为主.因此,不同养分和能量对应不同固碳菌类群[50-51]. ...
黄土高原土壤固碳微生物及其固定CO2的机理
1
2021
... 在固碳菌株分离培养方面,从毛乌素沙地裸沙中分离出的固碳菌株分别隶属于红球菌属、链霉菌属、节杆菌属、动球菌属(Planococcus)和微杆菌属(Microbacterium)[46].在黄土高原森林草原区分离出的固碳菌株包括假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、链霉菌属、中华根瘤菌属(Sinorhizobium)、土壤杆菌属(Agrobacterium)、肠杆菌属(Enterobacter)、短波单胞菌属(Brevundimonas)、根瘤菌属(Rhizobium)和不动杆菌属,其中芽孢杆菌属隶属于厚壁菌门(Firmicutes)[47].在荔波喀斯特洞穴,从沉积物中分离出的固碳菌株隶属于假单胞菌属、不动杆菌属、节杆菌属、黄杆菌属(Flavobacterium sp.)、克罗诺杆菌属(Cronobacter)、剑菌属(Ensifer)、埃希氏杆菌属(Escherichia)、拟节杆菌属(Paenarthrobacter)、叶杆菌属(Phyllobacterium)、假黄色单胞菌属(Pseudoxanthomonas)、假节杆菌属(Pseudarthrobacter)、红球菌属、志贺氏菌属(Shigella)、寡养单胞菌属(Stenotrophomonas)、贪噬菌属(Variovorax)和气单胞菌属(Aeromonas),其中黄杆菌属隶属于拟杆菌门(Bacteroidetes)[48].造成分离菌株类群差异的原因可能是土壤微生物群落组成主要受土壤理化性质调控,在荒漠草原和农田中,可培养的微生物类群受pH值和土壤含水率影响[49].此外,荒漠区养分贫瘠,固碳菌以寡营养类群为主,这些微生物类群能够在养分匮乏、能量较低的生境中生存;农田和湿地养分含量较高,固碳菌可能以富营养类群为主.因此,不同养分和能量对应不同固碳菌类群[50-51]. ...
荔波喀斯特洞穴沉积物中可培养固碳固氮细菌多样性分析及新种鉴定
1
2022
... 在固碳菌株分离培养方面,从毛乌素沙地裸沙中分离出的固碳菌株分别隶属于红球菌属、链霉菌属、节杆菌属、动球菌属(Planococcus)和微杆菌属(Microbacterium)[46].在黄土高原森林草原区分离出的固碳菌株包括假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、链霉菌属、中华根瘤菌属(Sinorhizobium)、土壤杆菌属(Agrobacterium)、肠杆菌属(Enterobacter)、短波单胞菌属(Brevundimonas)、根瘤菌属(Rhizobium)和不动杆菌属,其中芽孢杆菌属隶属于厚壁菌门(Firmicutes)[47].在荔波喀斯特洞穴,从沉积物中分离出的固碳菌株隶属于假单胞菌属、不动杆菌属、节杆菌属、黄杆菌属(Flavobacterium sp.)、克罗诺杆菌属(Cronobacter)、剑菌属(Ensifer)、埃希氏杆菌属(Escherichia)、拟节杆菌属(Paenarthrobacter)、叶杆菌属(Phyllobacterium)、假黄色单胞菌属(Pseudoxanthomonas)、假节杆菌属(Pseudarthrobacter)、红球菌属、志贺氏菌属(Shigella)、寡养单胞菌属(Stenotrophomonas)、贪噬菌属(Variovorax)和气单胞菌属(Aeromonas),其中黄杆菌属隶属于拟杆菌门(Bacteroidetes)[48].造成分离菌株类群差异的原因可能是土壤微生物群落组成主要受土壤理化性质调控,在荒漠草原和农田中,可培养的微生物类群受pH值和土壤含水率影响[49].此外,荒漠区养分贫瘠,固碳菌以寡营养类群为主,这些微生物类群能够在养分匮乏、能量较低的生境中生存;农田和湿地养分含量较高,固碳菌可能以富营养类群为主.因此,不同养分和能量对应不同固碳菌类群[50-51]. ...
西北半干旱荒漠草原与耕地土壤可培养微生物多样性及分布特征比较
1
2016
... 在固碳菌株分离培养方面,从毛乌素沙地裸沙中分离出的固碳菌株分别隶属于红球菌属、链霉菌属、节杆菌属、动球菌属(Planococcus)和微杆菌属(Microbacterium)[46].在黄土高原森林草原区分离出的固碳菌株包括假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、链霉菌属、中华根瘤菌属(Sinorhizobium)、土壤杆菌属(Agrobacterium)、肠杆菌属(Enterobacter)、短波单胞菌属(Brevundimonas)、根瘤菌属(Rhizobium)和不动杆菌属,其中芽孢杆菌属隶属于厚壁菌门(Firmicutes)[47].在荔波喀斯特洞穴,从沉积物中分离出的固碳菌株隶属于假单胞菌属、不动杆菌属、节杆菌属、黄杆菌属(Flavobacterium sp.)、克罗诺杆菌属(Cronobacter)、剑菌属(Ensifer)、埃希氏杆菌属(Escherichia)、拟节杆菌属(Paenarthrobacter)、叶杆菌属(Phyllobacterium)、假黄色单胞菌属(Pseudoxanthomonas)、假节杆菌属(Pseudarthrobacter)、红球菌属、志贺氏菌属(Shigella)、寡养单胞菌属(Stenotrophomonas)、贪噬菌属(Variovorax)和气单胞菌属(Aeromonas),其中黄杆菌属隶属于拟杆菌门(Bacteroidetes)[48].造成分离菌株类群差异的原因可能是土壤微生物群落组成主要受土壤理化性质调控,在荒漠草原和农田中,可培养的微生物类群受pH值和土壤含水率影响[49].此外,荒漠区养分贫瘠,固碳菌以寡营养类群为主,这些微生物类群能够在养分匮乏、能量较低的生境中生存;农田和湿地养分含量较高,固碳菌可能以富营养类群为主.因此,不同养分和能量对应不同固碳菌类群[50-51]. ...
毛乌素沙地土壤固定大气二氧化碳的微生物途径
1
2019
... 在固碳菌株分离培养方面,从毛乌素沙地裸沙中分离出的固碳菌株分别隶属于红球菌属、链霉菌属、节杆菌属、动球菌属(Planococcus)和微杆菌属(Microbacterium)[46].在黄土高原森林草原区分离出的固碳菌株包括假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、链霉菌属、中华根瘤菌属(Sinorhizobium)、土壤杆菌属(Agrobacterium)、肠杆菌属(Enterobacter)、短波单胞菌属(Brevundimonas)、根瘤菌属(Rhizobium)和不动杆菌属,其中芽孢杆菌属隶属于厚壁菌门(Firmicutes)[47].在荔波喀斯特洞穴,从沉积物中分离出的固碳菌株隶属于假单胞菌属、不动杆菌属、节杆菌属、黄杆菌属(Flavobacterium sp.)、克罗诺杆菌属(Cronobacter)、剑菌属(Ensifer)、埃希氏杆菌属(Escherichia)、拟节杆菌属(Paenarthrobacter)、叶杆菌属(Phyllobacterium)、假黄色单胞菌属(Pseudoxanthomonas)、假节杆菌属(Pseudarthrobacter)、红球菌属、志贺氏菌属(Shigella)、寡养单胞菌属(Stenotrophomonas)、贪噬菌属(Variovorax)和气单胞菌属(Aeromonas),其中黄杆菌属隶属于拟杆菌门(Bacteroidetes)[48].造成分离菌株类群差异的原因可能是土壤微生物群落组成主要受土壤理化性质调控,在荒漠草原和农田中,可培养的微生物类群受pH值和土壤含水率影响[49].此外,荒漠区养分贫瘠,固碳菌以寡营养类群为主,这些微生物类群能够在养分匮乏、能量较低的生境中生存;农田和湿地养分含量较高,固碳菌可能以富营养类群为主.因此,不同养分和能量对应不同固碳菌类群[50-51]. ...
Soil carbon-fixation rates and associated bacterial diversity and abundance in three natural ecosystems
1
2017
... 在固碳菌株分离培养方面,从毛乌素沙地裸沙中分离出的固碳菌株分别隶属于红球菌属、链霉菌属、节杆菌属、动球菌属(Planococcus)和微杆菌属(Microbacterium)[46].在黄土高原森林草原区分离出的固碳菌株包括假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、链霉菌属、中华根瘤菌属(Sinorhizobium)、土壤杆菌属(Agrobacterium)、肠杆菌属(Enterobacter)、短波单胞菌属(Brevundimonas)、根瘤菌属(Rhizobium)和不动杆菌属,其中芽孢杆菌属隶属于厚壁菌门(Firmicutes)[47].在荔波喀斯特洞穴,从沉积物中分离出的固碳菌株隶属于假单胞菌属、不动杆菌属、节杆菌属、黄杆菌属(Flavobacterium sp.)、克罗诺杆菌属(Cronobacter)、剑菌属(Ensifer)、埃希氏杆菌属(Escherichia)、拟节杆菌属(Paenarthrobacter)、叶杆菌属(Phyllobacterium)、假黄色单胞菌属(Pseudoxanthomonas)、假节杆菌属(Pseudarthrobacter)、红球菌属、志贺氏菌属(Shigella)、寡养单胞菌属(Stenotrophomonas)、贪噬菌属(Variovorax)和气单胞菌属(Aeromonas),其中黄杆菌属隶属于拟杆菌门(Bacteroidetes)[48].造成分离菌株类群差异的原因可能是土壤微生物群落组成主要受土壤理化性质调控,在荒漠草原和农田中,可培养的微生物类群受pH值和土壤含水率影响[49].此外,荒漠区养分贫瘠,固碳菌以寡营养类群为主,这些微生物类群能够在养分匮乏、能量较低的生境中生存;农田和湿地养分含量较高,固碳菌可能以富营养类群为主.因此,不同养分和能量对应不同固碳菌类群[50-51]. ...
Metagenomic and 13C tracing evidence for autotrophic atmospheric carbon absorption in a semiarid desert
2
2018
... 前期研究表明,毛乌素沙地裸沙地和BSCs中微生物固碳途径有6种:卡尔文循环途径(CBB)、还原性三羧酸循环途径(rTCA)、还原性乙酰辅酶A循环途径(WL)、3-羟基丙酸循环途径(3-HP)、3-羟基丙酸/4-羟基丁酸循环途径(3-HP/4-HB)和二羧酸/4-羟基丁酸循环途径(DC/4-HB).其中,rTCA途径的丰度最高,次之为CBB途径,其他固碳途径丰度较低[37,52].在干旱区,微生物固碳速率与编码CBB途径的关键酶基因丰度无显著相关性,而在稻田土壤中,两者具有显著的正相关,导致这种差异的原因可能是不同微生物类群的优势固碳途径存在差异[53].rTCA固碳途径耗能较少,在养分限制的荒漠区占优势,CBB固碳途径耗能较高,在稻田、污泥和湿地等土壤中占优势[52,54-55].因此,只利用单一酶活性解析荒漠区微生物的固碳能力并不全面.基于上述内容,本研究分别利用CBB途径限速酶(RubisCO酶)和rTCA途径限速酶(ACLY酶)解析固碳菌株的固碳能力.发现ACLY酶活性相对较高的菌株共9株,分别为菌株1、5、6、7、9、10、12、16和17,意味着这些菌株可能以rTCA循环途径固碳为主;RubisCO酶活性相对较高的菌株共8株,分别为菌株3、4、8、11、12、15、16和18,意味着这些菌株可能以CBB循环途径固碳为主.因此,在后期应用时,可先将ACLY酶活性相对较高的固碳菌株施入裸沙地,待SOC积累一段时间后,再施入RubisCO酶活性相对较高的固碳菌株.除此之外,还发现同一菌株同时拥有两种较高的固碳酶活性,如菌株16,说明同一菌株存在通过多种途径进行固碳的可能. ...
... [52,54-55].因此,只利用单一酶活性解析荒漠区微生物的固碳能力并不全面.基于上述内容,本研究分别利用CBB途径限速酶(RubisCO酶)和rTCA途径限速酶(ACLY酶)解析固碳菌株的固碳能力.发现ACLY酶活性相对较高的菌株共9株,分别为菌株1、5、6、7、9、10、12、16和17,意味着这些菌株可能以rTCA循环途径固碳为主;RubisCO酶活性相对较高的菌株共8株,分别为菌株3、4、8、11、12、15、16和18,意味着这些菌株可能以CBB循环途径固碳为主.因此,在后期应用时,可先将ACLY酶活性相对较高的固碳菌株施入裸沙地,待SOC积累一段时间后,再施入RubisCO酶活性相对较高的固碳菌株.除此之外,还发现同一菌株同时拥有两种较高的固碳酶活性,如菌株16,说明同一菌株存在通过多种途径进行固碳的可能. ...
Desert and steppe soils exhibit lower autotrophic microbial abundance but higher atmospheric CO2 fixation capacity than meadow soils
1
2018
... 前期研究表明,毛乌素沙地裸沙地和BSCs中微生物固碳途径有6种:卡尔文循环途径(CBB)、还原性三羧酸循环途径(rTCA)、还原性乙酰辅酶A循环途径(WL)、3-羟基丙酸循环途径(3-HP)、3-羟基丙酸/4-羟基丁酸循环途径(3-HP/4-HB)和二羧酸/4-羟基丁酸循环途径(DC/4-HB).其中,rTCA途径的丰度最高,次之为CBB途径,其他固碳途径丰度较低[37,52].在干旱区,微生物固碳速率与编码CBB途径的关键酶基因丰度无显著相关性,而在稻田土壤中,两者具有显著的正相关,导致这种差异的原因可能是不同微生物类群的优势固碳途径存在差异[53].rTCA固碳途径耗能较少,在养分限制的荒漠区占优势,CBB固碳途径耗能较高,在稻田、污泥和湿地等土壤中占优势[52,54-55].因此,只利用单一酶活性解析荒漠区微生物的固碳能力并不全面.基于上述内容,本研究分别利用CBB途径限速酶(RubisCO酶)和rTCA途径限速酶(ACLY酶)解析固碳菌株的固碳能力.发现ACLY酶活性相对较高的菌株共9株,分别为菌株1、5、6、7、9、10、12、16和17,意味着这些菌株可能以rTCA循环途径固碳为主;RubisCO酶活性相对较高的菌株共8株,分别为菌株3、4、8、11、12、15、16和18,意味着这些菌株可能以CBB循环途径固碳为主.因此,在后期应用时,可先将ACLY酶活性相对较高的固碳菌株施入裸沙地,待SOC积累一段时间后,再施入RubisCO酶活性相对较高的固碳菌株.除此之外,还发现同一菌株同时拥有两种较高的固碳酶活性,如菌株16,说明同一菌株存在通过多种途径进行固碳的可能. ...
Community structure and soil pH determine chemoautotrophic carbon dioxide fixation in drained paddy soils
1
2015
... 前期研究表明,毛乌素沙地裸沙地和BSCs中微生物固碳途径有6种:卡尔文循环途径(CBB)、还原性三羧酸循环途径(rTCA)、还原性乙酰辅酶A循环途径(WL)、3-羟基丙酸循环途径(3-HP)、3-羟基丙酸/4-羟基丁酸循环途径(3-HP/4-HB)和二羧酸/4-羟基丁酸循环途径(DC/4-HB).其中,rTCA途径的丰度最高,次之为CBB途径,其他固碳途径丰度较低[37,52].在干旱区,微生物固碳速率与编码CBB途径的关键酶基因丰度无显著相关性,而在稻田土壤中,两者具有显著的正相关,导致这种差异的原因可能是不同微生物类群的优势固碳途径存在差异[53].rTCA固碳途径耗能较少,在养分限制的荒漠区占优势,CBB固碳途径耗能较高,在稻田、污泥和湿地等土壤中占优势[52,54-55].因此,只利用单一酶活性解析荒漠区微生物的固碳能力并不全面.基于上述内容,本研究分别利用CBB途径限速酶(RubisCO酶)和rTCA途径限速酶(ACLY酶)解析固碳菌株的固碳能力.发现ACLY酶活性相对较高的菌株共9株,分别为菌株1、5、6、7、9、10、12、16和17,意味着这些菌株可能以rTCA循环途径固碳为主;RubisCO酶活性相对较高的菌株共8株,分别为菌株3、4、8、11、12、15、16和18,意味着这些菌株可能以CBB循环途径固碳为主.因此,在后期应用时,可先将ACLY酶活性相对较高的固碳菌株施入裸沙地,待SOC积累一段时间后,再施入RubisCO酶活性相对较高的固碳菌株.除此之外,还发现同一菌株同时拥有两种较高的固碳酶活性,如菌株16,说明同一菌株存在通过多种途径进行固碳的可能. ...
Autotrophic fixation of geogenic CO2 by microorganisms contributes to soil organic matter formation and alters isotope signatures in a wetland mofette
1
2015
... 前期研究表明,毛乌素沙地裸沙地和BSCs中微生物固碳途径有6种:卡尔文循环途径(CBB)、还原性三羧酸循环途径(rTCA)、还原性乙酰辅酶A循环途径(WL)、3-羟基丙酸循环途径(3-HP)、3-羟基丙酸/4-羟基丁酸循环途径(3-HP/4-HB)和二羧酸/4-羟基丁酸循环途径(DC/4-HB).其中,rTCA途径的丰度最高,次之为CBB途径,其他固碳途径丰度较低[37,52].在干旱区,微生物固碳速率与编码CBB途径的关键酶基因丰度无显著相关性,而在稻田土壤中,两者具有显著的正相关,导致这种差异的原因可能是不同微生物类群的优势固碳途径存在差异[53].rTCA固碳途径耗能较少,在养分限制的荒漠区占优势,CBB固碳途径耗能较高,在稻田、污泥和湿地等土壤中占优势[52,54-55].因此,只利用单一酶活性解析荒漠区微生物的固碳能力并不全面.基于上述内容,本研究分别利用CBB途径限速酶(RubisCO酶)和rTCA途径限速酶(ACLY酶)解析固碳菌株的固碳能力.发现ACLY酶活性相对较高的菌株共9株,分别为菌株1、5、6、7、9、10、12、16和17,意味着这些菌株可能以rTCA循环途径固碳为主;RubisCO酶活性相对较高的菌株共8株,分别为菌株3、4、8、11、12、15、16和18,意味着这些菌株可能以CBB循环途径固碳为主.因此,在后期应用时,可先将ACLY酶活性相对较高的固碳菌株施入裸沙地,待SOC积累一段时间后,再施入RubisCO酶活性相对较高的固碳菌株.除此之外,还发现同一菌株同时拥有两种较高的固碳酶活性,如菌株16,说明同一菌株存在通过多种途径进行固碳的可能. ...
固碳微生物的分离及其对不同状态岩溶湿地土壤的固碳能力研究
1
2022
... 菌液TOC含量的高低可指示菌株的固碳能力[56].根据菌液TOC含量测定结果可知,菌株2、14虽有较低的RubisCO酶和ACLY酶活性却表现出较高的固碳能力,进一步验证了同一株菌可通过多种途径进行碳固定.多途径固碳的代谢机制允许菌株根据昼夜温差、水分或光照切换固碳策略,以适应荒漠极端多变的环境.例如,在极端干旱或氧气不足时,关闭CBB途径,依赖rTCA和3-HP途径维持基础代谢;在强紫外线照射时,rTCA途径产生的α-酮戊二酸可参与抗氧化;WL途径又可以使菌株在极端pH下固碳;在光照、水分和氧气条件充足时,通过CBB途径在白天固碳,夜间储存多糖[57-59]. ...
Comparative genomic analysis reveals metabolic flexibility of Woesearchaeota
1
2021
... 菌液TOC含量的高低可指示菌株的固碳能力[56].根据菌液TOC含量测定结果可知,菌株2、14虽有较低的RubisCO酶和ACLY酶活性却表现出较高的固碳能力,进一步验证了同一株菌可通过多种途径进行碳固定.多途径固碳的代谢机制允许菌株根据昼夜温差、水分或光照切换固碳策略,以适应荒漠极端多变的环境.例如,在极端干旱或氧气不足时,关闭CBB途径,依赖rTCA和3-HP途径维持基础代谢;在强紫外线照射时,rTCA途径产生的α-酮戊二酸可参与抗氧化;WL途径又可以使菌株在极端pH下固碳;在光照、水分和氧气条件充足时,通过CBB途径在白天固碳,夜间储存多糖[57-59]. ...
A Rhodopseudomonas strain with a substantially smaller genome retains the core metabolic versatility of its genus
0
2025
喀斯特洞穴沉积物中可培养固碳和固氮细菌多样性分析
1
2024
... 菌液TOC含量的高低可指示菌株的固碳能力[56].根据菌液TOC含量测定结果可知,菌株2、14虽有较低的RubisCO酶和ACLY酶活性却表现出较高的固碳能力,进一步验证了同一株菌可通过多种途径进行碳固定.多途径固碳的代谢机制允许菌株根据昼夜温差、水分或光照切换固碳策略,以适应荒漠极端多变的环境.例如,在极端干旱或氧气不足时,关闭CBB途径,依赖rTCA和3-HP途径维持基础代谢;在强紫外线照射时,rTCA途径产生的α-酮戊二酸可参与抗氧化;WL途径又可以使菌株在极端pH下固碳;在光照、水分和氧气条件充足时,通过CBB途径在白天固碳,夜间储存多糖[57-59]. ...






 甘公网安备 62010202000688号
甘公网安备 62010202000688号