0 引言
戈壁是沙漠地貌的一种,主要分布于干旱或极端干旱区地势开阔地带,长期受到强烈的风蚀或物理风化作用。黑戈壁是一类特殊的戈壁地貌,地表被黑色砾石覆盖。黑戈壁仅分布于中国西部甘肃与新疆交界的大约20万km2的区域[7]。由于青藏高原以及周边山脉的阻挡,热带洋面上的水汽很难深入到这一区域,因此该区域干旱、多风,大陆性气候特别明显,年降水量一般小于100 mm,大部分区域小于50 mm,日照时间长,蒸发量极高,是降水量的十几倍[8-10]。目前关于黑戈壁区域的研究较少,仅限于地貌、气候、水文、土壤及动植物资源,微生物学相关研究未见报道。同时,由于黑戈壁区域表面的黑色砾石具有很强的太阳光吸收能力,导致它比其他戈壁区接受的辐射更强[11]。也就意味着生存其中的微生物需具备较强的抗辐射活性来应对环境胁迫,对其研究有望深入讨论极端环境下微生物的生态适应机制。
本研究首次针对河西走廊黑戈壁生态系统中可培养细菌开展研究,以期阐明其在黑戈壁生境下的分布特征,结合土壤理化因子分析阐明其分布的影响因素,通过对菌株抗辐射活性进行研究探讨其生态适应机制,所获得菌株亦可为这一特殊生境中微生物资源开发提供数据支撑及菌株资源。
1 材料和方法
1.1 样品采集
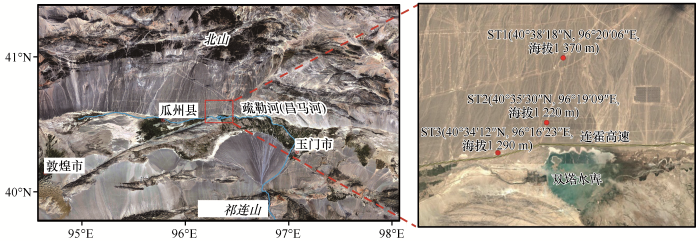
采样地点位于河西走廊甘肃省酒泉市瓜州县双塔镇(图1)。使用无菌铲和无菌勺分别采集黑戈壁砾石上表面土、砾石石下土、砾石间隙土、深层土(50 cm深度)4种土壤生境样品。具体采集方法为:每个采样点随机选取5个平行位点进行样品混合,位点间隔>200 m。砾石间隙土直接用无菌勺收进无菌袋,深层土用无菌铲挖深50 cm,后用无菌勺收进无菌袋,砾石石下土直接用无菌勺进行刮取,收进无菌袋,将取过砾石石下土的石头收进无菌袋带回实验室处理。每份样品50~100 g,4 ℃低温保存和冰袋运输。样品运输至实验室后4 ℃低温保存,并于48 h内进行微生物分离实验和理化性质测定,剩余样品储存在-20 ℃冰箱内。
图1
图1
河西走廊黑戈壁采样点位置示意图
Fig.1
Map of sampling points in black gobi of the Hexi Corridor
1.2 土壤理化性质分析
土壤含水量(SWC)采用烘干法测定(105 ℃,8 h)。土壤总碳(TC)、有机碳(TOC)和总氮(TN) 用高温燃烧法测定,用孔径为2 mm的筛子过滤后的风干土测定。将10 g土溶于50 mL的去离子水,然后振荡30 min,再静置10 min,之后用pH测量仪(PT-10,sartorius)测量土壤pH,用电导率仪(DDSJ-308A)测量电导率(EC)和盐度。因砾石上表面上样品量少,未进行理化性质测定。
1.3 土壤细菌分离培养
1.3.1 培养基
固体培养基平板选用R2A和LB培养基。R2A固体培养基:酵母粉0.5 g,胰蛋白胨0.5 g,酪蛋白氨基酸0.5 g,葡萄糖0.5 g,可溶性淀粉0.5 g,磷酸氢二钾0.5 g,七水硫酸镁0.5 g,丙酮酸钠0.5 g,琼脂15 g,1 L蒸馏水,pH值7.2(用磷酸氢二钾或磷酸二氢钾调节),121 ℃灭菌20 min。LB固体培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂15 g,1 L蒸馏水, 121 ℃灭菌20 min。
液体培养基选用R2A液体培养基,配方同R2A固体培养基,仅不包含琼脂。
1.3.2 培养方法
砾石石下土、砾石间隙土、深层土的处理方式: 将土壤样品按梯度稀释,在无菌条件下,1 g土壤样品加入9 mL无菌生理盐水,用混匀器充分振荡5 min,静置10 min后取上清液1 mL加入 9 mL 无菌生理盐水稀释得10-1稀释溶液,从10-1稀释溶液取1 mL用 9 mL 无菌生理盐水稀释10-2稀释溶液,再反复3次,最终获得10-1、10-2、10-3、10-4、10-5共5个浓度梯度的稀释溶液,每个梯度分别取100 μL溶液涂布在固体培养基平板上,置于25 ℃培养箱,培养7~15 d。
砾石上表面土的处理方式: 在无菌条件下,砾石样品用无菌棉签蘸取无菌生理盐水反复擦拭,将砾石表面的土壤清洗至无菌的试管中,再按梯度稀释。取静置10 min的溶液上清液1 mL加入9 mL无菌生理盐水稀释得10-1稀释溶液,从10-1稀释溶液取1 mL用 9 mL 无菌生理盐水稀释10-2稀释溶液,再反复3次,最终获得10-1、10-2、10-3、10-4、10-5共5个浓度梯度的稀释溶液,每个梯度分别取100 μL溶液涂布在固体培养基平板上,置于25 ℃培养箱,培养7~15 d。
1.4 分离菌株的 16S rRNA基因测序分析
挑取平板上生长的单菌落,在培养基平板上进行划线纯化、编号并记录菌落形态特征。将纯化后的菌株保存在保种液(30%培养基,70%甘油)中,放于-80 ℃超低温冰箱保藏。同时,使用PCR扩增的方法,用细菌通用引物 27F与1492R扩增细菌的16S rRNA基因。经琼脂糖凝胶电泳检测,将扩增成功的PCR产物寄至西安擎科测序公司测序,将获得的16S rRNA基因序列用BLAST核酸比对工具与NCBI的核酸数据库进行比对。
1.5 菌株抗辐射活性测定
用R2A液体培养基将要筛选的菌制备成菌悬液(OD=1,OD值用紫外分光光度计在波长600 nm下测定),取稀释到10-4的菌悬液1 mL平铺到平板中,放入紫外箱中照射20 min(辐照强度为1 000 J·m-2),之后取100 μmL到固体培养基平板上进行涂布,取未照射过的10-4菌液100 μmL涂布到固体培养基平板上作为对照,每个做3个平行,培养7~15 d后进行计数,计算菌株存活率。
1.6 数据统计分析
数据的统计分析与处理在SPSS和Origin程序中进行。P值为所做的显著性分析。P<0.05,表示两组存在显著差异,P<0.001,表示两组的差异极其显著,两组之间有相关性,然后再看R值,|R|值越大,相关性越好,正数代表正相关,负数代表负相关。
2 结果
2.1 黑戈壁土壤的理化性质
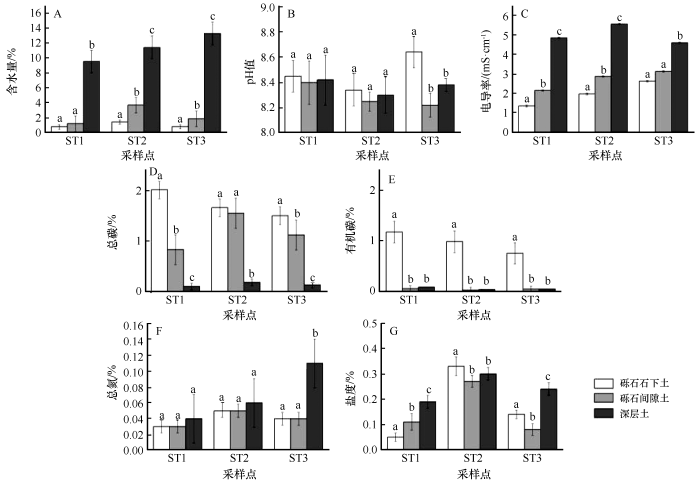
河西走廊黑戈壁不同土壤理化因子特征不同(图2)。土壤平均含水量和电导率表现出深层土>砾石间隙土>砾石石下土的特征。深层土平均含水量为11.45 %,显著高于砾石间隙土(2.27 %)和砾石石下土(1.02 %)。深层土平均电导率为5.02 mS·cm-1,是砾石间隙土平均电导率(2.73 mS·cm-1)的1.83倍,是砾石石下土(2.00 mS·cm-1)的2.51倍。土壤平均总碳显示出深层土<砾石间隙土<砾石石下土,深层土总碳含量显著低于砾石石下土和砾石间隙土。砾石石下土有机碳含量显著高于砾石间隙土和深层土,砾石间隙土和深层土有机碳含量接近且无显著差异。总氮浓度0.03%~0.11%,深层土平均总氮的含量高于砾石石下土和砾石间隙土。土壤的盐度0.08%~0.34%,pH值8.22~8.64,但是不同样品间无显著差异。理化性质的不同表明了黑戈壁生境的异质性。
图2
图2
河西走廊黑戈壁土壤理化性质
对同一采样点,不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著
Fig.2
Physical and chemical properties of soil in black gobi of the Hexi Corridor
2.2 黑戈壁土壤可培养细菌数量分布特征
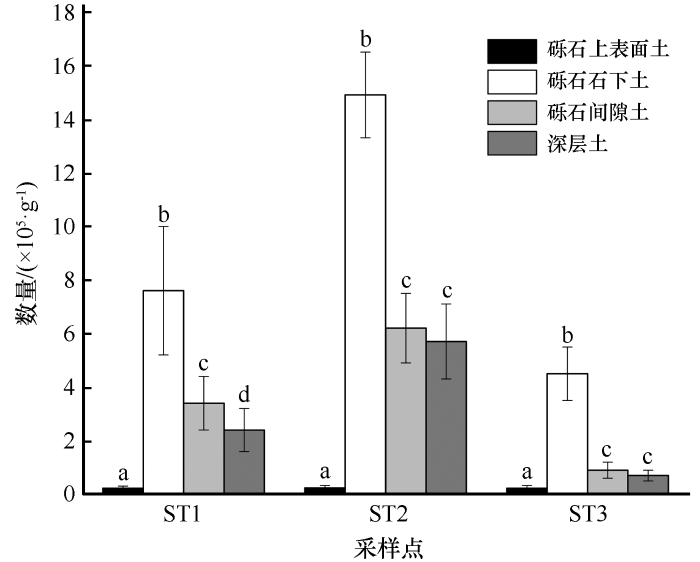
可培养细菌的数量随取样地点的不同而有显著差异,可培养细菌数量分布特征呈现为:砾石石下土>砾石间隙土>深层土>砾石上表面土,砾石上表面土、砾石石下土、砾石间隙土、深层土每克土壤可培养细菌数量(CFU)平均值分别是2.33×104、9.00×105、3.50×105、2.93×105(图3)。
图3
图3
河西走廊黑戈壁土壤可培养细菌数量分布特征
对同一采样点,不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著
Fig.3
Distribution characteristics of soil culturable bacteria in black gobi of the Hexi Corridor
2.3 黑戈壁土壤可培养细菌菌群组成
通过平板筛选,依据菌株形态差异共获得198株菌株,通过16S rRNA基因测定及序列比对分析,最终得到118 株菌株,分属于4个门:放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和异常球菌-栖热门(Deinococcus-Thermus)。其中,放线菌门和厚壁 菌门为优势菌门,3个样点所占比例分别为64.06%和26.56%、45.41%和44.95%、67.46%和18.21%(表1)。
表1 河西走廊黑戈壁土壤可培养细菌菌株
Table 1
| 门 | 属 | 编号 | 相似菌株 | 登录号 | 相似度/% | 属 | 编号 | 相似菌株 | 登录号 | 相似度/% |
|---|---|---|---|---|---|---|---|---|---|---|
| Actinobacteria | Agrococcus | ST2LB-2 | A. citreus ZBGKL11 | KJ734880 | 99.71 | Streptomyces | ST2SX-8 | S. africanus E3SQ | MH472998 | 98.80 |
| ST1-1-2-2 | A. jenensis DW414 | KR856324 | 97.32 | ST1-1-2-5 | S. cacaoi Ru87 | KY818662 | 97.87 | |||
| ST3-6 | A. jenensis Y25 | MK721042 | 99.34 | ST3-3-2-5 | S. capoamus JCM 4734 | NR_040856 | 99.56 | |||
| ST3-4 | A. jenensis Y14 | MK721034 | 99.26 | ST3-3-2-6-1 | S. chryseus HBUM174847 | EU841613 | 97.51 | |||
| ST3-3 | A. terreus BT116 | MH934923 | 99.85 | ST2-S1 | S. coeruleoaurantiacus K7 | KR023963 | 99.85 | |||
| Amycolatopsis | ST3-18 | A. nigrescens CSC17Ta-90 | NR_043880 | 97.93 | ST1-1-1-13 | S. coeruleofuscus MR-18 | KY753217 | 99.85 | ||
| Arsenicicoccus | ST1-1-1-17-1 | A. bolidensis CCUG 47306 | NR_025598 | 99.93 | ST1SX-8 | S. glaucescens NRRL B-2706 | NR_115773 | 99.93 | ||
| Arthrobacter | ST3-16 | A. agilis IHBB 11164 | KR085842 | 99.01 | ST1SX-14 | S. gobitricini LMG 19910 | AJ781335 | 100.00 | ||
| ST3-15 | A. agilis II/11 | KM036066 | 99.71 | ST3-2-1-10-2 | S. lavendulocolor NBRC 12881 | NR_112317 | 99.93 | |||
| ST1-1-2-7 | A. crystallopoietes MR-15 | KY753214 | 99.93 | ST3B1 | S. litmocidini HBUM175011 | FJ486428 | 98.65 | |||
| Auraticoccus | ST3-10 | A. monumenti AL12 | KU258209 | 98.17 | ST1-1-2-4 | S. lunaelactis 244-HNR7 | MF077012 | 99.11 | ||
| ST3-2 | A. monumenti MON 2.2 | LT629688 | 99.55 | ST3-24-1-1 | S. lunaelactis MM109 | CP026304 | 99.12 | |||
| ST3-21 | A. sp. R-68201 | KY386505 | 95.24 | ST1-1-2-3 | S. lunaelactis MMun143 | MG980181 | 99.19 | |||
| ST3-22 | A. monumenti AL12 | KU258209 | 94.31 | ST3-2-1-1-2-1 | S. misionensis 12-4 | KJ571074 | 99.49 | |||
| Blastococcus | ST1-1-1-16 | B. aggregatus 1P10AnA | EU977831 | 99.63 | ST3-2-1-8-1 | S. misionensis cfcc3147 | FJ792563 | 99.63 | ||
| ST3-5-2 | B. capsensis R9 | MK696404 | 99.63 | ST1-1-2-10-1 | S. palmae CMU-AB199 | LC413945 | 98.02 | |||
| ST3-24-1-3 | B. capsensis RQ2 | MK696394 | 99.09 | ST1-1-2-10 | S. palmae CMU-AB204 | NR_152026 | 97.47 | |||
| ST2B4 | B. endophyticus YIM 68236 | NR_108608 | 99.32 | ST2SB-6 | S. piloviolofuscus 174468 | EU593715 | 97.66 | |||
| ST3-12-1 | B. saxobsidens DD2 | FO117623 | 99.78 | ST3-2-2-2 | S. pulveraceus MR-27 | KY753226 | 96.65 | |||
| ST3-24 | B. saxobsidens BC444 | NR_117019 | 99.33 | ST3-3-2-6 | S. sp. Z594b | MN371360 | 97.72 | |||
| ST2SX-1 | B. saxobsidens BC448 | NR_025482 | 99.64 | ST2SX-5-2 | S. rimosus PSK5-20B | MN421096 | 96.81 | |||
| Crossiella | ST3SX-11 | C. equi NRRL B-24104 | NR_025088 | 99.18 | ST1-3-2-2 | S. sioyaensis W24 | KP718602 | 99.12 | ||
| Janibacter | ST1-1-2-11 | J. terrae CS12 | NR_036868 | 99.85 | ST3-2-1-9-1 | S. spinoverrucosus 173372 | EU570683 | 98.89 | ||
| Kineococcus | ST2SS-1 | K. radiotolerans SRS30216 | NR_074542 | 99.00 | ST3-12 | S. spinoverrucosus 174464 | EU593714 | 99.05 | ||
| Kocuria | ST1-1-1-24-2 | K. gwangalliensis SJ2 | NR_116266 | 99.93 | ST2SX7 | S. spinoverrucosus NBRC 14228 | NR_041159 | 97.81 | ||
| ST3-24-1-2 | K. indica SJU27 | MN511772 | 99.86 | ST3SX-4 | S. spinoverrucosus Ng2-6 | MK519101 | 98.62 | |||
| ST2LB-1 | K. rosea 5 | KF923415 | 99.78 | ST1-1-2-9 | S. sp. NO8 | KC200022 | 100.00 | |||
| Lechevalieria | ST1SX-6-2 | L. atacamensis 41-HR6 | MF077035 | 99.46 | ST2-5 | S. xinghaiensis S15077 | MG563223 | 99.78 | ||
| ST2SX-6 | L. atacamensis C61 | NR_116354 | 95.81 | Saccharothrix | ST2B-10-4 | S. lopnurensis YIM LPA2h | NR_145947 | 98.62 | ||
| ST1SX-10 | L. xinjiangensis R24 | NR_044009 | 99.26 | ST3-3-1 | S. yanglingensis Hhs.015 | NR_117283 | 99.55 | |||
| Microbacterium | ST2LB-3 | M. kitamiense kitami C2 | NR_112042 | 99.71 | Modestobacter | ST3-14 | M. caceresii KNN 45-2b | NR_137398 | 99.56 | |
| ST3-6 | M. oxydans 4-46-1-1-1 | MK425667 | 99.85 | ST3-1-1-13 | M. marinus BC501 | FO203431 | 99.93 | |||
| Pseudonocardia | ST1SX-2 | P. hierapolitana PM2084 | NR_126236 | 99.26 | ||||||
| Deinococcus-Thermus | Deinococcus | ST1SX-4 | D. sp. 4B4 | EU029131 | 97.07 | |||||
| ST1-1-1-9 | D. sp. 4B6 | EU029132 | 99.83 | |||||||
| Firmicutes | Bacillus | ST1-1-1-24-1 | B. amyloliquefaciens HX2016004 | MN176577 | 100.00 | Bacillus | ST1SX-3 | B. atrophaeus XAAS.xj4 | MN187264 | 99.86 |
| ST1-1-1-17 | B. amyloliquefaciens KB-82 | KM269197 | 100.00 | ST2SX-3 | B. atrophaeus Y27 | MK721044 | 100.00 | |||
| ST2SS3-1 | B. atrophaeus HAB_5 | MK310269 | 99.93 | ST1-1-1-9 | B. cereus LH8 | KC248215 | 99.93 | |||
| ST1-1SX-3 | B. atrophaeus MER_TA_30 | KT719435 | 99.93 | ST2-19-2 | B. cereus st2 | MF102134 | 99.93 | |||
| ST1-1-1-17-2 | B. licheniformis D69 | KU922147 | 99.86 | ST1-1-2-6 | B. foraminis CD5 | MK216757 | 99.64 | |||
| ST2-19-1 | B. mojavensis h | MG839268 | 100.00 | ST3-1-1-3-1 | B. halotolerans FJAT-45391 | KY849471 | 100.00 | |||
| ST1SX8-1 | B. paramycoides OOF5 | MH542275 | 99.86 | ST2-26 | B. subtilis GuanMX | MN473282 | 100.00 | |||
| ST1-1-2-13 | B. pumilus D51 | JX293284 | 99.93 | ST3-2 | B. subtilis PSBnR5 | MH257752 | 100.00 | |||
| ST1SX-5 | B. safensis MDL5 | MN493773.1 | 100.00 | ST1-1-1-20 | B. subtilis Sk01A | MH210872 | 99.79 | |||
| ST3-27 | B. safensis YZ1709B01 | MK748241.1 | 99.79 | ST3-5 | B. tequilensis 6MS1 | MK713704 | 97.32 | |||
| ST2-29 | B. simplex ZLynn1000-56 | KY316470 | 99.57 | ST1-1-2-1 | B. vallismortis 70.LE.1 | MN149347 | 99.93 | |||
| ST3SS4-1 | B. subtilis 2/30 | MN435586 | 100.00 | ST2B8 | B. vallismortis Y | MG839261 | 98.57 | |||
| ST3-2-2-12 | B. velezensis N8 | KX588164 | 100.00 | |||||||
| Paenibacillus | ST2-28 | P. harenae NJY-3 | MF101120 | 95.90 | Enterococcus | ST3-2-1-9-3 | E. sp. 79w3 | AB675140 | 94.50 | |
| ST3-24-2 | P. polymyxa RCP6 | GU369972 | 99.63 | Staphylococcus | ST2SS2-1 | S. saprophyticus subsp. saprophyticus zzx27 | KJ009395 | 99.51 | ||
| Proteobacteria | Azospirillum | ST3SX-5 | A. palatum ww10 | EU747318 | 94.87 | Massilia | ST3-20 | M. varians 66-LR14-2 | MF077216 | 99.48 |
| ST2SX5-1 | A. sp. NCCP-699 | LC193946 | 96.99 | Methylorubrum | ST2SX-5-1 | M. pseudosasae IMB16-188 | MG190781 | 100.00 | ||
| Belnapia | ST1SX-20 | B. moabensis CP2C | NR_042371 | 99.20 | Microvirga | ST3-2-1-6 | M. aerilata KBL26 | MG576179 | 98.19 | |
| ST3-2-1-11 | B. rosea CPCC 100156 | NR_109297 | 99.85 | ST3-2-1 | M. aerilata NBRC 106137 | NR_114298 | 100.00 | |||
| Brevundimonas | ST2-2 | B. diminuta 264AG7 | KF836539 | 99.78 | ST3-13 | M. ossetica V5/5K | KX576554 | 98.36 | ||
| ST2-10 | B. diminuta HMS9 | MK696984 | 99.92 | ST3-2-1-10 | M. sp. R491-7 | KX444133 | 98.89 | |||
| ST3SS-7 | B. naejangsanensis 5S3 | KM374767 | 99.69 | Pseudomonas | ST2SS3-2 | P. fluorescens psf14 | MN256400 | 99.58 | ||
| ST3-27-2 | B. vesicularis CX-89 | MH368406 | 99.70 | ST3-2-3-12-1-1 | P. putida YP2 | KP313537 | 100.00 | |||
| Candidimonas | ST1-3-2-5 | C. bauzanensis BZ59 | NR_108569 | 98.23 | ST1-1-2-2-1 | P. stutzeri SYJ1-8 | KR262851 | 99.57 | ||
| Enterobacter | ST1SX-6-1 | E. hormaechei SCEH020042 chromosome | CP028538 | 99.71 | Roseomonas | ST3-1-1-14 | R. oryzae JC288 | NR_137403 | 98.34 | |
| Herbaspirillum | ST3-2-1-12 | H. sp. 1NM-18 | JQ608328 | 97.76 | Stenotrophomonas | ST3-3-1-2 | S. rhizophila EGE-B-6 | KP050794 | 99.71 |
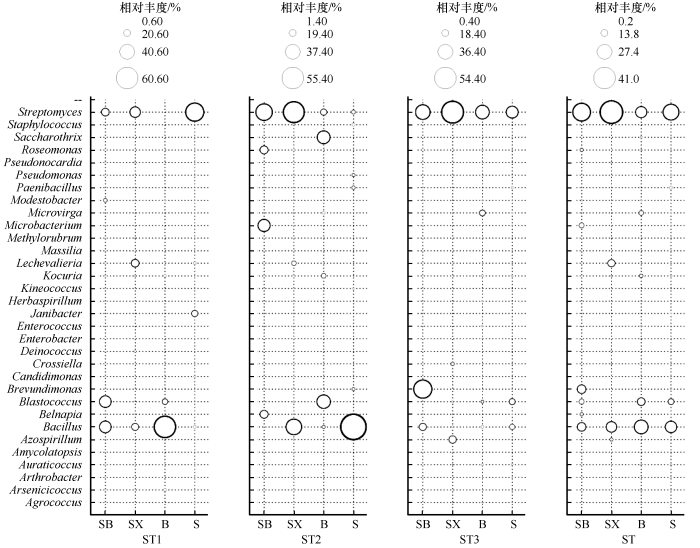
118株菌株分属于32个属:土壤球菌属(Agrococcus)、Arsenicicoccus、节细菌属(Arthrobacter)、Auraticoccus、 Amycolatopsis、固氮螺菌属(Azospirillum)、芽孢杆菌属(Bacillus)、Belnapia、芽球菌属(Blastococcus)、短波单胞菌属(Brevundimonas)、Candidimonas、克洛氏菌属(Crossiella)、异常球菌属(Deinococcus)、肠杆菌属(Enterobacter)、肠球菌属(Enterococcus)、两面神菌属(Janibacter)、草螺菌属(Herbaspirillum)、动球菌属(Kineococcus)、考克氏菌属(Kocuria)、列契瓦尼而氏菌属(Lechevalieria)、Massilia、 Methylorubrum、细杆菌属(Microbacterium)、Microvirga、贫养杆菌属(Modestobacter)、类芽胞杆菌属(Paenibacillus)、假单胞菌属(Pseudomonas)、假诺卡氏菌属(Pseudonocardia)、玫瑰单胞菌属(Roseomonas)、糖丝菌属(Saccharothrix)、葡萄球菌属(Staphylococcus)、链霉菌属(Streptomyces)。其中芽孢杆菌属、链霉菌属是优势菌属,在土壤中相对丰度分别为20.88%和31.81%(图4)。
图4
图4
河西走廊黑戈壁土壤菌株相对丰度气泡图
SB:砾石上表面土;SX:砾石石下土;B:砾石间隙土;S:深层土
Fig.4
Relative abundance bubble diagram of culturable bacteria strains in black gobi of the Hexi Corridor
河西走廊黑戈壁不同生境土壤中可培养细菌分布有所异同,其中链霉菌属和芽孢杆菌属为优势菌属,在不同生境土壤广泛分布。链霉菌属在砾石上表面土、砾石石下土、砾石间隙土和深层土的相对丰度分别为32.26%、41.03%、20.20%和28.75%,在砾石石下土分布更广泛。芽孢杆菌属在砾石上表面土、砾石石下土、砾石间隙土和深层土的相对丰度分别为16.13%、19.05%、25.00%和20.89%,在砾石间隙土分布更为广泛(图4)。
所有菌株中,有10株菌株16S rRNA基因序列比对相似度≤97%,为潜在新种资源,其中放线菌门5株,变形菌门2株,厚壁菌门2株,异常球菌-栖热门1株(表1)。
研究区可培养细菌Shannon多样性指数呈现特征为:深层土>砾石间隙土>砾石石下土>砾石上表面土;Simpson多样性指数呈现特征为:深层土<砾石间隙土<砾石石下土<砾石上表面土(表2)。
表2 河西走廊黑戈壁可培养细菌多样性指数
Table 2
| 土壤生境 | Shannon多样性指数 | Simpson多样性指数 |
|---|---|---|
| 砾石上表面土 | 2.3804 | 0.1009 |
| 砾石石下土 | 3.2668 | 0.0518 |
| 砾石间隙土 | 3.4482 | 0.0379 |
| 深层土 | 3.8591 | 0.0253 |
2.4 可培养细菌数量及多样性与土壤理化因子的相关性
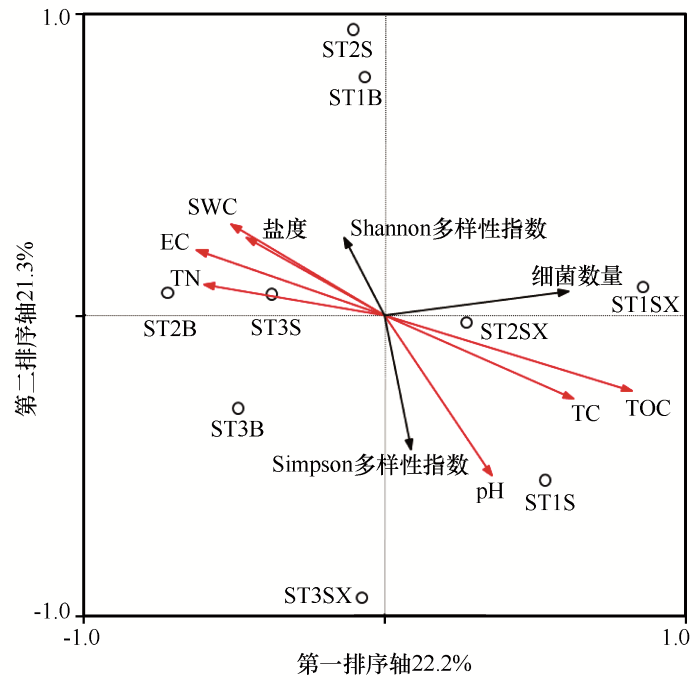
CCA分析表明:土壤细菌数量与有机碳、总碳正相关,与总氮、含水量和盐度负相关;Shannon多样性指数与pH负相关(图5)。Person相关性分析表明:土壤细菌数量与总碳显著正相关(R=0.783,P=0.013)。
图5
图5
河西走廊黑戈壁可培养细菌和土壤理化因子之间的典型对应分析(CCA)
SB:砾石上表面土;SX:砾石石下土;B:砾石间隙土;S:深层土
Fig.5
Typical correspondence analysis (CCA) between soil factors and culturable bacteria in black gobi of the Hexi Corridor
2.5 分离菌株的抗辐射活性
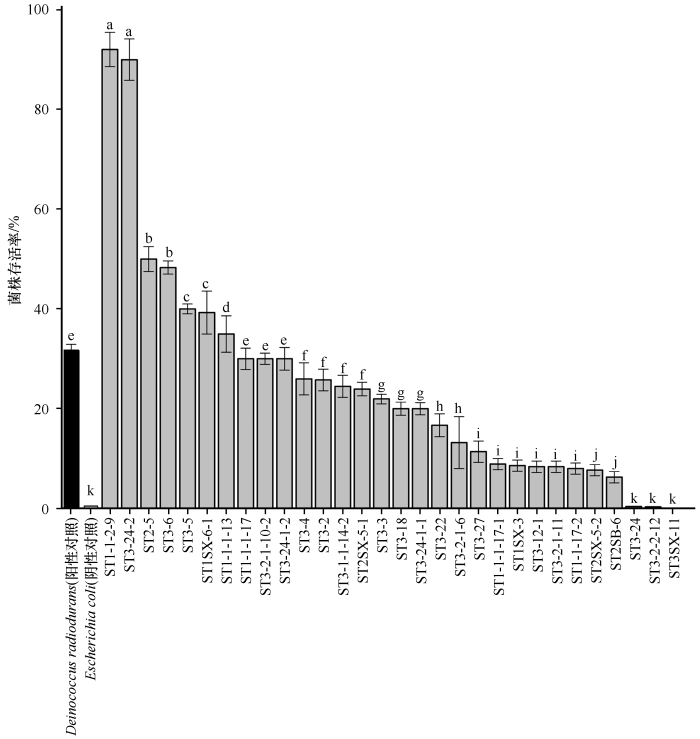
对可培养分离出的菌株进行抗辐射的筛选,其中30株菌在经过辐射后仍具有生长活性(选用耐辐射奇球菌(Deinocccus radiodurans)作为阳性对照,大肠杆菌(Escherichia coli)作为阴性对照)。辐射过后,有7株菌的存活率要显著高于阳性对照耐辐射奇球菌(P<0.001)。其中有两株高达90%以上,菌株ST1-1-2-9达到92.06%,属于链霉菌属,菌株ST3-24-2达到90.00%,属于类芽孢杆菌属(图6)。还有5株菌辐射活性较高,ST2-5能达到50%,ST3-6达到48.30%,ST3-5达到40.00%,ST1SX-6-1达到39.27%,ST1-1-1-13达到43.98%(图6)。此外有3株菌的存活率与阳性对照耐辐射奇球菌无显著差异(3株均为P=0.382),17株菌的存活率显著低于阳性对照耐辐射奇球菌但显著高于阴性对照大肠杆菌(0.42%~31.58%),3株菌的存活率显著低于阴性对照大肠杆菌(<0.42%)。
图6
图6
河西走廊黑戈壁部分可培养菌株抗辐射存活率(耐辐射奇球菌(Deinocccus radiodurans)作为阳性对照,大肠杆菌(Escherichia coli)作为阴性对照)
不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著
Fig.6
Radiation-tolerant survival rate of culturable strains in black gobi of the Hexi Corridor
3 讨论
河西走廊黑戈壁环境条件恶劣,但仍分离了许多可培养细菌菌株,每克土壤可培养细菌数量(CFU)为2.33×104~9.00×105,与干旱的沙漠生境中的可培养细菌数量(10~1.6×107)相似[12]。已有研究发现,世界不同地区沙漠中微生物数量亦随环境差异而存在较大的差异,如智利阿塔卡马沙漠表层的每克土壤可培养微生物数量为103~104,深层每克土壤的可培养微生物数量为9×104~5.4×105,美国索诺兰沙漠表层每克土壤可培养微生物数量为9.6×106 [13],瑞士马特洪峰谷沙漠表层每克土壤可培养微生物数量为0~2 ×102 [14],亚洲库布齐沙漠表层每克土壤可培养微生物数量为104~1.6×105[15]。相似的干旱环境下,河西走廊黑戈壁可培养细菌数量相对更少,这可能与其极端的高辐射、干旱环境密切相关。本研究中,黑戈壁可培养细菌主要富集于石下土环境中,每克土壤可培养细菌数量最高可达1.49×106。石下土微生物为定殖在岩石的底部或岩土界面的微生物及微生物群落。这类微生物群落在沙漠(戈壁)中常见,例如,美国莫哈韦沙漠[16]、以色列内盖夫沙漠[17]、非洲纳米布沙漠[18]、南极韦斯特福尔山脉[19]。岩石的底部为微生物提供了一个可以保持湿度和避免高光强辐照保护区,使得石下生微生物免受极端干旱和光化学氧化胁迫的伤害[20]。黑戈壁生境中可培养细菌主要富集于石下生境,表明该生态系统中砾石下为该生态系统中的微生物提供了相对较适宜的生境。
河西走廊黑戈壁可培养细菌主要归类于放线菌门、厚壁菌门、变形菌门和异常球菌-栖热门。其中,放线菌门和厚壁菌门为优势菌门。已有研究指出,亚洲沙漠区域土壤细菌主要是放线菌门、厚壁菌门、变形菌门、拟杆菌门(Bacteroides)和芽单胞菌门(Gemmatimonadetes)[21-29];美洲沙漠区域土壤细菌主要是放线菌门、厚壁菌门、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)和酸杆菌门[30-34];非洲沙漠区域土壤细菌主要是放线菌门、厚壁菌门、浮霉菌门、绿弯菌门、变形菌门和拟杆菌门[35-36]。澳洲沙漠区域土壤细菌主要是放线菌门、厚壁菌门、绿弯菌门、变形菌门和芽单胞菌门[37-38]。这表明,相似的干旱胁迫环境下,黑戈壁与其他沙漠环境形成了相似的菌群结构来应对环境胁迫,黑戈壁具有与沙漠生境相似的菌群结构。
在戈壁中,干旱和强辐射是持久的[48],因此该区域的微生物长期受到强辐射的影响。辐射能破坏微生物中的DNA或RNA的分子结构,会造成生长性细胞死亡和(或)再生性细胞死亡,来达到杀死微生物的效果[49]。河西走廊黑戈壁中可培养细菌对紫外辐射表现出了较高的耐受活性。研究表明,紫外灯杀菌消毒时,94.85 J·m-2紫外辐照,杀菌率可达到99% [50]。本研究的辐射强度达到了1 000 J·m-2,将辐射强度提高约10倍来模拟一个高辐射的环境来筛选菌株,筛选出7株抗辐射活性高的菌株,其中抗辐射活性最高的菌株是ST1-1-2-9,其抗辐射存活率达到92.06%。ST1-1-2-9在NCBI最相近菌株是Streptomyces sp. NO8,该菌株分离自辐射污染土壤中,抗辐射活性强。链霉菌属可以在不利环境下长期存活,能产生各类生物活性物质[51],具有一定的抗逆性[39-41]。极端环境中的链霉菌在环境胁迫下能产生新的代谢途径和次生化合物[52]。另一株抗辐射活性较高的菌株是ST3-24-2(Paenibacillus polymyxa RCP6),其抗辐射存活率达到90.00%。类芽孢杆菌属跟芽孢杆菌属一样,具有很强的拮抗性,对逆境具有很好的适应性[53]。因此河西走廊黑戈壁中强辐射环境下孕育了具高效抗辐射活性的菌株资源。
参考文献
中国黑戈壁地区水文和水化学调查研究
[J].
Four-fold increase in solar forcing on snow in western U.S.burned forests since 1999
[J].
Mars-like soils in the Atacama Desert,Chile,and the dry limit of microbial life
[J].
Antarctica
[M]//Holdgate M W.
Desert farming benefits from microbial potential in arid soils and promotes diversity and plant health
[J].
Community composition and photosynthesis by photoautotrophs under Quartz Pebbles,Southern Mojave Desert
[J].
The influence of temperature and light penetration on the abundance of the hypolithic algae in the Negev desert of Israel
[J].
Water status of green and blue-green phycobionts in Lichen Thalli after hydration by water vapor uptake:Do they become turgid
[J].
Sublithic bacteria associated with Antarctic quartz stones
[J].
The role of nonphotosynthetic microbes in the recovery of biological soil crusts in the Gurbantunggut Desert,Northwestern China
[J].
Bacterial diversity of surface sand samples from the Gobi and Taklamaken Deserts
[J].
Fungi in hot and cold deserts with particular reference to microcolonial fungi
[J].
Spatiotemporal distribution of soil microfungi in the Makhtesh Ramon area,central Negev desert,Israel
[J].
Prospecting cold deserts of north western Himalayas for microbial diversity and plant growth promoting attributes
[J].
Bacterial diversity and occurrence of ammonia-oxidizing bacteria in the Atacama Desert soil during a “desert bloom” event
[J].
Bacterial diversity and distribution in the southeast edge of the Tengger Desert and their correlation with soil enzyme activities
[J].
固沙植被区土壤质地与土壤微生物数量的关系
[J].
Delineating Kocuria turfanensis 2M4 as a credible PGPR:a novel IAA-producing bacteria isolated from saline desert
[J].
Microflora of extreme arid Atacama Desert soils
[J].
Abiotic factors shape microbial diversity in Sonoran Desert soils
[J].
Diversity of ionizing radiation-resistant bacteria obtained from the Taklimakan Desert
[J].
Streptomyces asenjonii sp.nov.,isolated from hyper-arid Atacama Desert soils and emended description of Streptomyces viridosporus Pridhamet al.1958
[J].
The desert of Tataouine:an extreme environment that hosts a wide diversity of microorganisms and radiotolerant bacteria
[J].
An examination of the bacteriophages and bacteria of the Namib desert
[J].
Capturing greater 16S rRNA gene sequence diversity within the domain Bacteria
[J].
Diverse,yet-to-be-cultured members of the Rubrobacter subdivision of the Actinobacteria are widespread in Australian arid soils
[J].
6株野生植物内生放线菌防病促生作用的初步研究
[J].
高通量测序技术下连作植烟土壤细菌群落与土壤环境因子的耦合分析
[J].
Fungi associated with rocks of the Atacama Desert:taxonomy,distribution,diversity,ecology and bioprospection for bioactive compounds
[J].
Molecules derived from the extremes of life
[J].




 甘公网安备 62010202000688号
甘公网安备 62010202000688号