0 引言
生物结皮在干旱和半干旱地区广泛分布,是由土壤生物(藓类、苔类、真核藻类、地衣、细菌和蓝藻)和表层土壤颗粒胶结形成的层状结构[1]。生物结皮的种类多样,包括藻类、地衣、藓类以及混生为主的各种不同类型[2]。生物结皮的演替能够促进荒漠生态系统的恢复,增强土壤的稳定性,减少侵蚀,同时能固定碳(C)、氮(N),影响养分循环,从而引发土壤生态化学计量特征的变化。生态化学计量学作为研究生态系统各组分主要组成元素平衡关系和耦合关系的重要方法[3],可用以认识植物-土壤相互作用的养分调控机制、揭示生态系统养分元素之间的相互作用与平衡制约关系[4]。因此,对生物结皮土壤化学计量特征的研究能够揭示干旱半干旱地区生物结皮对土壤养分循环的贡献,对生态恢复及管理提供科学依据[5]。
微生物是生物结皮的重要组成部分,参与全球干旱区生物地球化学循环过程[6]。土壤酶是土壤中活跃的有机组分,主要来自于土壤动物、植物根系和微生物分泌释放,在土壤有机物的形成和转化过程中起着重要作用[7]。但在水分受限制的荒漠地区,动植物分布稀疏,土壤酶主要由土壤微生物分泌作用产生[8]。土壤酶活性对土壤养分核心要素C、N、磷(P)元素的转化和迁移具有重要作用。鉴于土壤酶活性与土壤养分化学计量比可能存在动态平衡关系[9],可将土壤酶活性视作诊断土壤肥力高低和土壤环境优劣的一个重要指标[10]。目前关于生物结皮酶活性的研究较集中在单一或是混生的生物结皮,很少涉及不同生物结皮类型对土壤酶活性的影响。此外,陆地生态系统不同组分如叶片、根系、土壤、微生物和凋落物等的C∶N∶P化学计量关系在各组分之间存在传递关系[11]。高丽倩等[5]采用时空互代法,研究了黄土高原不同演替阶段的生物结皮对土壤生态化学计量特征的影响,发现生物结皮的形成和演替可显著影响土壤生态化学计量特征,且其影响可至其下2—5 cm土层。吴旭东等[12]研究了不同降雨处理对荒漠草原生物结皮化学计量的影响,认为相较于结皮层下土壤,结皮层C、N、P含量较高,呈现明显的“表聚性”。在生物结皮演替过程中,土壤性状与微生物群落存在耦合作用和协同变化。结皮类型不同,其下层土壤理化性质也会存在较大差异,并在一定程度上影响土壤酶活性[13]。生物结皮能够固定C、N并活化P,使表层土壤C、N、P含量均显著增加,并会改变土壤化学计量特征[14-15]。
目前关于生物结皮类型和演替对土壤养分的影响已有大量报道,但关于生物结皮演替如何通过调控土壤酶活性和土壤理化性质,从而对土壤化学计量特征产生影响仍需要深入研究。因此,本研究采用时空互代法,通过调查毛乌素沙地处于不同演替阶段的3类生物结皮中与C、N、P 养分循环有关的土壤酶活性(过氧化氢酶、蔗糖酶、脲酶和碱性磷酸酶)的变化,研究生物结皮演替对土壤酶活性及其对土壤C、N、P化学计量特征的影响,以期通过生物结皮与土壤酶活性的关系来指示生物结皮对荒漠区土壤质量的贡献。
1 研究区和研究方法
1.1 研究区概况
研究区位于毛乌素沙地西南部的宁东能源化工基地核心区(37°48′N,107°21′E)。研究区的自然生态系统是典型的荒漠草原,属于中温带干旱气候区,具有典型的温带大陆性气候特征。年降水量194.7 mm,蒸发量2 088.2 mm,年均气温6.7—8.8 ℃,无霜期154 d。地带性土壤以灰钙土为主,非地带性土壤以风沙土为主。植被以耐旱、耐寒、耐土壤贫瘠的灌木和草本植物为主[16]。经野外植被调查发现,研究区生物结皮分布较为广泛,优势生物结皮类型主要有藻结皮、地衣结皮和藓结皮,藻类结皮多成片分布,藓结皮大多以斑块状分布,地衣结皮零星极少。其中分布较多、盖度较大且发育良好的藓类和藻类主要有真藓(Bryum argenteum)、土生对齿藓(Didymodon vinealis)、盐土藓(Pterygoneurum subsessile)、厚肋流苏藓(Crossidium crassinerve)、具鞘微鞘藻(Microcolus vaginatus)、念珠藻(Nostoc commune)、隐头舟形藻(Navicula cryptocephala)等。
1.2 样地布设和样品采集
采样于2019年7月下旬进行。为避免地形对本研究的影响,选取3块地形相对平坦的生物结皮分布区作为研究样地,并分别标记为样地1、样地2和样地3。各样地间隔20—50 m,样地基本概况见表1。依据生物结皮中优势生物类群的差异,将研究样地内聚集分布的结皮划分为3类:藻结皮、混生结皮和藓结皮。其中,藻类结皮厚度3—5 mm,生物量9.74±1.79 μg·g-1,多呈片状分布;混生结皮厚度4—7 mm,生物量27.26±2.22 μg·g-1;藓结皮厚度8—15 mm,生物量4.13±0.65 g·dm-2,多呈斑块状分布。
表1 样地基本概况
Table 1
| 样地 | 坡度/% | 结皮特征 | 主要植物种 | 植被盖度/% |
|---|---|---|---|---|
| 样地1 | 4 | 生物结皮总盖度82%,藻结皮相对盖度49%,藓结皮相对盖度26%,地衣结皮相对盖度9% | 猪毛蒿(Artemisia scoparia) 冰草(Agropyron cristatum) 沙生针茅(Stipa glareosa) 甘草(Glycyrrhiza uralensis) | 33 |
| 样地2 | 7 | 生物结皮总盖度80%,藻结皮相对盖度45%,藓结皮相对盖度42%,地衣结皮相对盖度3% | 蒙古韭(Allium mongolicum ) 苦豆子(Sophora alopecuroides) 猪毛蒿(Artemisia scoparia) 甘草(Glycyrrhiza uralensis) | 53 |
| 样地3 | 5 | 生物结皮总盖度84%,藻结皮相对盖度39%,藓结皮相对盖度42%,地衣结皮相对盖度5% | 柠条(Caragana korshinskii) 冰草(Agropyron cristatum) 蒙古韭(Allium mongolicum) | 26 |
在每块样地内选取3类生物结皮的采样斑块,其中混生结皮采样斑块的选取标准为藻、藓结皮盖度各占50%左右。根据结皮发育的均匀程度设置小样方,样方大小不等,最小20 cm×30 cm(藓结皮),最大60 cm×120 cm(藻结皮),样地内各类型生物结皮样品采用随机布点法重复设置5个采样点。分层采集生物结皮的结皮层(0—2 cm)及结皮层下土壤0—5、5—10、10—20 cm土层土样。共采集60个样品(15个结皮层样品和45个结皮层下土壤样品),带回实验室风干。其中,留一部分生物结皮样品测定容重;剩余样品一部分过20目筛,用于测定土壤酶活性等指标,一部分过60目筛,用于测定土壤C、N、P等元素。
1.3 样品测定
参考关松荫[20]的测定方法,脲酶(Ure)活性采用苯酚钠-次氯酸钠比色法;蔗糖酶(Suc)采用3,5-二硝基水杨酸比色法;碱性磷酸酶(Alp)采用磷酸苯二钠比色法;过氧化氢酶(Cat)采用高锰酸钾滴定法。
1.4 数据分析
采用Excel 2010、SPSS 19.0进行数理统计分析,Origin 9.0作图。采用Levene's test进行方差齐性检验,用One-Way ANOVA进行单因素方差分析,最小显著性差异法(LSD)进行处理间的多重比较。图表中数据为平均值±标准差(n=5)。采用Canoco 5.0软件对生物结皮及下层土壤酶活性与土壤环境因子的相关性进行冗余分析,RDA排序过程中对数据进行了转换,转换公式为Y′=lg(Y+1)。
2 结果与分析
2.1 不同类型生物结皮及下层土壤理化性质
由表2可知,不同类型生物结皮层的AN、AP、AK含量明显高于下层土壤,pH和BD明显低于下层土壤。藓结皮的结皮层AN、AP、AK含量明显高于藻结皮和混生结皮,但藻结皮和混生结皮之间并无显著差异。藓结皮的结皮层pH、BD均低于藻结皮和混生结皮。将所选的3类生物结皮分别视作生物结皮演替的不同阶段,则土壤养分随生物结皮的演替呈持续增加趋势。生物结皮发育程度越高,对土壤理化性质影响越大。
表2 生物结皮结皮层及其下层土壤理化性质
Table 2
| 层次 /cm | 结皮类型 | 容重BD /(g·cm-3) | 含水率 SWC/% | 孔隙度 Por/% | pH值 | 碱解氮AN /(mg·kg-1) | 速效磷AP /(mg·kg-1) | 速效钾AK /(mg·kg-1) |
|---|---|---|---|---|---|---|---|---|
| 结皮层 | 藻结皮 | 1.12±0.03Aa | 5.20±0.48Aa | 54.79±1.07Aa | 8.07±0.01Aa | 668.74±51.75Aa | 14.74±1.89Aa | 117.76±2.76Aa |
| 混生结皮 | 1.11±0.09Aa | 4.20±0.66Aa | 58.16±3.32Aa | 8.21±0.15Aa | 809.89±50.90Aa | 15.29±2.97Aa | 137.18±3.14Aa | |
| 藓结皮 | 1.04±0.07Aa | 4.47±0.27Aa | 60.82±2.70Aa | 7.84±0.07Ab | 1096.98±63.74Ab | 26.14±2.61Ab | 202.32±18.5Ab | |
| 0—5 | 藻结皮 | 1.31±0.01Bab | 7.54±0.75Aa | 50.62±0.36Ba | 8.47±0.02Ba | 196.08±4.53Ba | 6.52±0.61Ba | 94.82±3.26Ba |
| 混生结皮 | 1.37±0.03Ba | 5.31±0.27Ab | 48.36±1.27Ba | 8.51±0.02Bab | 272.52±5.41Bb | 7.83±0.96Ba | 110.16±2.33Ba | |
| 藓结皮 | 1.23±0.05Bb | 5.52±0.27Ab | 53.71±2.03Bb | 8.60±0.04Bb | 316.11±20.02Bc | 10.41±0.69Bb | 135.02±8.72Bb | |
| 5—10 | 藻结皮 | 1.39±0.05Ba | 7.14±0.91Aa | 47.44±1.95Ba | 8.50±0.02Ba | 117.80±15.31Ba | 5.09±1.00BCa | 70.15±5.72Ca |
| 混生结皮 | 1.32±0.04Ba | 3.97±0.29Bb | 50.16±1.57Ba | 8.43±0.09Ba | 215.34±4.01Cb | 5.72±0.43BCa | 80.26±7.35Ca | |
| 藓结皮 | 1.31±0.04BCa | 4.28±0.29Bb | 50.44±1.42BCa | 8.80±0.07Bb | 245.38±23.25Bb | 6.65±0.26BCa | 124.34±3.57Bb | |
| 10—20 | 藻结皮 | 1.39±0.02Ba | 6.52±1.31Aa | 47.55±0.70Ba | 8.47±0.05Ba | 110.13±15.02Ba | 2.75±0.24Ca | 47.58±9.08Da |
| 混生结皮 | 1.43±0.04Ba | 4.71±0.36ABa | 46.09±1.40Ba | 8.51±0.13Ba | 212.8±25.20Cb | 2.03±0.09Ca | 52.00±4.42Da | |
| 藓结皮 | 1.39±0.01Ca | 4.34±0.23Ba | 47.45±0.31Ca | 8.89±0.10Cb | 178.27±5.20Cb | 2.55±0.38Ca | 75.74±2.12Cb |
不同大写字母表示同一类型生物结皮不同土层间差异显著(P<0.05),不同小写字母表示同一土层不同类型生物结皮间差异显著(P<0.05)。
2.2 不同类型生物结皮及下层土壤酶活性特征
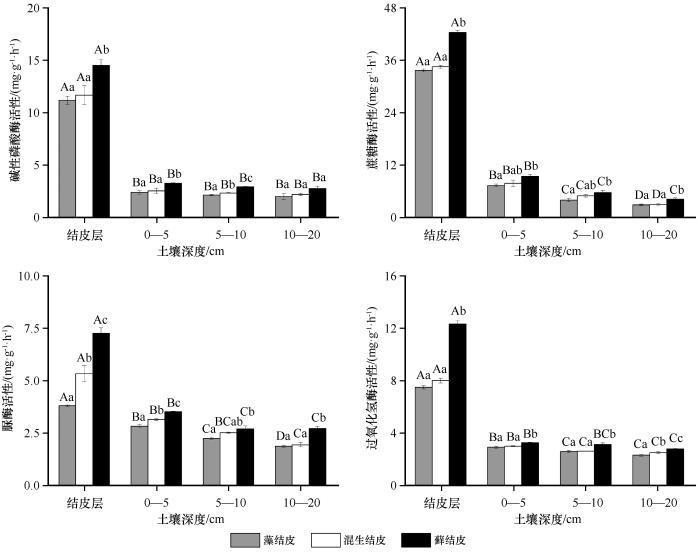
由图1可以看出,不同类型生物结皮及下层土壤的酶活性差异显著。在结皮层,3类生物结皮的碱性磷酸酶活性为11.20—14.54 mg·g-1·h-1,蔗糖酶活性为33.71—42.44 mg·g-1·h-1,脲酶活性为3.80—7.26 mg·g-1·h-1,过氧化氢酶活性为7.49—12.33 mg·g-1·h-1,均表现为藓结皮>混生结皮>藻结皮,藓结皮的碱性磷酸酶、蔗糖酶、过氧化氢酶活性与混生结皮和藻结皮具有显著差异(P<0.05),但后两者之间无显著差异。在0—5 cm和5—10 cm土层,藓结皮的4种酶活性均显著高于藻结皮。在10—20 cm土层,藓结皮的蔗糖酶、脲酶、过氧化氢酶活性显著高于藻结皮(P<0.05),3类生物结皮的碱性磷酸酶活性两两之间并无显著差异。
图1
图1
不同类型生物结皮及下层土壤酶活性特征
不同大写字母表示同一类型生物结皮不同土层间差异显著(P<0.05),不同小写字母表示同一土层不同类型生物结皮间差异显著(P<0.05)
Fig.1
Characteristics of soil enzyme activities at different biocrusts and subsoil
从土壤深度来看,3类生物结皮的结皮层的碱性磷酸酶、蔗糖酶、脲酶、过氧化氢酶活性显著高于其他土层(P<0.05),分别是其下层10—20 cm土层的5.6、5.3、5.3倍,11.8、11.7、10.1倍,2.0、2.8、2.7倍,3.3、3.2、4.5倍。这说明随着土层深度的增加,3类生物结皮下层土壤酶活性均呈递减的趋势。
2.3 不同类型生物结皮及下层土壤 C、N、P 含量及其化学计量特征
2.3.1 生物结皮及下层土壤 C、N、P 含量特征
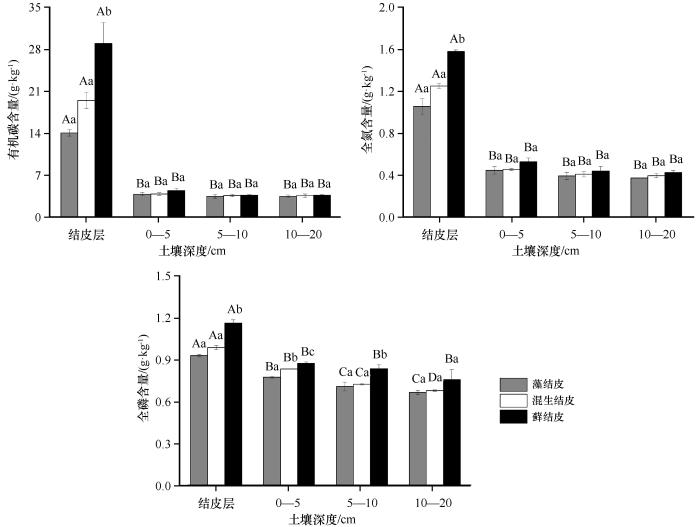
由图2可以看出,不同类型生物结皮及下层土壤的SOC和TN含量差异显著。在结皮层,3类生物结皮的SOC含量为14.06—28.97 g·kg-1,TN含量为1.06—1.58 g·kg-1,均表现为藓结皮>混生结皮>藻结皮;藓结皮与混生结皮、藻结皮具有显著差异(P<0.05),但后两者之间无显著差异。从土壤深度来看,在0—5、5—10 cm和10—20 cm土层,SOC和TN含量变化均表现为藓结皮高于混生结皮和藻结皮,但3类生物结皮处理之间无显著差异。3类生物结皮的结皮层SOC和TN含量显著高于下层土壤(P<0.05)。其中,SOC含量分别是0—5 cm土层的3.7、5.0、6.5倍,5—10 cm土层的4.0、5.4、7.9倍,10—20 cm土层的4.0、5.5、7.9倍,TN含量分别是0—5 cm土层的2.3、2.7、3.0倍,5—10 cm土层的2.7、3.1、3.6倍,10—20 cm土层的2.8、3.2、3.7倍。不同类型生物结皮SOC和TN含量均随着土层加深而降低,表明生物结皮对土壤SOC和TN含量影响有限。
图2
图2
不同类型生物结皮及下层土壤C、N、P含量特征
不同大写字母表示同一类型生物结皮不同土层间差异显著(P<0.05),不同小写字母表示同一土层不同类型生物结皮间差异显著(P<0.05)
Fig.2
Characteristics of soil C,N,P contents at different biocrusts and subsoil
不同类型生物结皮及下层土壤的TP含量差异显著。在结皮层,3类生物结皮的TP含量为0.93—1.16 g·kg-1,表现为藓结皮>混生结皮>藻结皮;藓结皮与混生结皮、藻结皮具有显著差异(P<0.05),但后两者之间无显著差异;从土壤深度来看,在0—5 cm土层,3类生物结皮的TP含量之间差异均显著(P<0.05)。在5—10 cm和10—20 cm土层,TP含量表现为藓结皮显著高于混生结皮和藻结皮(P<0.05)。3类生物结皮的结皮层TP含量显著高于其他土层(P<0.05),分别是0—5 cm土层的1.20、1.18、1.33倍,5—10 cm土层的1.31、1.36、1.39倍,10—20 cm土层的1.40、1.45、1.54倍。藻结皮和混生结皮0—5 cm土层的TP含量显著高于5—10 cm和10—20 cm土层(P<0.05)。
2.3.2 生物结皮及下层土壤C、N、P生态化学计量特征
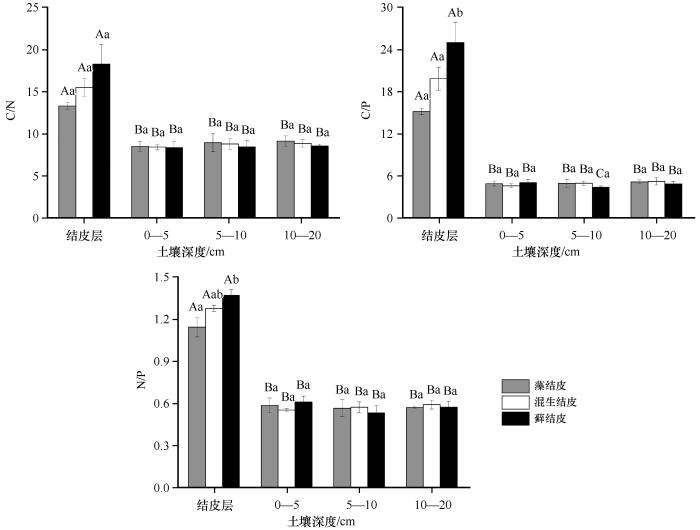
由图3可以看出,不同类型生物结皮及下层土壤的C/N存在显著差异。在结皮层,3类生物结皮的结皮层C/N为13.36—18.34,表现为藓结皮>混生结皮>藻结皮,藓结皮C/N是藻结皮的1.37倍。结皮层下0—5、5—10、10—20 cm土层C/N均表现为藓结皮<混生结皮<藻结皮,3类生物结皮之间无显著差异。从土壤深度来看,3类生物结皮的结皮层C/N显著高于下层土壤(P<0.05),分别是0—5 cm土层的1.56、1.83、2.18倍,5—10 cm土层的1.48、1.76、2.16倍,10—20 cm土层的1.45、1.75、2.13倍。
图3
图3
不同类型生物结皮及下层土壤C、N、P化学计量特征
不同大写字母表示同一类型生物结皮不同土层间差异显著(P<0.05),不同小写字母表示同一土层不同类型生物结皮间差异显著(P<0.05)
Fig.3
Characteristics of soil C∶N∶P stoichiometry of different biocrusts and subsoil
不同类型生物结皮及下层土壤的C/P差异显著。在结皮层,3类生物结皮的C/P为15.17—25.00,表现为藓结皮>混生结皮>藻结皮,藓结皮C/P是藻结皮的1.65倍,藓结皮与混生结皮、藻结皮具有显著差异(P<0.05),但后两者之间无显著差异。从土壤深度来看,0—5、5—10、10—20 cm土层C/P两两之间差异均不显著。3类生物结皮的结皮层C/P显著高于下层土壤(P<0.05),分别是其下层0—5 cm土层的3.06、4.26、4.92倍,5—10 cm土层的3.04、3.97、5.65倍,10—20 cm土层的2.92、3.76、5.10倍。
不同类型生物结皮及下层土壤的N/P差异显著。在结皮层,3类生物结皮的N/P为1.14—1.37,表现为藓结皮>混生结皮>藻结皮,藓结皮N/P是藻结皮的1.2倍。从土壤深度来看,0—5、5—10、10—20 cm土层N/P两两之间差异均不显著。3类生物结皮的结皮层N/P显著高于下层土壤(P<0.05),分别是0—5 cm土层的1.96、2.32、2.25倍,5—10 cm土层的2.03、2.24、2.58倍,10—20 cm土层的2.01、2.17、2.40倍。
由表3可以看出,生物结皮类型显著影响结皮层及下层土壤的酶活性和SOC、TN、TP含量,而对SOC、N、P化学计量比影响不显著。土壤深度显著影响表中所有的环境因子(P<0.01)。两者的交互作用对酶活性影响显著,对TP、C/N和N/P影响不显著。
表3 不同类型生物结皮及不同层次土壤酶活性和C、N、P及其化学计量特征的方差分析结果
Table 3
| 指标 | 结皮类型 | 土壤深度 | 结皮类型×土壤深度 | |||||
|---|---|---|---|---|---|---|---|---|
| F | P | F | P | F | P | |||
| 过氧化氢酶Cat | 227.942 | <0.01 | 2538.858 | <0.01 | 117.118 | <0.01 | ||
| 蔗糖酶Suc | 81.692 | <0.01 | 4499.391 | <0.01 | 23.655 | <0.01 | ||
| 碱性磷酸酶Alp | 17.992 | <0.01 | 569.821 | <0.01 | 3.668 | <0.05 | ||
| 脲酶Ure | 82.408 | <0.01 | 291.958 | <0.01 | 22.095 | <0.01 | ||
| 有机碳SOC | 12.788 | <0.01 | 172.720 | <0.01 | 10.721 | <0.01 | ||
| 全氮TN | 27.893 | <0.01 | 499.220 | <0.01 | 12.241 | <0.01 | ||
| 全磷TP | 31.087 | <0.01 | 91.853 | <0.01 | 2.013 | >0.05 | ||
| C/N | 1.017 | >0.05 | 42.7 | <0.01 | 2.109 | >0.05 | ||
| C/P | 4.904 | >0.05 | 161.733 | <0.01 | 6.066 | <0.01 | ||
| N/P | 1.557 | >0.05 | 187.064 | <0.01 | 1.968 | >0.05 | ||
结皮类型×土壤深度:结皮类型和土壤深度的交互作用; P值表示显著相关(P<0.05)。
2.4 环境因子对不同类型生物结皮及下层土壤酶活性的影响
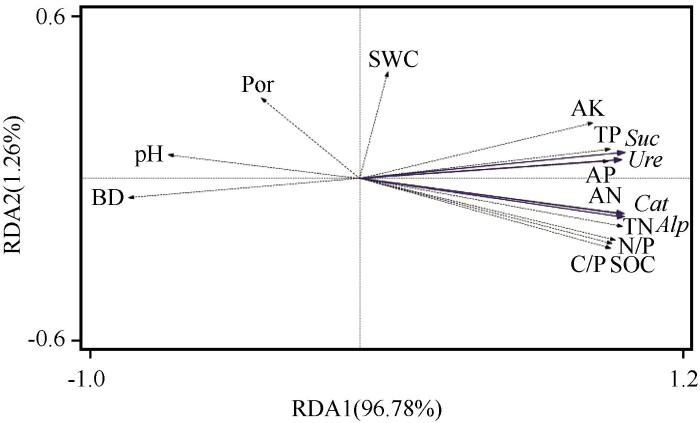
对环境因子与生物结皮及下层土壤的酶活性进行相关分析(表4),4种酶活性和SOC、TN、TP均呈极显著正相关关系,相关性系数较高;和C/N、C/P 、N/P呈极显著或显著正相关关系,但相关性系数较低。对生物结皮及下层土壤酶活性与环境因子的冗余分析(RDA)结果表明:第Ⅰ、Ⅱ排序轴特征值分别为96.78%和1.26%,即前两排序轴累计解释了酶活性特征的98.04%(图4),说明前两轴已能很好反映结皮层及下土层酶活性与土壤因子的关系。根据环境因子箭头的长度可知影响4种酶活性的主要因子是SOC、TN、TP、C/N、N/P、AN、BD。根据酶活性和环境因子的夹角可知碱性磷酸酶、过氧化氢酶活性与SOC、TN、AN、C/P、N/P呈正相关关系,与pH、BD呈负相关关系;脲酶和蔗糖酶活性与AK、TP、AP呈正相关关系,与pH、BD呈负相关关系。
表4 生物结皮及下层土壤生态化学计量特征和酶活性的相关性
Table 4
| 指标 | Cat | Suc | Alp | Ure | SOC | TN | TP | C/N | C/P | N/P |
|---|---|---|---|---|---|---|---|---|---|---|
| 过氧化氢酶Cat | 1 | 0.929** | 0.878** | 0.938** | 0.713** | 0.885** | 0.913** | 0.413* | 0.447** | 0.600** |
| 蔗糖酶Suc | 1 | 0.821** | 0.949** | 0.738** | 0.873** | 0.881** | 0.465** | 0.498** | 0.588** | |
| 碱性磷酸酶Alp | 1 | 0.854** | 0.703** | 0.791** | 0.842** | 0.480** | 0.511** | 0.587** | ||
| 脲酶Ure | 1 | 0.739** | 0.853** | 0.898** | 0.517** | 0.492** | 0.551** | |||
| 有机碳SOC | 1 | 0.829** | 0.690** | 0.728** | 0.846** | 0.743** | ||||
| 全氮TN | 1 | 0.811** | 0.387* | 0.603** | 0.814** | |||||
| 全磷TP | 1 | 0.498** | 0.365* | 0.441** | ||||||
| C/N | 1 | 0.789** | 0.422* | |||||||
| C/P | 1 | 0.820** | ||||||||
| N/P | 1 |
*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。
图4
图4
生物结皮及下层土壤酶活性与环境因子之间的冗余分析
SOC、N、P、C∶N、C∶P 和N∶P 分别代表有机碳、全氮、全磷含量及其计量比;AN、AP、AK、SWC、BD、Por、pH分别代表碱解氮、速效磷、速效钾、含水量、容重、孔隙度、pH值;Suc 、Ure 、Alp和Cat分别代表蔗糖酶、脲酶、碱性磷酸酶和过氧化氢酶活性
Fig.4
Redundancy analysis of enzyme activities and environmental factors in biocrust and subsoil
相关性分析和RDA排序结果表明生物结皮及下层土壤SOC与TN,TP与C/N、C/P 、N/P等因子之间有显著相关关系,且都是酶活性的影响因子。为进一步判别结皮层及下层土壤理化性质中对酶活性产生影响的主要因素,通过冗余分析进一步提取出各因子对生物结皮及下层土壤酶活性变异的贡献率。结果表明,理化性质对生物结皮及下层土壤酶活性影响的重要性排序为TN>AK>SWC>TP>C/P>SOC>AN>pH>BD>AP>Por>N/P(表5)。其中,TN、TP 与AK对生物结皮及下层土壤酶活性的影响达到极显著水平(P<0.01),其解释量占所有土壤指标解释量的96.9%。而SWC和C/P对酶活性的影响达到显著水平(P<0.05),其解释量占所有土壤指标解释量的1.5%。这说明TN、TP、AK是影响生物结皮及下层土壤酶活性的主导因子。
表5 土壤环境指标作为解释变量的前向选择和蒙特卡罗检验分析
Table 5
| 参数 | 条件影响 | 多元相关 比率/% | F | P |
|---|---|---|---|---|
| 全氮TN | 0.921 | 93.6 | 293 | 0.002** |
| 速效钾AK | 0.026 | 2.6 | 11.9 | 0.002** |
| 含水量SWC | 0.009 | 0.9 | 4.9 | 0.030* |
| 全磷TP | 0.007 | 0.7 | 5.9 | 0.004** |
| C/P | 0.006 | 0.6 | 4.4 | 0.026* |
| 有机碳SOC | 0.005 | 0.5 | 2.9 | 0.056 |
| 碱解氮AN | 0.004 | 0.4 | 2.6 | 0.082 |
| pH | 0.002 | 0.2 | 1.6 | 0.224 |
| 容重BD | 0.001 | 0.1 | 0.8 | 0.438 |
| 速效磷AP | 0.001 | 0.1 | 1.1 | 0.378 |
| 孔隙度Por | 0.001 | 0.1 | 1.2 | 0.324 |
| N/P | 0.001 | 0.1 | 0.2 | 0.876 |
*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。
3 讨论
3.1 生物结皮演替对结皮及下层土壤酶活性的影响
土壤C、N是微生物养分的来源,当土壤中有可利用养分时,微生物生长较快[22],需分泌较多的酶以满足自身需求。土壤酶能够活化土壤中各类元素的化合物,进而提升土壤有效养分、改善土壤质量。土壤中的酶种类繁多,其活性可以反映土壤养分转化的强度,主要用于催化土壤中物质的化学反应和能量传递等。土壤中与C、N、P生物地球化学循环有关的土壤酶主要有过氧化氢酶、蔗糖酶、脲酶和磷酸酶等。其中,蔗糖酶、脲酶、磷酸酶活性分别表征土壤C、N、P的供应状况。本研究中,随着生物结皮的演替,结皮层的蔗糖酶、脲酶和磷酸酶活性因生物结皮类型不同均存在显著差异(图1),差异性分析表明脲酶活性受结皮类型影响的顺序为藓结皮>混生结皮>藻结皮。藓结皮层的C、N含量指标最高,相应地其蔗糖酶、脲酶和磷酸酶活性也最高。从酶活性的垂直分布来看,随着土层深度的增加,3类生物结皮的土壤酶活性均呈递减趋势,且集中分布于结皮层,说明土壤层次越深土壤酶活性受结皮影响越小。主要是由于结皮层相对丰富的养分含量为酶促反应提供较多的底物,从而提高了酶活性[23]。
3.2 不同类型生物结皮及下层土壤C、N、P含量及其化学计量特征
生物结皮的演替可引起土壤化学计量特征发生变化。演替过程中,植被对土壤养分的归还处于动态变化[24],且土壤理化性质和微生物活性均会在演替过程中发生显著改变。Dümig等[25]发现由藻结皮演替到藓结皮,结皮层有机碳含量增加了1.8倍;Liu等[26]发现随着生物结皮的演替,土壤微生物丰度和多样性呈逐渐增加趋势。通常生长较快的组分会具有高的N/C和P/C比以及较低的N/P[27]。本研究中证实了这个观点,处于演替初级阶段的藻结皮有较高的C/N和C/P比和较低的N/P比值,而藓结皮土壤C/N降低,促进了微生物对SOC的分解与循环。本研究中,随着生物结皮的演替,在结皮层,3类生物结皮的SOC、TN、TP含量均显著高于下层土壤,且类型间差异显著,表现为藓结皮>混生结皮>藻结皮(图2)。这主要是由于藓结皮的生物量、凋落物、微生物组成和固C能力显著高于藻结皮[28]。
生物结皮固N的主要途径是通过俘获干旱环境中的富营养颗粒。本研究表明,不同类型生物结皮对土壤养分的富集程度不同。随着生物结皮的演替,结皮层的TN含量显著增加,其中,以藓结皮的TN含量增加最显著。这与沙坡头人工固沙植被区研究结果一致[31]。通过土壤C、N、P化学计量特征判别营养元素限制状况,可为维持生物多样性与生态系统平衡的措施选择提供理论依据。N/P作为判断限制生产力的养分因子指标,将N/P小于10或大于20作为评价植被生产力受N或者P限制的指标[32]。研究区3类生物结皮及其下层土壤N/P 均小于10,且N/P均低于中国温带荒漠土壤平均值(1.2)[33],说明研究区土壤受N限制。本研究中,生物结皮下层土壤C/N均值显著低于全球平均水平(12.26)[34],表明研究区土壤相对于全球土壤平均水平土壤碳源、有机质分解和矿化速率均较低。本研究对3类生物结皮的结皮层C/N、C/P、N/P与其下层土壤C/N、C/P、N/P比值进行参比,结果表明,3类生物结皮均能促进SOC的积累,且均表现为藓结皮SOC累积量最大。但结皮层和下层土壤C/P、N/P参比结果显示:3类结皮均能积累较多的SOC,而P元素则积累较少,其中藓结皮有着较高的C/P、N/P,间接说明了藓结皮下层土壤P的有效性最低,且其处于P限制状态。
3.3 不同类型生物结皮及下层土壤酶活性及其与C、N、P化学计量特征的关系
土壤酶主要来源于土壤微生物、植物根系分泌及植物降解的产物。随着土壤养分输入增加,微生物活性也随之增加[35]。本研究发现,随着生物结皮的演替,结皮层的C、N、P含量及C/N、N/P均显著增加(表2和图3),这和陶冶等[36]在古尔班通古特沙漠的研究相一致。这主要与演替过程中生物结皮内生物组分(微生物、藻类、地衣和苔藓)的数量和活性有关[37]。微生物参与控制C∶N∶P的平衡关系以及在植物、凋落物和土壤之间相互转换[38]。土壤C、N、P等养分因子作为各类酶的重要底物,其含量的多少与酶活性显著相关[39]。当受到严重N限制时,微生物很可能在N限制解除之前一直处于休眠状态[40]。土壤磷酸酶活性与土壤P的有效性呈反比[41]。本研究表明,生物结皮的演替促进了SOC和TN含量的增加,而相关性分析和RDA分析结果显示SOC和TN含量是结皮层和下层土壤酶活性增加的主要因素,且SOC和TN含量与脲酶、过氧化氢酶、蔗糖酶、碱性磷酸酶活性呈显著或极显著相关性。不同生物结皮的凋落物及其分泌物的特性不同,会影响微生物群落结构、功能及其多样性,而微生物的数量和组成的变化,又会引起酶活性在质和量上的差异[42]。本研究中,C/N、C/P、N/P随生物结皮的演替呈增加趋势,而相关性分析表明C/N、C/P、N/P与碱性磷酸酶、蔗糖酶、脲酶、过氧化氢酶活性酶活性显著相关,说明生物结皮层及下层土壤的酶活性随土壤和植物组织养分化学计量比的改变而改变。这和叶协锋等[43]的研究结论一致。
3.4 不同类型生物结皮及下层土壤酶活性及其与理化性质的关系
在植被与土壤协同进化过程中,调控物质循环的土壤酶活性会受到相应的土壤养分状况影响[45]。土壤C、N、P作为生物结皮C、N、P养分元素的来源,是土壤微生物C、N的主要来源,与土壤酶活性密切相关。由于处于不同演替阶段各类生物结皮固定C、N的能力不同,相应地其酶活性不同,进而使化学计量学特征发生分异。本研究中,随着生物结皮的演替,群落结构组成及多样性的变化会促进结皮层及下层土壤理化性质的改善和酶活性的提升。具体表现为:处于演替初期的藻结皮的SOC、TN含量和酶活性最低,而藓结皮则最高。这基本符合沙区生物结皮演替过程中养分的变化趋势。
生物结皮及下层土壤的理化性质与酶活性之间存在着密切的相关关系。土壤脲酶活性能体现土壤的供氮水平,且与SOC含量密切相关。已有研究表明,土壤酶在SOM转化过程中,既有专性特性,也有共性关系[46]。本研究中,SOC和TN含量与脲酶、过氧化氢酶、蔗糖酶、碱性磷酸酶呈正相关关系,说明SOC和TN含量是影响这4种酶活性的主要因子(图4);如过氧化氢酶可通过改变土壤的通气透水性来影响土壤容重和质量含水量。脲酶、过氧化氢酶是影响TN、AN、TP、pH和AK的关键因子[47]。本研究中,相关性和RDA分析结果表明,4种酶活性与pH、BD呈负相关,而与养分TN、AK、TP均呈显著正相关,这和吴丽芳等[13]的研究结果相似。
4 结论
随着生物结皮的发育演替,结皮层养分含量增加,促进了酶活性,表现为处于藓结皮阶段的酶活性更高。随着土层深度的增加,3类生物结皮的酶活性呈递减趋势。同时,4种酶活性间也存在显著的正相关关系(P<0.01)。3类生物结皮的结皮层C、N、P含量均高于下层土壤,其中SOC与TN的变化具有一致性,均随着土层的加深而减小。此外,3类生物结皮的结皮层C/N、C/P、N/P 均表现为结皮层显著高于下层土壤(P<0.01)。其中,藓结皮C/N最低,促进了微生物对SOM的分解与循环。在从藻结皮向藓结皮演替过程中,生物结皮的组成发生了明显变化,理化性质得以改善,酶活性增加显著。生物结皮及下层土壤的酶活性与环境因子的相关性和冗余分析结果显示:生物结皮及下层土壤的pH、BD是制约酶活性的主要影响因子,而TN、AK、TP是驱动酶活性的主要土壤因子。
参考文献
C∶N∶P stoichiometry in China's forests:from organs to ecosystems
[J].
The elemental stoichiometry of aquatic and terrestrial ecosystems and its relationships with organismic lifestyle and ecosystem structure and function:a review and perspectives
[J].
A global atlas of the dominant bacteria found in soil
[J].
Soil enzyme activity and stoichiometry in forest ecosystems along the North-South Transect in eastern China (NSTEC)
[J].
Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semiarid tropical regions
[J].
Ecoenzymatic stoichiometry of microbial nutrient acquisition in tropical soils
[J].
Contribution of cryptogamic covers to the global cycles of carbon and nitrogen
[J].
Differential responses of soil microbial biomass and carbon-degrading enzyme activities to altered precipitation
[J].
Organic matter from biological soil crusts induces the initial formation of sandy temperature soils
[J].
Changes in functional gene structure and metabolic potential of the microbial community in biological soil crusts along a revegetation chronosequence in the Tengger Desert
[J].
Carbon fixation by biological soil crusts following revegetation of sand dunes in arid desert regions of China:a four-year field study
[J].
Biological and microbial activity in biological soil crusts from the Tabernas desert,a sub-arid zone in SE Spain
[J].
The response mechanisms of soil N mineralization under biological soil crusts to temperature and moisture in temperate desert regions
[J].
N∶P ratios in terrestrial plants:variation and functional significance
[J].
Pattern and variation of C∶N∶P ratios in China’s soils:a synthesis of observational data
[J].
C∶N∶P stoichiometry in soil:is there a “Redfield ratio” for the microbial biomass?
[J].
Substrate quality and soil environmental conditions predict litter decomposition and drive soil nutrient dynamics following afforestation on the Loess Plateau of China
[J].
Response of microbial diversity to C:N:P stoichiometry in fine root and microbial biomass following afforestation
[J].
Changes in enzyme activities and soil microbial community composition along carbon and nutrient gradients at the Franz Josef chronosequence,New Zealand
[J].
Exotic plant species alter the microbial community structure and function in the soil
[J].
Linkages between extra-cellular enzyme activities and the carbon and nitrogen content of grassland soils
[J].




 甘公网安备 62010202000688号
甘公网安备 62010202000688号