0 引言
陆地生态系统中,土壤微生物与植物群落的联系十分紧密。一方面,土壤微生物除了可以作为根际微生物或菌根直接参与植物生命活动外,还可作为游离微生物广泛参与土壤中的生物化学过程[1-2],包括通过营养元素的周转,调节养分的供应,影响植物的生长、资源分配和化学组成等[3]。另一方面,植物不仅通过其凋落物和分泌物为土壤微生物提供营养,而且可通过影响冠幅下的微生境来间接影响土壤微生物的群落结构与分布[4]。植被的种类[5]、多样性[6]、生理特征[7-8]、地上生物量[9]及与植被距离[10]等因素的变化都会对土壤微生物状况产生影响。在荒漠生态系统中,以旱生灌木为代表的植物群落与以土壤细菌为主[11]的土壤微生物间的密切联系则具有更为重要的生态意义。荒漠环境严酷,生态系统稳定性差且难以恢复[12-13]。然而,旱生灌木不仅对维持荒漠生态系统的稳定性具有重要作用[14],且由于荒漠土壤中土壤动物和真菌的数量稀少,植物对土壤细菌的影响在荒漠陆地生态系统中也更加突出[15]。与此同时,由于高等植物和动物的数量有限,土壤微生物群落被认为是荒漠生态系统中最具生产力的组成部分[16]。此外,土壤微生物对于环境变化十分敏感,能较早地反映土壤质量的变化过程,是评价土壤变化的重要指示因子[17-18]。因此,对荒漠区不同植物群落下土壤细菌群落特征的研究不仅能够加深对于当地土壤环境状况的了解,而且可以为植被生态功能的评价以及植物群落的保育与恢复提供理论依据。
阿拉善高原处于内蒙古自治区西侧,是草原向荒漠的过渡带[19]。区内特有种、残遗种和其他珍稀濒危植物多达72种,具有十分重要的保护价值[20]。诸如红砂(Reaumuria soongarica)、绵刺(Potaninia mongolica)、沙冬青(Ammopiptanthus mongolicus)、霸王(Zygophyllum xanthoxylum)及白刺(Nitraria tangutorum)等荒漠灌木是当地重要的建群种,不仅具有抗旱、耐盐碱等特殊的生理机制,且具有防风固沙等重要生态价值[21]。目前,关于这些植被的生理特性、环境适应机制、对土壤性质的影响及空间分布状况等方面的研究已取得较多成果[22-28]。然而对于其下土壤微生物状况及差异状况的研究尚少,且主要涉及可培养微生物或微生物的碳源利用以及磷脂脂肪酸构成等方面[29-31]。对灌木下土壤细菌的群落结构的系统发育及其差异缺乏具体深入的了解。特别是对于生长在同一区域,但具有不同生存策略的旱生灌木下不同深度的土壤细菌存在何种差异、以及灌木的生理形态与生存策略如何影响土壤细菌群落,尚缺乏认识。为此,我们以阿拉善荒漠区中部的上述5种荒漠灌木为研究对象,采用16S rDNA高通量测序技术,调查其冠幅下方土壤细菌群落构成及多样性状况,比较灌木类型与土层间的差异,并开展环境影响因素研究。这有助于增加对于不同种群下土壤细菌的差异状况以及荒漠灌木-土壤细菌之间关系的理解,并为相关灌木群落的保护与恢复及微生物资源的开发利用提供直接依据。
1 研究区域、材料与方法
1.1 研究区域与样品采集
研究区位于阿拉善高原中部巴彦诺日公以北(40.17°N、104.80°E,海拔1 278 m)。该地区位于巴丹吉林沙漠、腾格里沙漠及亚玛雷克沙漠之间,为典型荒漠区与草原化荒漠区的过渡带。气候上,该地区属于中温带草原化荒漠区,年≥10 ℃积温2 800—3 100 ℃,干燥度3.5—4.5,年降水量104.1 mm,且近70%集中在夏季[32]。该地区土壤类型为灰漠土,质地多为沙壤。区内植被以红砂、白刺、绵刺、沙冬青、霸王等旱生灌木和小灌木为主,并有少量油蒿(Artemisia ordosica)、沙米(Agriophyllum squarrosum)及骆驼蓬(Peganum harmala)等半灌木或草本植物,多为斑块状分布,灌木盖度为18%—39%。
样品采集于2017年8月下旬,采样前48 h内没有显著降水。在研究区内挑选生长良好的红砂、绵刺、沙冬青、霸王及白刺灌丛各3丛,灌丛冠幅、高度等信息见表1。灌丛间距离在1 m以上。在每个灌丛下方,距灌木主干15 cm左右分别取表层(0—10 cm)和次表层(10—20 cm)土壤。部分土样装入铝盒并称重用于测定土壤质量含水量。每种灌木的每层土样混合后作为一份样品(每份约1 500 g,共10份),装入灭菌自封袋后放入4 ℃冰盒中带回。每份土样过筛并去除枯枝和砾石后,分为3份,分别进行-80 ℃冰箱和4 ℃冰箱保存以及风干处理,用于DNA提取和测序、微生物量测定和土壤理化性状测定。
表1 采样灌木的形态学指标
Table 1
| 植物 | 高度 /m | 地径 /cm | 冠幅(长轴) /m | 冠幅(短轴) /m |
|---|---|---|---|---|
| 红砂 | 0.13±0.01 | 0.52±0.10 | 0.27±0.02 | 0.21±0.02 |
| 沙冬青 | 0.52±0.09 | 0.65±0.11 | 0.69±0.18 | 0.63±0.17 |
| 绵刺 | 0.25±0.01 | 0.92±0.13 | 0.58±0.18 | 0.50±0.19 |
| 霸王 | 0.40±0.03 | 1.43±0.61 | 1.13±0.31 | 0.87±0.14 |
| 白刺 | 0.33±0.02 | 0.90±0.18 | 2.23±1.01 | 1.23±0.24 |
1.2 土壤DNA提取与测序
该流程在诺禾致源(Novogene)基因组测序公司(北京)进行,DNA提取采用了CTAB/SDS提取方法[33]。每个样本中分别提取DNA三次,作为生物学重复,且每个重复分别用于测序和文库制备。DNA扩增使用的对应于细菌的16S V3-V4区域的引物对为341F(5’-CCTAYGGGRBGCASCAG-3’)和806R(5’-GGACTACNNGGGTATCTAAT-3’)[34]。聚合酶链反应(PCR)体系(30 µL)为:带有GC缓冲液的(2×)Phusion®高保真PCR Master Mix(15 µL,New England Biolabs,美国),2 µM前引物(1.5 µL),2 µM后引物(1.5 µL),1 ng·µL-1模板DNA (10 µL),无菌水(2 µL)。PCR反应步骤如下:98 ℃下预变性1 min;98 ℃ 变性10 s,50 ℃下退火30 s,72 ℃下延伸30 s (以上循环重复30次);72 ℃下5 min。随后对PCR产物在2%琼脂糖凝胶中进行电泳分离并切胶回收目标DNA。PCR产物使用GeneJETTM凝胶提取试剂盒(Thermo Fisher Scientific,美国)进行纯化。
1.3 土壤微生物量与理化性状等测定
1.4 数据分析
测序数据在诺禾致源公司进行分析。将相似度≥97%的序列分配到同一个操作分类单元(OTU)。使用SILVA数据库(v132)并基于mothur算法对分类信息进行物种注释。Beta多样性的分析基于兼顾了OTU丰度数据的加权UniFrac距离值[40]。采用4种常见的Alpha多样性指数:Chao1,Shannon (H'),Simpson (D)及PD whole tree指数(表征群落内亲缘关系)比较组间细菌多样性差异。采用非度量多维标度(nonmetric multidimensional scaling,NMDS)和分子方差分析(analysis of molecular variance,AMOVA)评估组间细菌群落差异程度和显著性。利用线性判别分析 (Linear discriminant analysis Effect Size,LEfSe,阈值设置为≥4)来识别分组间的生物标记物。基于测序结果,使用原核生物类群数据库(Functional Annotation of Prokaryotic Taxa,FAPROTAX)进行功能注释。最后,使用Mantel检验与典型相关分析(canonical correlation analysis,CCA)计算并反映环境因子与土壤细菌群落之间的关系。
2 结果分析
2.1 物种注释结果及组间土壤细菌群落差异特征
全部30个样本共获得6 676个OUT,共注释出468属189科96目36纲35门(其中10个暂定门)。主要优势菌门为放线菌门(39.22%)和变形菌门(29.20%)。此外,拟杆菌门(Bacteroidetes,8.35%)、绿弯菌门(Chloroflexi,8.01%)、酸杆菌门(Acidobacteria,5.94%)、芽单胞菌门(Gemmatimonadetes,2.79%)、厚壁菌门(Firmicutes,1.04%)的平均相对丰度也超过1%,这7个菌门共占总丰度的94.56%。主要优势菌目为根瘤菌目(Rhizobiales,10.56%)和鞘脂单胞菌目(Sphingomonadales,7.18%)。主要优势菌属为鞘脂单胞菌属(Sphingomonas,4.98%)和微枝形杆菌属(Microvirga,3.03%)。
表2 灌木间土壤细菌群落结构分子方差分析(AMOVA)结果
Table 2
| 对比组 | F | P |
|---|---|---|
| 红砂-白刺 | 3.348 | <0.001 |
| 红砂-霸王 | 2.737 | <0.001 |
| 红砂-沙冬青 | 2.858 | 0.002 |
| 红砂-绵刺 | 2.328 | 0.021 |
| 绵刺-白刺 | 1.859 | 0.076 |
| 绵刺-霸王 | 1.578 | 0.084 |
| 绵刺-沙冬青 | 1.488 | 0.098 |
| 沙冬青-霸王 | 1.239 | 0.173 |
| 沙冬青-白刺 | 1.281 | 0.154 |
| 霸王-白刺 | 1.680 | 0.055 |
| (0—10 cm)-(10—20 cm) | 30.278 | <0.001 |
| 全部 | 1.969 | <0.001 |
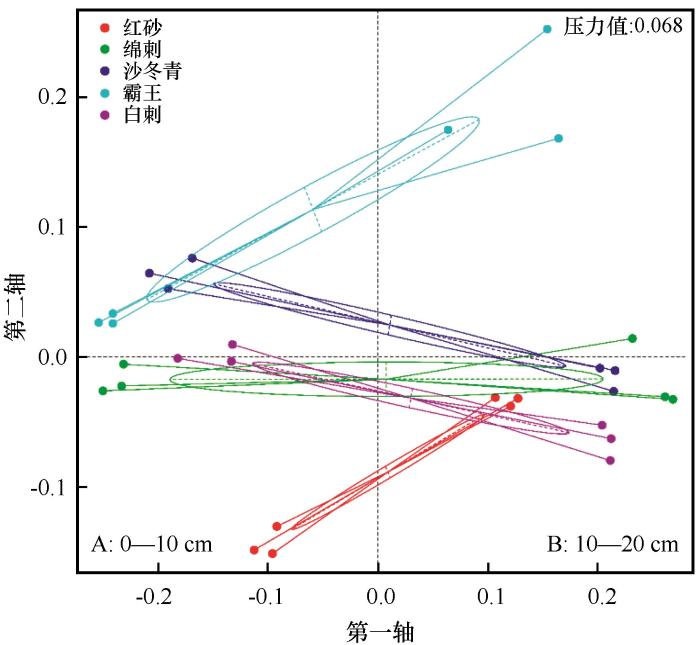
图1
图1
非度量多维标度(NMDS)分析结果
组间样点间距离越远反映细菌群落结构差异越大
Fig.1
The result of nonmetric multidimensional scaling analysis
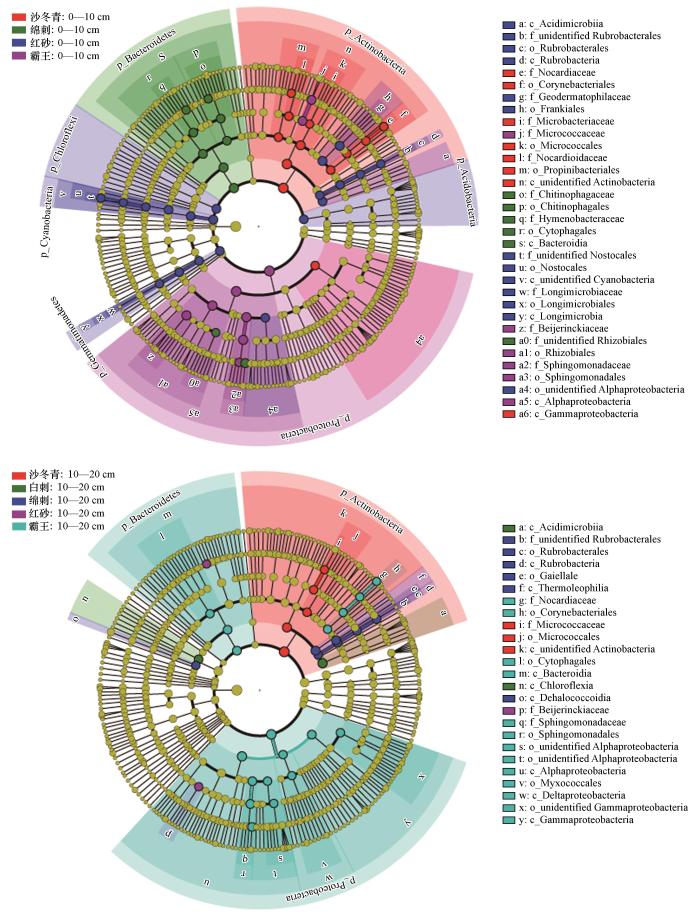
组间的群落结构差异LEfSe分析结果见图2。在表层,红砂灌丛下土壤具有最多且最广泛的生物标志物,其在绿弯菌门、酸杆菌门、长微菌科(Longimicrobiaceae,芽单胞菌门)、Microcoleus sp
图2
图2
表层(上)与次表层(下)灌木间土壤细菌群落结构的线性判别分析(LEfSe)结果,所标出的生物标志物表明其丰度在灌木间的差异具有统计显著性(LDA≥4)
Fig.2
The result of Linear discriminant analysis Effect Size (LEfSe) of soil bacterial community structure among shrubs in surface layer (A, upper) and subsurface layer (B, lower), the biomarkers indicates that the difference of their abundance among shrubs was statistically significant (LDA≥4)
对于次表层,则所有植被的生物标志物均与表层不一致。具体来说,霸王灌丛下土壤具有最多的生物标志物,且依旧主要分布在变形菌门,例如α-变形菌纲(Alphaproteobacteria)的鞘氨醇单胞菌属、δ-变形菌纲(Deltaproteobacteria)的粘球菌目(Myxococcales),但也涉及拟杆菌门和放线菌门。沙冬青灌丛下土壤细菌在放线菌门及其所属的节杆菌属的丰度上具有优势。绵刺灌丛下土壤的生物标志物主要为变形菌门的盖勒氏菌目(Gaiellales)和红色杆菌属(Rubrobacter)。红砂灌丛下土壤具有更高的Segetibacter属(拟杆菌门)和拜叶林克氏菌科(Beijerinckiaceae,变形菌门)丰度。白刺灌丛下土壤的生物标志物依旧较少,仅包括绿弯菌纲(Chloroflexia,绿弯菌门)和酸微菌纲(Acidimicrobiia,放线菌门)。
2.2 组间土壤细菌多样性差异及功能群特征
总体上,次表层土壤细菌多样性更高(表3)。在不同灌丛土壤间,4个指数反映出同样的规律。红砂灌丛下土壤细菌多样性最高,其次分别是绵刺、沙冬青和白刺,霸王最低。综合灌木种类和土层来看,红砂次表层的土壤细菌群落具有最高的物种丰度度(Chao 1指数)和最远的物种系统发育距离(PD whole tree指数),但均匀度(Shannon和Sinpson指数)最高的则为绵刺次表层。对于霸王灌丛下土壤来说,其不仅具有最低的多样性,且在丰富度和系统发育距离上表现为次表层低于表层,这与其他灌丛下的土层差异特征不同。
表3 不同灌木及土层间Alpha多样性
Table 3
| 土层 | 植物 | Chao1指数 | Shannon指数 | Simpson指数 | PD whole tree指数 |
|---|---|---|---|---|---|
| 0—10 cm | 红砂 | 2009.12±87.04ab | 8.68±0.05c | 0.9927±0.0004c | 127.15±1.98b |
| 绵刺 | 1768.74±62.49b | 8.45±0.11cd | 0.9895±0.0012d | 121.00±2.08b | |
| 沙冬青 | 1514.74±370.49bc | 8.39±0.36b | 0.9899±0.0021d | 113.68±23.49b | |
| 霸王 | 1765.50±190.19b | 8.19±0.08de | 0.9877±0.0011d | 127.57±15.16b | |
| 白刺 | 1538.73±303.53bc | 8.54±0.15e | 0.9906±0.0008cd | 110.63±14.21b | |
| 10—20 cm | 红砂 | 2201.70±291.70a | 9.10±0.03b | 0.9932±0.0006bc | 147.80±5.92a |
| 绵刺 | 2138.18±143.00a | 9.25±0.10a | 0.9962±0.0003a | 142.81±5.46a | |
| 沙冬青 | 1837.21±46.73b | 9.08±0.03b | 0.9951±0.0004ab | 130.48±3.82ab | |
| 霸王 | 1275.719±348.13c | 8.69±0.44ab | 0.9942±0.0002b | 104.78±22.00b | |
| 白刺 | 1781.79±103.30b | 8.75±0.05cd | 0.9936±0.0004b | 129.81±6.54ab | |
| 0—20 cm | 红砂 | 2105.39±219.52a | 8.89±0.23a | 0.9929±0.0006a | 137.47±11.97a |
| 绵刺 | 1953.46±225.14a | 8.85±0.45a | 0.9928±0.0037a | 131.91±12.51ab | |
| 沙冬青 | 1675.97±294.90b | 8.73±0.44ab | 0.9925±0.0031a | 122.08±17.64ab | |
| 霸王 | 1520.61±367.31b | 8.44±0.40b | 0.9910±0.0038a | 116.18±21.01b | |
| 白刺 | 1660.26±242.58b | 8.64±0.15ab | 0.9921±0.0017a | 120.22±14.43ab | |
| 10 cm | 1719.37±272.96a | 8.45±0.23b | 0.9901±0.0020b | 120.01±13.87b | |
| 20 cm | 1846.91±387.58a | 8.97±0.28a | 0.9945±0.0013a | 131.13±18.02a |
小写字母为组间Wilcoxon秩和检验结果,相同字母表示组间差异不显著。
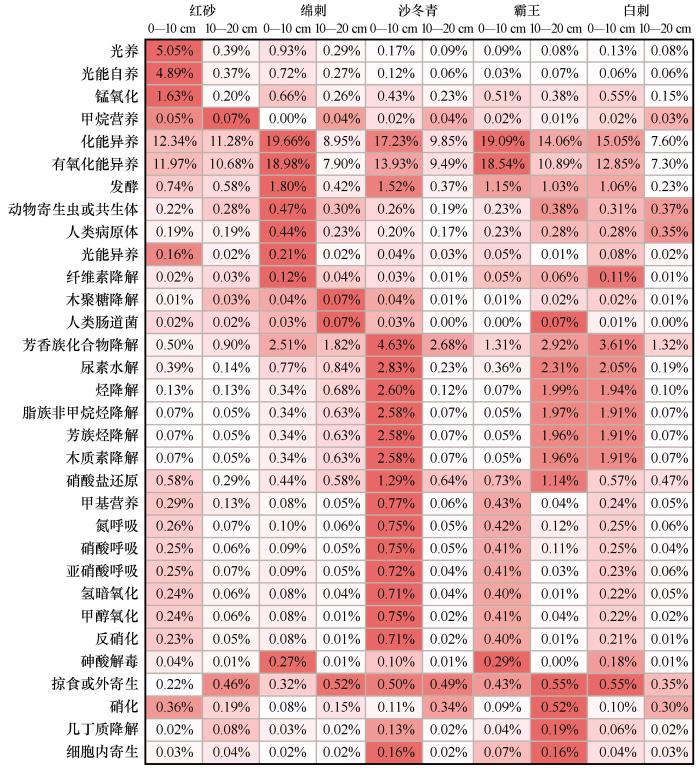
在土壤细菌群落功能的特征方面(图3),沙冬青表层在多种功能的细菌丰度上高于其他分组,主要包括芳香烃降解菌以及多种涉及氮循环的细菌;绵刺表层表现为异养菌丰度更高;红砂表层的光养菌丰度更高;霸王次表层外寄生或细胞内寄生菌的丰度最高,这可能是其细菌多样性较低的原因。此外,霸王灌丛下次表层土壤在烃类降解菌方面的丰度高于其他灌丛的次表层,这符合霸王灌丛下土壤在次表层较为特殊的细菌群落结构的特征。
图3
图3
基于原核生物功能数据库(FAPROTAX)的组间功能注释热度图,数值为具有该功能细菌的平均丰度之和
Fig.3
The functional annotation heat map based on Functional Annotation of Prokaryotic Taxa (FAPROTAX), the data is the sum of the bacterial average abundance with this function
2.3 土壤微生物量特征及细菌群落结构与环境因子的关系
灌丛下土壤微生物量主要表现为表层高于次表层,绵刺及霸王灌丛下土壤中微生物量较高,沙冬青最低(表4)。绵刺表层的全氮及土壤速效养分要高于其他组;红砂及霸王灌丛下土壤具有更高的盐分含量(特别是Cl-和Na+)。在土层方面,次表层具有更高的含水量、pH值、电导率、全碳、全磷、Mg2+及HCO
表4 组间微生物量及环境因子统计表
Table 4
| 环境因子 | 红砂 | 绵刺 | 沙冬青 | 霸王 | 白刺 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0—10 cm | 10—20 cm | 0—10 cm | 10—20 cm | 0—10 cm | 10—20 cm | 0—10 cm | 10—20 cm | 0—10 cm | 10—20 cm | |||||
| MBC/(mg·kg-1) | 65.99±12.66 | 58.42±11.38 | 80.51±15.14 | 65.11±10.36 | 45.79±8.11 | 38.12±6.93 | 84.02±17.21 | 62.09±11.44 | 57.70±9.91 | 45.77±8.36 | ||||
| MBN/(mg·kg-1) | 9.11±1.02 | 7.99±0.86 | 12.95±1.17 | 8.88±0.99 | 5.96±0.41 | 5.19±0.39 | 12.18±1.33 | 9.58±0.81 | 8.94±0.75 | 6.52±0.55 | ||||
| TC/(g·kg-1) | 5.56±0.27 | 4.71±0.21 | 4.94±0.39 | 7.28±0.44 | 2.91±0.13 | 8.38±0.47 | 4.96±0.35 | 6.82±0.37 | 2.93±0.11 | 8.07±0.42 | ||||
| TN/(g·kg-1) | 0.19±0.01 | 0.18±0.00 | 0.29±0.02 | 0.22±0.01 | 0.11±0.00 | 0.13±0.00 | 0.19±0.01 | 0.19±0.01 | 0.09±0.01 | 0.14±0.00 | ||||
| TP/(g·kg-1) | 0.35±0.03 | 0.37±0.04 | 0.30±0.03 | 0.34±0.04 | 0.24±0.02 | 0.30±0.02 | 0.30±0.03 | 0.34±0.03 | 0.19±0.01 | 0.24±0.03 | ||||
| SOC/(g·kg-1) | 2.15±0.19 | 2.22±0.21 | 3.83±0.33 | 3.02±0.32 | 1.29±0.10 | 1.55±0.14 | 2.45±0.23 | 2.13±0.22 | 1.18±0.11 | 1.74±0.14 | ||||
| AN/(mg·kg-1) | 10.53±2.76 | 6.27±2.28 | 19.29±3.92 | 10.17±3.13 | 3.04±1.04 | 12.84±3.06 | 15.97±3.47 | 11.86±3.36 | 8.19±2.11 | 3.72±1.17 | ||||
| AP/(mg·kg-1) | 1.28±0.20 | 2.03±0.42 | 3.80±0.57 | 0.96±0.21 | 0.84±0.19 | 0.85±0.21 | 1.87±0.24 | 1.19±0.17 | 0.63±0.07 | 1.08±0.18 | ||||
| Cl-/(mg·kg-1) | 116.53±3.41 | 118.07±3.37 | 27.68±1.03 | 30.55±1.24 | 25.14±1.08 | 36.26±1.42 | 113.78±3.03 | 93.06±2.94 | 33.06±1.38 | 49.66±1.90 | ||||
| HCO | 75.68±1.36 | 81.38±1.42 | 50.62±0.93 | 68.76±1.44 | 44.24±0.52 | 88.29±2.04 | 50.54±0.88 | 73.5±1.82 | 48.88±0.47 | 68.98±1.96 | ||||
| SO | 134.55±9.38 | 55.99±5.03 | 38.88±4.02 | 41.21±4.50 | 154.40±11.66 | 149.58±12.05 | 193.77±15.44 | 85.09±6.14 | 43.64±4.16 | 39.02±4.42 | ||||
| Ca2+/(mg·kg-1) | 35.79±2.84 | 36.10±2.55 | 66.98±5.72 | 84.23±6.11 | 56.86±4.06 | 77.8±5.30 | 75.14±5.22 | 68.63±4.93 | 63.27±5.71 | 86.44±6.16 | ||||
| K+/(mg·kg-1) | 33.58±1.09 | 25.62±1.26 | 24.92±1.07 | 22.29±0.94 | 22.29±1.23 | 22.27±1.10 | 36.51±1.24 | 30.33±1.37 | 16.77±0.77 | 25.85±1.45 | ||||
| Mg2+/(mg·kg-1) | 10.15±0.98 | 13.20±1.52 | 11.39±1.07 | 15.80±1.39 | 11.75±1.25 | 15.46±1.41 | 12.91±1.35 | 18.6±1.83 | 11.01±1.22 | 18.08±2.00 | ||||
| Na+/(mg·kg-1) | 186.78±20.03 | 221.38±19.37 | 34.78±2.94 | 33.46±3.44 | 22.05±2.19 | 80.11±9.92 | 95.84±12.56 | 122.68±15.34 | 13.57±0.84 | 28.7±3.24 | ||||
| EC/(μS·cm-1) | 217.67±2.06 | 248.10±1.55 | 106.33±1.07 | 140.67±1.24 | 100.17±0.82 | 171.90±0.64 | 231.00±2.55 | 202.10±1.29 | 100.23±0.71 | 143..83±0.70 | ||||
| MOI/% | 0.87±0.06 | 1.65±0.09 | 1.68±0.42 | 1.48±0.08 | 1.07±0.06 | 1.78±0.07 | 2.07±0.51 | 1.96±0.10 | 1.69±0.10 | 1.83±0.06 | ||||
| pH | 8.98±0.05 | 9.20±0.06 | 8.33±0.04 | 8.61±0.03 | 8.28±0.04 | 8.55±0.04 | 7.87±0.04 | 8.77±0.04 | 8.65±0.05 | 8.58±0.05 | ||||
MBC=微生物量碳,MBN=微生物量氮,TC=土壤全碳,TN=土壤全氮,TP=土壤全磷,SOC=土壤有机碳,AN=土壤有效氮,AP=土壤有效磷,EC=土壤电导率,MOI=土壤含水量。
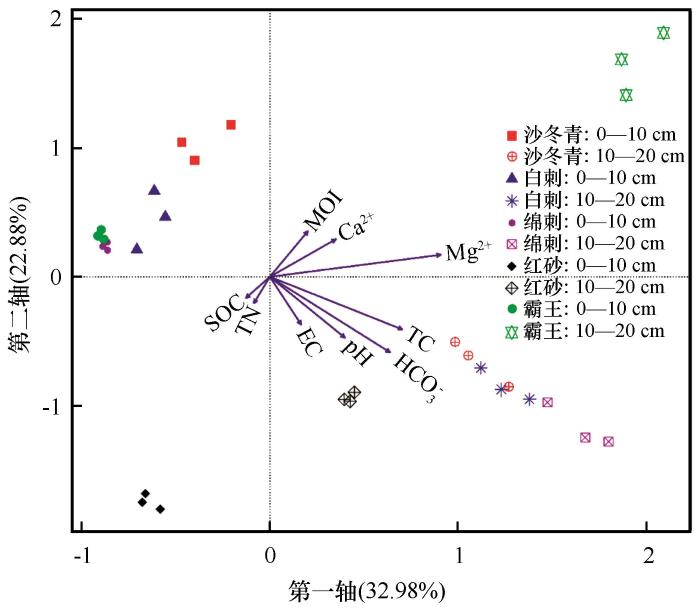
与土壤细菌群落结构相关性较高的环境因子主要是Mg2+(r=0.7084)、TC(r=0.5294)、HCO
表5 Mantel检验中与土壤细菌群落相关性最高的9个环境因子
Table 5
| 环境因子 | r | P |
|---|---|---|
| Mg2+ | 0.7084 | <0.001 |
| TC | 0.5294 | <0.001 |
| HCO | 0.4575 | <0.001 |
| Ca2+ | 0.2455 | 0.002 |
| pH | 0.1806 | 0.007 |
| MOI | 0.1779 | 0.008 |
| EC | 0.1539 | 0.011 |
| SOC | 0.1529 | 0.013 |
| TN | 0.1371 | 0.018 |
TC=土壤全碳,MOI=土壤含水量,EC=土壤电导率,SOC=土壤有机碳,TN=土壤全氮。
图4
图4
9种环境因子与全样本土壤细菌群落的典型相关分析(CCA)排序
TC=土壤全碳,MOI=土壤含水量,EC=土壤电导率,SOC=土壤有机碳,TN=土壤全氮
Fig.4
Ordination diagram of canonical correlation analysis of nine environmental factors and soil bacterial communities in all samples,
3 讨论
3.1 灌木的种系发生组学亲缘关系与土壤细菌群落差异程度的比较
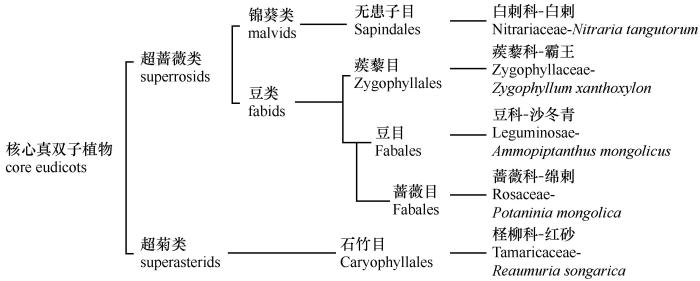
根据基于分子生物学数据的APG Ⅳ分类法(图5)[41],红砂所在的石竹目属于超菊类,而其他4种灌木均属于超蔷薇类。所涉及的5种荒漠灌木分属5目,亲缘关系的远近有所区别。5种灌木之间在种系发生组学上的亲缘关系与本研究中5种灌木下土壤中细菌群落结构差异程度十分吻合(表2)。灌木的亲缘关系越远,其下土壤中细菌的群落结构差异越大。而在超蔷薇类内部,虽然4种灌木分属不同的目,但他们的土壤细菌群落结构差异均不显著。这不仅反映了超菊类与超蔷薇类灌木的显著差异,也表明在同一区域的相似环境下,植物基因组的差异程度与土壤细菌群落结构的差异程度可能存在一定关联。有研究表明植物可能会积极地管理周围整体的微生物群落的组成而非仅仅通过营造环境条件来影响土壤微生物[42]。然而,植物基因组的差异程度与土壤微生物群落结构的差异程度在多大程度上以及多大范围内存在对应关系仍需要后续更多研究成果支持。
图5
图5
5种灌木种系发生学亲缘关系(基于APG Ⅳ)
Fig.5
The phylogeny genetic relationship of five shrubs by APG Ⅳ
3.2 灌木形态与生理特征对表层土壤细菌群落的影响
本研究结果表明,在红砂表层的生物标志物,包括Longimicrobiaceae科和Microcoleus sp
以上结果表明,对于同一生境中的灌木,其地上部分的不同形态与生理特征会通过影响环境而对表层土壤细菌形成了一定的选择压力,进而影响了表层土壤细菌群落的结构。而深处的土壤环境更为稳定且受植物凋落物的影响较小,因而次表层土壤细菌表现出了不同的群落结构及差异特征。
3.3 灌木生存策略的差异对土壤细菌的影响
荒漠灌木为了应对恶劣的自然环境往往具有不同的生存策略,进而会对土壤细菌群落造成影响,但这些生存策略的具体表达存在差异。例如,红砂与霸王为了对抗土壤盐分胁迫,分别采用了泌盐与积盐的策略。前者可通过泌盐腺将盐分排出体外[23],后者则运用吸Na+排K+的策略在地上部分积累Na+用作渗透调节[46]。这些耐盐策略上的差异不仅会影响土壤盐分含量,还能进一步影响土壤细菌群落。例如在红砂的生物标志物中,表层的Microcoleus属具有耐盐的特性[47],其在红砂土壤中的丰度(3.71%)远超其他灌木(0.01%—0.33%)。但是,对于耐盐能力有限的细菌,例如Adhaeribacter属[48],其在红砂土壤中的丰度则为最低(0.56%,其他灌木平均为3.20%)。而对于霸王来说,其吸Na+排K+的耐盐策略与微生物常见的吸K+排Na+耐盐策略[49]完全相反,这可能是其土壤细菌群落特殊性的塑造因素之一。由于红砂的泌盐与霸王的积盐过程均主要发生在地上部分,因此这种差异也主要表现在表层。此外,这也导致了Na+、K+等不同盐分离子对不同灌木下土壤细菌结构的影响存在差异,进而削弱了这些盐离子对5种灌木土壤细菌群落的整体相关度。
4 结论与展望
阿拉善荒漠的5种荒漠灌木的土壤细菌以放线菌门和变形菌门为主,在属一级为鞘脂单胞菌属和微枝形杆菌属占优。灌木间土壤细菌群落结构、多样性及细菌功能存在差异。其中群落结构差异程度与种系发生组学亲缘关系十分吻合,不同灌木的土壤细菌群落在不同土层呈现不同特点。此外,表层土壤细菌群落组成与结构还受灌木形态、生理特征以及生存策略的影响。Mg2+、土壤全碳和HCO3-的含量是本研究中与土壤细菌群落最为相关的环境因子。
本文通过高通量测序对5种荒漠灌木冠层下的土壤细菌状况进行了调查,为相关研究提供了一定的理论基础。但本研究所涉及的研究范围与样本数量仍较少,要加深对于荒漠环境中植被-微生物关系的认识,仍需对其他荒漠与其他植被进行大范围、多尺度的调查与研究。此外,仍有一些问题需要进一步探讨。例如荒漠灌木生存策略中不同基因的表达如何具体影响土壤微生物,荒漠灌木间土壤微生物状况的差异在土壤呼吸以及碳循环方面有何具体的表现,以及荒漠灌木之间的相互影响如何影响土壤微生物等。
参考文献
Ecological linkages between aboveground and belowground biota
[J].
Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere
[J].
Unravelling the effects of plant species diversity and aboveground litter input on soil bacterial communities
[J].
Vertical distribution of a soil microbial community as affected by plant ecophysiological adaptation in a desert system
[J].
Abiotic and plant gender effects on the structure and function of soil microbial communities associated with Acanthosicyos horridus (Nara) in the Namibian sand-dune desert ecosystem
[J].
Soil microbial beta-diversity is linked with compositional variation in aboveground plant biomass in a semi-arid grassland
[J].
Empirical and theoretical bacterial diversity in four Arizona soils
[J].
Accelerated dryland expansion under climate change
[J].
Warming climate extends dryness-controlled areas of terrestrial carbon sequestration
[J].
The characters of shrub by diversity of Alxa arid desert region
[J].
Microbial colonization and controls in dryland systems
[J].
Soil microbial diversity and the sustainability of agricultural soils
[J].
Functional,regulatory and indicator features of microorganisms in man-made ecosystems
[J].
甘肃荒漠区濒危植物绵刺生理生态学特性的研究
[J].
西鄂尔多斯古地中海孑遗植物干旱胁迫与保护酶响应研究
[J].
阿拉善荒漠草地几种灌木对土壤有效态养分的影响
[J].
白刺属植物现状、生态功能及保护策略
[J].
不同荒漠植物根际土壤微生物群落结构特征
[J].
DNA recovery from soils of diverse composition
[J].
Bacterial diversity in Greenlandic soils as affected by potato cropping and inorganic versus organic fertilization
[J].
Cutadapt removes adapter sequences from high-throughput sequencing reads
[J].
UCHIME improves sensitivity and speed of chimera detection
[J].
An extraction method for measuring soil microbial biomass C
[J].
UniFrac: an effective distance metric for microbial community comparison
[J].
An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants:APG IV
[J].
Plant host-associated mechanisms for microbial selection
[J].
Rubrobacter taiwanensis sp.nov.a novel thermophilic,radiation-resistant species isolated from hot springs
[J].
Ubiquity,diversity and physiological characteristics of Geodermatophilaceae in Shapotou National Desert Ecological Reserve
[J].
Utilization of atmospheric ammonia by an extremely oligotrophic bacterium,Rhodococcus erythropolis N9T-4
[J].
The characteristics of Na+,K+ and free proline distribution in several drought-resistant plants of the Alxa Desert,China
[J].
Phylogeny and salt-tolerance of freshwater Nostocales strains: contribution to their systematics and evolution
[J].
Adhaeribacter
[M]//Whitman W B.




 甘公网安备 62010202000688号
甘公网安备 62010202000688号