荒漠区食细菌线虫对生物土壤结皮下土壤酶活性的影响
刘艳梅 , 1 , 2 , 杨航宇 3 , 刘凤莲 1 , 王俊俊 1 , 王莉红 1 , 张亭亭 1
1.天水师范学院 生物工程与技术学院,甘肃 天水 741001
2.中国科学院西北生态环境资源研究院 沙坡头沙漠试验研究站,甘肃 兰州 730000
3.甘肃林业职业技术学院,甘肃 天水 741020
Effects of soil bacterial-feeding nematodes on soil enzyme activity under biocrusts in desert areas
Liu Yanmei , 1 , 2 , Yang Hangyu 3 , Liu Fenglian 1 , Wang Junjun 1 , Wang Lihong 1 , Zhang Tingting 1
1.College of Biological Engineering and Technology,Tianshui Normal University,Tianshui 741001,Gansu,China
2.Shapotou Desert Research and Experiment Station,Northwest Institute of Eco-Environment and Resources,Chinese Academy of Sciences,Lanzhou 730000,China
3.Gansu Forestry Technological College,Tianshui 741020,Gansu,China
收稿日期: 2020-08-03
修回日期: 2021-08-16
基金资助:
甘肃省科技计划项目 . 21JR7RE177 国家自然科学基金项目 . 41761057 盛彤笙创新基金项目 . GAN-STS-2019-1 . GAN-STS-2019-2 天水市自然科学基金项目 . 2021-FZJHK-1948 . 2020-FZJHK-5734
Received: 2020-08-03
Revised: 2021-08-16
作者简介 About authors
刘艳梅(1978—),女,甘肃天水人,博士,教授,主要从事干旱区土壤生物的研究E-mail:lym-781118@163.com
, E-mail:lym-781118@163.com
摘要
作为土壤的重要生物组分,食细菌线虫影响土壤的能量流动和物质循环,但它在荒漠生态系统的作用仍不清楚。为探明土壤食细菌线虫对荒漠区土壤的影响,以腾格里沙漠东南缘人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,分别采集藻-地衣和藓类结皮及结皮下0—10 cm土样,按每克土壤10、30、60、90、120、150条的密度接种食细菌线虫,以未接种线虫的土壤为对照,测定接种食细菌线虫后土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性的变化,明确食细菌线虫对荒漠区土壤质量的影响。结果表明:土壤食细菌线虫可提高生物土壤结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性,且土壤酶活性随土壤食细菌线虫接种密度的增加呈现先升后降的规律,指示土壤食细菌线虫与微生物存在互利共生关系;此外,接种土壤食细菌线虫背景下,结皮类型也显著影响土壤酶的活性,藓类结皮下土壤酶的活性显著高于藻-地衣结皮(P <0.05),指示结皮发育有利于土壤食细菌线虫与微生物的互长模式。因此,在腾格里沙漠人工植被固沙区土壤食细菌线虫可提高生物土壤结皮下土壤酶的活性,指示土壤食细菌线虫可促进荒漠区土壤的修复进程,有利于荒漠生态系统的改良。
关键词:
土壤食细菌线虫 生物土壤结皮 土壤酶 结皮类型
Abstract
Soil bacterial-feeding nematodes act as important biological components in soil, which affect soil energy flow and material circulation. However, little was known on the function of soil bacterial-feeding nematodes in desert ecosystems. Sand dune soil under biocrusts in the artificial vegetation areas at the southeast edge of Tengger desert was studied to explore the effects of soil bacteria-feeding nematodes on soil in desert areas. Soil samples of 0-10 cm with cyanobacteria-lichen and moss crusts were collected, and inoculated bacterial-feeding nematodes following the density of 10, 30, 60, 90, 120 and 150 individuals in per gram of soil, respectively. Soils with no bacterial-feeding nematodes were as contrasts. The activities of soil urease, sucrase, dehydrogenase and alkaline phosphatase were examined to make sure the effects of bacterial-feeding nematodes on soil quality in desert areas. The results showed that soil bacterial-feeding nematodes increased the activities of soil urease, invertase, dehydrogenase and alkaline phosphatase under biocrusts, and soil enzyme activities increased first and then decreased with increasing the density of soil bacterial-feeding nematodes. The results indicated a mutually beneficial symbiosis between soil bacterial-feeding nematodes and microorganisms. In addition, crust types also significantly affected four studied enzyme activities following the inoculation of soil bacterial-feeding nematodes into soil. Moss crusts has significantly higher soil enzyme activities than that of cyanobacteria-lichen crusts (P <0.05), indicating that the development of crusts is beneficial to the mutual growth mode between bacterial-feeding nematodes and microorganisms. Therefore, soil bacterial-feeding nematodes could increase soil enzyme activities beneath biocrusts in the artificial vegetation area of the Tengger Desert, indicating that soil bacterial-feeding nematodes could promote the process of soil restoration in desert areas and they are beneficial to the improvement of desert ecosystems.
Keywords:
soil bacterial-feeding nematodes biocrusts soil enzyme activities crust types
本文引用格式
刘艳梅, 杨航宇, 刘凤莲, 王俊俊, 王莉红, 张亭亭. 荒漠区食细菌线虫对生物土壤结皮下土壤酶活性的影响 . 中国沙漠 [J], 2022, 42(2): 77-84 doi:10.7522/j.issn.1000-694X.2021.00101
Liu Yanmei, Yang Hangyu, Liu Fenglian, Wang Junjun, Wang Lihong, Zhang Tingting. Effects of soil bacterial-feeding nematodes on soil enzyme activity under biocrusts in desert areas . Journal of Desert Research
0 引言
生物土壤结皮(Biocrusts)作为干旱半干旱荒漠地表景观的重要组成,是由一些绿藻、地衣、苔藓等隐花植物、土壤微生物以及相关的其他生物通过菌丝体和分泌物等与表层土壤颗粒胶结而形成的十分复杂的复合体[1 -2 ] 。作为荒漠生态系统的“工程师”,生物土壤结皮在维持土壤稳定性、促进土壤发育、促进沙地物质循环和能量流动、调节土壤温湿度、提高并维持生物的多样性等方面均发挥重要的功能[3 -4 ] ,对其进行深入研究是人类实现荒漠景观管理和荒漠生态系统可持续发展的重要前提。
土壤微生物和线虫作为土壤生态系统中的重要组分,其广泛分布于各种生境的土壤中,占据土壤食物网的重要节点,是重要的分解者[5 -7 ] 。食细菌线虫作为最主要的土壤自由生活线虫,与细菌通过捕食关系形成的食物网结构是土壤微食物网中最重要的部分,可控制食物网能量流动的方向和大小[8 ] 。除自身代谢外,土壤食细菌线虫还可通过捕食细菌直接或间接影响土壤能量流动和物质循环[9 ] 。土壤食微生物线虫通过与土壤微生物之间的竞争和取食等相互作用彼此产生协同或拮抗作用。理论推测,土壤食细菌线虫通过取食微生物会降低微生物数量和活性,但大量研究发现在食细菌线虫的取食压力下微生物数量和活性不仅未减反而增加。黄荣霞等[10 ] 研究发现,食细菌线虫可刺激石油污染地土壤微生物的增殖,进而增强土壤酶活性;毛小芳等[11 ] 研究发现,食细菌线虫可明显促进细菌增殖和提高土壤微生物的活性(土壤呼吸强度、土壤蔗糖酶、脲酶和磷酸酶的活性均提高)。也有一些相反的结论,其认为食细菌线虫抑制或不影响土壤微生物的数量或活性[12 -13 ] 。目前,土壤食细菌线虫与微生物之间的关系已备受关注,其是解析土壤微食物网的功能和作用的重要依据,但它们的关系还不清晰,特别是在干旱半干旱的荒漠区土壤食细菌线虫与微生物之间的关系鲜见报道。鉴于此,本研究以腾格里沙漠东南缘的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,研究土壤食细菌线虫与土壤酶活性的关系,揭示食细菌线虫对土壤微生物活性的影响,以期为荒漠生态系统的管理及修复提供科学依据。
1 材料与方法
1.1 试验区概况
本试验的采样点位于腾格里沙漠东南缘中国科学院沙坡头沙漠试验研究站人工植被固沙区(37°32′N,105°02′E),处于荒漠化草原向草原化荒漠的过渡地带,也是沙漠与绿洲的过渡区。受蒙古高气压的影响,研究区常年气候干燥且多西北风,年降水量仅为186 mm,且集中在5—9月,但年蒸发量却高达3 000 mm。地下水埋深达80 m,不能被植物直接利用,降水成为该地区植物生长的主要水分来源。
为保护包兰铁路沙坡头沙漠地段的畅通,科学工作者于1956年起在铁路北侧相继建立了以固为主,固阻结合的植被固沙防护体系。首先在流动沙丘上垂直于主风的方向扎设阻沙栅栏,然后在阻沙栅栏扎设麦草方格作为固沙屏障,在无灌溉条件下栽植柠条(Caragana korshinskii )、油蒿(Artemisia ordosica )和花棒(Hedysarum scoparium )等为主的旱生灌木。经过60多年的演变,这些维管束植被的间隙定殖了发育早期阶段的藻类结皮和发育晚期阶段的地衣和藓类结皮,盖度约达到80%。本研究选择铁路北侧的1964年人工植被固沙区作为研究区,以生物土壤结皮下的土壤作为研究对象,研究接种食细菌线虫后土壤酶活性的变化,明确食细菌线虫对土壤微生物活性的影响,进而揭示其对土壤质量及荒漠生态系统的影响。
1.2 研究方法
1.2.1 样品采集及样品处理
采集腾格里沙漠东南缘的1964年人工植被固沙区藻-地衣结皮和藓类结皮及其覆盖下的沙丘土壤,随机选择5个10 m×10 m的样方,在每个样方内随机选取10个点,去除地表的凋落物层,分两种方式采样,一种方式是用PVC管(内径110 mm,高100 mm)采集分别带藻-地衣结皮和藓类结皮的土壤原状样品,采集完成后用堵头堵上下端,做成一个培养钵,共采集50个土壤样品,带回实验室置于常温下备用;另一种方式是采用五点取样法,用直径为5 cm土钻采取0—10 cm土层的土样,将同种结皮下的土壤混合形成一个土样,手工去除可见植物根系和残体,土样装入自封袋并带回实验室。将土样分为两部分,一部分风干用于测定土壤理化性质,另一部分用于土壤线虫的富集培养。该区土壤理化性质和线虫密度见表1 。
为了尽量减少对土壤物理结构和微生物区系的破坏,本试验采用低温冷冻来杀灭培养钵中原状土壤中的原有线虫。其具体过程为:调节培养钵的土壤含水量至田间持水量的60%,22 ℃下培养7 d后(光照时间∶黑暗时间=1∶1)置于-26 ℃下黑暗冷冻48 h,杀灭土壤中活的线虫;然后,重新调节培养钵的土壤含水量至田间持水量的60%,置于22 ℃下培养7 d后, -26 ℃下冰冻48 h;这样反复培养-冷冻4次后,将其放入22 ℃培养7 d后,采用改良的Baermann漏斗法检测土壤线虫[14 ] ,直到检测不出活线虫为止。
1.2.2 土壤食细菌线虫的富集培养
采用原位富集培养法培养土壤食细菌线虫[15 ] 。将采集的新鲜土壤与新鲜猪粪按1∶1的体积比混合,置于室内自然条件下进行富集培养(平均温度22 ℃),培养40 d左右,期间需定时补充水分。采用改良的Baermann漏斗法分离土壤线虫,光学显微镜下统计线虫的数量,并将其接种到PVC培养钵的土壤中。
1.2.3 接种试验
将食细菌线虫的成虫按每克土壤10、30、60、90、120、150条的密度接入PVC培养钵的土壤中,以未接种食细菌线虫的土壤为对照,重复3次。调节PVC培养钵中的土壤含水量至田间持水量的60%,在22 ℃下培养(光照时间∶黑暗时间=1∶1),每5 d补水1次,每次补水量为200 mL。培养1、10、20、30、60 d时,分别测定土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶的活性。
1.2.4 酶活性的测定方法
采用靛酚蓝比色法测定土壤脲酶的活性[16 ] ,以单位时间内尿素转化为NH4 + - N的量来表示;采用3,5-二硝基水杨酸比色法测定蔗糖酶活性[16 ] ,以单位时间内蔗糖转化为葡萄糖的量来表示;采用2,3,5-三苯基氯化四氮唑(TTC)比色法测定脱氢酶活性,以单位时间内TTC转化为三苯甲臜的量来表示[17 ] ;采用对硝基酚磷酸钠比色法测定碱性磷酸酶活性[18 ] ,以单位时间内对硝基酚磷酸钠转化为p -Nitrophenol的量来表示。
1.2.5 数据处理方法
数据经Excel处理后,采用SPSS 16.0软件进行方差分析,显著性水平均为0.05。单因素方差分析用于食细菌线虫的接种密度对土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性的影响;多因素方差分析用于土壤食细菌线虫的接种密度、结皮类型和培养时间交互作用对土壤酶活性的影响。
2 结果与分析
2.1 土壤食细菌线虫对生物土壤结皮下土壤酶活性的影响
2.1.1 土壤食细菌线虫对藻-地衣结皮下土壤酶活性的影响
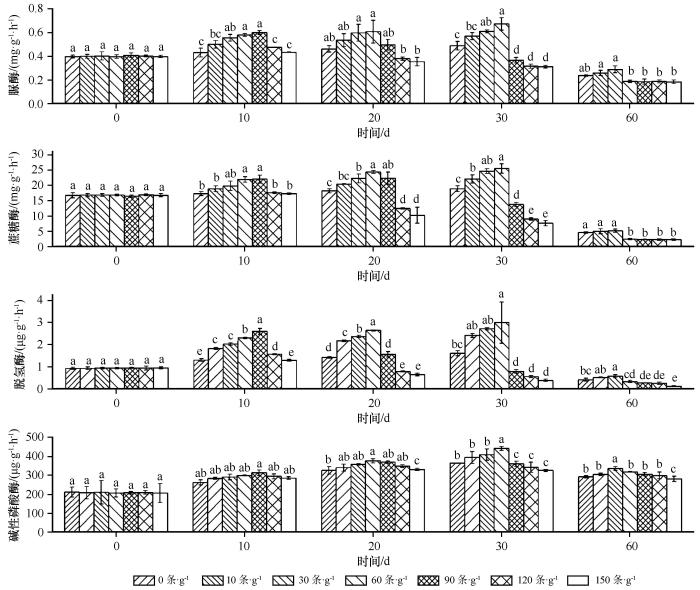
培养1 d时,藻-地衣结皮下接种不同密度的食细菌线虫后土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性与未接种的对照差异均不显著(图1 )。培养10 d,藻-地衣结皮下食细菌线虫的接种密度为每克土壤0—90条,土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性随接种密度的增加而提高,90条时土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性达到峰值(分别为0.60 mg·g-1 ·h-1 、22.1 mg·g-1 ·h-1 、2.60 μg·g-1 ·h-1 和313.8 μg·g-1 ·h-1 );当食细菌线虫的接种密度大于90条,土壤酶活性随食细菌线虫接种密度的增加而降低。同样,培养20 d和30 d时,食细菌线虫的接种密度为每克土壤0—60条,藻-地衣结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性随食细菌线虫接种密度的增加而提高,60条时土壤酶活性达到峰值(20 d时,土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性分别为0.61 mg·g-1 ·h-1 、24.4 mg·g-1 ·h-1 、2.64 μg·g-1 ·h-1 和377.4 μg·g-1 ·h-1 ;30 d时,土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性分别为0.68 mg·g-1 ·h-1 、25.6 mg·g-1 ·h-1 、3.00 μg·g-1 ·h-1 和442.9 μg·g-1 ·h-1 ),而后土壤酶活性随着食细菌线虫接种密度的增加而下降;在培养60 d 时,食细菌线虫的接种密度为每克土壤0—30条,藻-地衣结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性随接种密度的增加而提高,30条时土壤酶活性达到峰值(土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性分别为0.29 mg·g-1 ·h-1 、5.16 mg·g-1 ·h-1 、0.57 μg·g-1 ·h-1 和337.1 μg·g-1 ·h-1 ),而后土壤酶活性随着食细菌线虫接种密度的增加而下降。
图1
图1
食细菌线虫对藻-地衣结皮下土壤酶活性(平均值±标准误)的影响
不同小写字母表示接种密度间差异显著,P <0.05
Fig.1
Effects of bacterial-feeding nematodes on soil enzyme activities (mean±S.E) under cyanobacteria-lichen crusts
可见,土壤食细菌线虫可提高藻-地衣结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性,但当土壤食细菌线虫的密度超过阈值时,土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性与土壤食细菌线虫的密度呈现负相关性。
2.1.2 土壤食细菌线虫对藓类结皮下土壤酶活性的影响
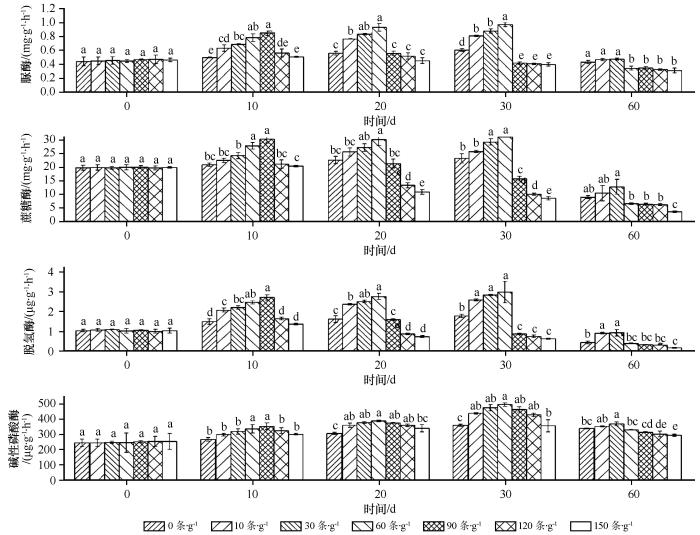
培养1 d时,藓类结皮下接种不同密度的土壤食细菌线虫后土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性与未接种的对照之间差异均不显著(图2 );培养10 d时,藓类结皮下食细菌线虫的接种密度为每克土壤0—90条,土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性随土壤食细菌线虫密度的增加而提高,当食细菌线虫的接种密度为90条,土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性达到峰值(分别为0.85 mg·g-1 ·h-1 、30.3 mg·g-1 ·h-1 、2.72 μg·g-1 ·h-1 和354.3 μg·g-1 ·h-1 ),而后随着食细菌线虫密度的增加土壤酶的活性下降;同样,培养20 d和30 d时,食细菌线虫的接种密度为每克土壤0—60条,藓类结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性随接种密度的增加而提高,在60条的接种密度下土壤酶的活性达到峰值(20 d时,土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性分别为0.93 mg·g-1 ·h-1 、27.9 mg·g-1 ·h-1 、2.77 μg·g-1 ·h-1 和389.8 μg·g-1 ·h-1 ;30 d时,土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性分别为0.97 mg·g-1 ·h-1 、30.2 mg·g-1 ·h-1 、3.00 μg·g-1 ·h-1 和497.0 μg·g-1 ·h-1 ),此后土壤酶活性随着线虫接种密度的增加而下降;培养60 d 时,食细菌线虫的接种密度为每克土壤0—30条,藓类结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性随接种密度的增加而提高,当线虫接种密度为30条,土壤酶活性达到峰值(土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性分别为0.48 mg·g-1 ·h-1 、12.8 mg·g-1 ·h-1 、0.93 μg·g-1 ·h-1 和367.0 μg·g-1 ·h-1 ),而后土壤酶活性随着食细菌线虫接种密度的增加而下降。可见,藓类结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性均随着食细菌线虫接种密度的增加而呈现先升后降的趋势。
图2
图2
食细菌线虫对藓类结皮下土壤酶活性(平均值±标准误)的影响
不同小写字母表示接种密度间差异显著,P <0.05
Fig.2
Effects of bacterial-feeding nematodes on soil enzyme activity (mean±S.E) under moss crust
因此,土壤食细菌线虫能提高藓类结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性,但当土壤食细菌线虫密度超过阈值时,土壤酶活性与土壤食细菌线虫接种密度呈现负相关性。
2.2 土壤酶活性的多因素分析
食细菌线虫接种密度、培养时间和结皮类型均极显著影响土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶的活性(P <0.001,表2 );结皮类型极显著影响土壤酶活性(P< 0.001),接种相同密度的土壤食细菌线虫后,藓类结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性均高于藻-地衣结皮,指示藓类结皮更利于食细菌线虫与微生物的互作模式。此外,线虫接种密度、结皮类型和培养时间二者或三者互作显著影响土壤酶的活性(P< 0.05),表明线虫接种密度、培养时间和结皮类型三因素共同影响土壤酶的活性。
3 讨论
3.1 食细菌线虫的接种密度对生物土壤结皮下土壤酶活性的影响
腾格里沙漠人工植被固沙区土壤食细菌线虫可显著提高藻-地衣结皮和藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性(P <0.05),指示土壤食细菌线虫可提高荒漠区土壤微生物活性。前人的研究也认为食细菌线虫能够提高土壤微生物的活性及土壤酶的活性[19 -20 ] 。可能的原因为:①食细菌线虫通过自身的活动将微生物携带到其自身无法迅速到达的区域,扩充了微生物的生存空间[21 ] ;②食细菌线虫的代谢物为微生物的生长提供了可利用的营养物质[22 ] ,加速了微生物的增殖;③由于线虫的选择性取食,改变了优势菌种群的相对丰度,缓解了其他种类微生物的竞争压力,促进了微生物的增殖[13 ,22 ] ;因此,土壤食细菌线虫与微生物之间通过竞争和取食等相互作用不但没有降低微生物的数量和活性反而促进了微生物的繁衍,它们之间存在互利共生关系,它们协同提高土壤C、N和P等养分元素的转化[20 ,23 -24 ] ,可改良土壤质量。但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降。
3.2 接种食细菌线虫背景下,结皮类型对生物土壤结皮下土壤酶活性的影响
接种相同密度的食细菌线虫,藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性均高于藻-地衣结皮。相比于发育早期的藻-地衣结皮,发育晚期的藓类结皮拥有更厚的结皮层,其厚度约为藻-地衣结皮的4—6倍,厚的结皮层为微生物提供丰富的营养来源(高的有机质和氮含量等,表1 )、稳定的土壤温度、较高的土壤湿度[25 -26 ] ,促进了微生物的增殖。这些大量的微生物资源促进了其捕食者-食细菌线虫的繁衍,而食细菌线虫的增殖又反过来促进了土壤微生物的繁衍,通过食细菌线虫与微生物间的这种互利共生关系,最终提高了土壤微生物的活性,加速了土壤C、N和P元素的转化,改良了荒漠区的土壤质量。
4 结论
在腾格里沙漠人工植被固沙区,土壤食细菌线虫可提高藻-地衣结皮和藓类结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶的活性,表明土壤食细菌线虫可提高微生物活性,指示土壤食细菌线虫与土壤微生物存在互利共生关系,它们协同作用促进土壤C、N、P营养元素转化,进而改良荒漠区土壤的质量。但是,当食细菌线虫的密度超过阈值后,土壤酶的活性与线虫密度呈负相关性,指示过量的土壤食细菌线虫可抑制土壤微生物;结皮类型也显著地影响土壤酶活性(P< 0.05),藓类结皮下土壤脲酶、蔗糖酶、脱氢酶和碱性磷酸酶活性明显高于藻-地衣结皮,表明结皮的进展演替更有利于土壤食细菌线虫与微生物的互利共生关系,指示结皮的进展演替有利于荒漠区土壤的修复。因此,在腾格里沙漠人工植被固沙区,土壤食微线虫能够提高藻-地衣结皮和藓类结皮下土壤酶的活性,指示土壤食细菌线虫可促进荒漠区土壤修复和改良,有利于荒漠生态系统的恢复。
参考文献
View Option
[1]
West N E Structure and function of microphytic soil crusts in wildland ecosystems of arid tosemi-arid regions
[J].Advances in Ecological Research ,1990 ,20 :179 -223 .
[本文引用: 1]
[2]
Belnap J Lange O L Biological soil crust: structure, function and management [M].Berlin,Germany :Springer-Verlag ,2003 .
[本文引用: 1]
[3]
张元明 ,王雪芹 荒漠地表生物土壤结皮形成与演替特征概述
[J].生态学报 ,2010 ,30 (16 ):4484 -4492 .
[本文引用: 1]
[4]
Liu Y M Li X R Jia R L et al Effects of biological soil crusts on soil nematode communities following dune stabilization in the Tengger Desert,Northern China
[J].Applied Soil Ecology ,2011 ,49 :118 -124 .
[本文引用: 1]
[5]
吴纪华 ,宋慈玉 ,陈家宽 食微线虫对植物生长及土壤养分循环的影响
[J].生物多样性 ,2007 ,15 (2 ):124 -133 .
[本文引用: 1]
[6]
Clarholm M Interactions of bacteria, protozoa and plants leading to mineralization of soil nitrogen
[J].Soil Biology and Biochemistry ,1985 ,17 :181 -187 .
[7]
Sohlenius B.Abundance,biomass and con tribution to energy flow by soil nematodes in terrestrial ecosystems
[J].Okios ,1980 ,34 :186 -194 .
[本文引用: 1]
[8]
陈小云 ,李辉信 ,胡锋 ,等 食细菌线虫对土壤微生物量和微生物群落结构的影响
[J].生态学报 ,2004 (12 ):2825 -2831 .
[本文引用: 1]
[9]
潘凤娟 ,韩晓增 ,邹文秀 土壤生态系统中食细菌线虫与细菌相互作用关系研究
[J].土壤与作物 ,2017 ,6 (4 ):304 -311 .
[本文引用: 1]
[10]
黄荣霞 ,周际海 ,田胜尼 ,等 石油污染与食细菌线虫对土壤微生物活性及石油降解的影响
[J].环境科学学报 ,2017 ,37 (11 ):4322 -4328 .
[本文引用: 1]
[11]
毛小芳 ,李辉信 ,龙梅 ,等 不同食细菌线虫取食密度下线虫对细菌数量、活性及土壤氮素矿化的影响
[J].应用生态学报 ,2005 ,16 (6 ):1112 -1116 .
[本文引用: 1]
[12]
Jiang Y J Sun B Jin C et al Soil aggregate stratification of nematodes and microbial communities affects the metabolic quotient in an acid soil
[J].Soil Biology and Biochemistry ,2013 ,60 :1 -9 .
[本文引用: 1]
[13]
Djigal D Brauman A Diop T A et al Influence of bacterial-feeding nematodes (Cephalobidae ) on soil microbial communities during maize growth
[J].Soil Biology and Biochemistry , 2004 ,36 (2 ):323 -331 .
[本文引用: 2]
[14]
Carins E J Methods in nematology
[M]//Sasser J N,Jenkins W R.Nematology ,Fundamentals and Recent Advances with Emphasis on Plant Parasitic and Soil Forms.Chapel Hill,USA :University of North Carolina Press ,1960 :33 -84 .
[本文引用: 1]
[15]
毛小芳 ,胡锋 ,李辉信 土壤食细菌线虫的原位富集培养方法
[J].生态学报 ,2007 (2 ):650 -654 .
[本文引用: 1]
[16]
关松荫 土壤酶及其研究法 [M].北京 :农业出版社 ,1986 .
[本文引用: 2]
[17]
Liu Y M Yang H Y Li X R et al Effects of biological soil crusts on soil enzyme activities in revegetated areas of the Tengger Desert,China
[J].Applied Soil Ecology ,2014 ,80 :6 -14 .
[本文引用: 1]
[18]
Tabatabai M A Bremner J M Use of p -nitrophenyl phosphate for assay of soil phosphatase activity
[J].Soil Biology and Biochemistry ,1969 ,1 :301 -307 .
[本文引用: 1]
[19]
Zhou J H Chen D S Huang R X et al Effects of bacterial-feeding nematodes on soil microbial activity and the microbial community in oil-contaminated soil
[J].Journal of Environmental Management ,2019 ,234 :424 -430 .
[本文引用: 1]
[20]
李贺勤 ,张林林 ,刘奇志 ,等 接种食细菌线虫对连作草莓幼苗生长及其根际土壤酶活性和矿质氮含量影响的研究
[J].中国生物防治学报 ,2014 ,30 (3 ):355 -360 .
[本文引用: 2]
[21]
胡锋 ,李辉信 ,谢涟琪 ,等 土壤食细菌线虫与细菌的相互作用及其对N、P矿化生物固定的影响及机理
[J].生态学报 ,1999 (6 ):914 -920 .
[本文引用: 1]
[22]
肖海峰 ,焦家国 ,胡锋 ,等 食细菌线虫Caenorhabditis elegans 的取食偏好性
[J].生态学报 , 2010 ,30 (24 ):7101 -7105 .
[本文引用: 2]
[23]
Bardgett R D Chan K F Experimental evidence that soil fauna enhance nutrient mineralization and plant nutrient uptake in montane grassland ecosystems
[J].Soil Biology and Biochemistry ,1999 ,31 :1007 -1014 .
[本文引用: 1]
[24]
Li H X Hu F Effect of bacterial-feeding nematode inoculation on wheat growth and N and P up take
[J].Pedosphere ,2001 ,11 :57 -62 .
[本文引用: 1]
[25]
Liu Y M Li X R Xing Z S et al Responses of soil microbial biomass and community composition to biological soil crusts in the revegetated areas of the Tengger Desert
[J].Applied Soil Ecology ,2013 ,65 :52 -59 .
[本文引用: 1]
[26]
李新荣 ,张志山 ,谭会娟 ,等 我国北方风沙危害区生态重建与恢复:腾格里沙漠土壤水分与植被承载力的探讨
[J].中国科学:生命科学 ,2014 (3 ):257 -266 .
[本文引用: 1]
Structure and function of microphytic soil crusts in wildland ecosystems of arid tosemi-arid regions
1
1990
... 生物土壤结皮(Biocrusts)作为干旱半干旱荒漠地表景观的重要组成,是由一些绿藻、地衣、苔藓等隐花植物、土壤微生物以及相关的其他生物通过菌丝体和分泌物等与表层土壤颗粒胶结而形成的十分复杂的复合体[1 -2 ] .作为荒漠生态系统的“工程师”,生物土壤结皮在维持土壤稳定性、促进土壤发育、促进沙地物质循环和能量流动、调节土壤温湿度、提高并维持生物的多样性等方面均发挥重要的功能[3 -4 ] ,对其进行深入研究是人类实现荒漠景观管理和荒漠生态系统可持续发展的重要前提. ...
1
2003
... 生物土壤结皮(Biocrusts)作为干旱半干旱荒漠地表景观的重要组成,是由一些绿藻、地衣、苔藓等隐花植物、土壤微生物以及相关的其他生物通过菌丝体和分泌物等与表层土壤颗粒胶结而形成的十分复杂的复合体[1 -2 ] .作为荒漠生态系统的“工程师”,生物土壤结皮在维持土壤稳定性、促进土壤发育、促进沙地物质循环和能量流动、调节土壤温湿度、提高并维持生物的多样性等方面均发挥重要的功能[3 -4 ] ,对其进行深入研究是人类实现荒漠景观管理和荒漠生态系统可持续发展的重要前提. ...
荒漠地表生物土壤结皮形成与演替特征概述
1
2010
... 生物土壤结皮(Biocrusts)作为干旱半干旱荒漠地表景观的重要组成,是由一些绿藻、地衣、苔藓等隐花植物、土壤微生物以及相关的其他生物通过菌丝体和分泌物等与表层土壤颗粒胶结而形成的十分复杂的复合体[1 -2 ] .作为荒漠生态系统的“工程师”,生物土壤结皮在维持土壤稳定性、促进土壤发育、促进沙地物质循环和能量流动、调节土壤温湿度、提高并维持生物的多样性等方面均发挥重要的功能[3 -4 ] ,对其进行深入研究是人类实现荒漠景观管理和荒漠生态系统可持续发展的重要前提. ...
Effects of biological soil crusts on soil nematode communities following dune stabilization in the Tengger Desert,Northern China
1
2011
... 生物土壤结皮(Biocrusts)作为干旱半干旱荒漠地表景观的重要组成,是由一些绿藻、地衣、苔藓等隐花植物、土壤微生物以及相关的其他生物通过菌丝体和分泌物等与表层土壤颗粒胶结而形成的十分复杂的复合体[1 -2 ] .作为荒漠生态系统的“工程师”,生物土壤结皮在维持土壤稳定性、促进土壤发育、促进沙地物质循环和能量流动、调节土壤温湿度、提高并维持生物的多样性等方面均发挥重要的功能[3 -4 ] ,对其进行深入研究是人类实现荒漠景观管理和荒漠生态系统可持续发展的重要前提. ...
食微线虫对植物生长及土壤养分循环的影响
1
2007
... 土壤微生物和线虫作为土壤生态系统中的重要组分,其广泛分布于各种生境的土壤中,占据土壤食物网的重要节点,是重要的分解者[5 -7 ] .食细菌线虫作为最主要的土壤自由生活线虫,与细菌通过捕食关系形成的食物网结构是土壤微食物网中最重要的部分,可控制食物网能量流动的方向和大小[8 ] .除自身代谢外,土壤食细菌线虫还可通过捕食细菌直接或间接影响土壤能量流动和物质循环[9 ] .土壤食微生物线虫通过与土壤微生物之间的竞争和取食等相互作用彼此产生协同或拮抗作用.理论推测,土壤食细菌线虫通过取食微生物会降低微生物数量和活性,但大量研究发现在食细菌线虫的取食压力下微生物数量和活性不仅未减反而增加.黄荣霞等[10 ] 研究发现,食细菌线虫可刺激石油污染地土壤微生物的增殖,进而增强土壤酶活性;毛小芳等[11 ] 研究发现,食细菌线虫可明显促进细菌增殖和提高土壤微生物的活性(土壤呼吸强度、土壤蔗糖酶、脲酶和磷酸酶的活性均提高).也有一些相反的结论,其认为食细菌线虫抑制或不影响土壤微生物的数量或活性[12 -13 ] .目前,土壤食细菌线虫与微生物之间的关系已备受关注,其是解析土壤微食物网的功能和作用的重要依据,但它们的关系还不清晰,特别是在干旱半干旱的荒漠区土壤食细菌线虫与微生物之间的关系鲜见报道.鉴于此,本研究以腾格里沙漠东南缘的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,研究土壤食细菌线虫与土壤酶活性的关系,揭示食细菌线虫对土壤微生物活性的影响,以期为荒漠生态系统的管理及修复提供科学依据. ...
Interactions of bacteria, protozoa and plants leading to mineralization of soil nitrogen
0
1985
Sohlenius B.Abundance,biomass and con tribution to energy flow by soil nematodes in terrestrial ecosystems
1
1980
... 土壤微生物和线虫作为土壤生态系统中的重要组分,其广泛分布于各种生境的土壤中,占据土壤食物网的重要节点,是重要的分解者[5 -7 ] .食细菌线虫作为最主要的土壤自由生活线虫,与细菌通过捕食关系形成的食物网结构是土壤微食物网中最重要的部分,可控制食物网能量流动的方向和大小[8 ] .除自身代谢外,土壤食细菌线虫还可通过捕食细菌直接或间接影响土壤能量流动和物质循环[9 ] .土壤食微生物线虫通过与土壤微生物之间的竞争和取食等相互作用彼此产生协同或拮抗作用.理论推测,土壤食细菌线虫通过取食微生物会降低微生物数量和活性,但大量研究发现在食细菌线虫的取食压力下微生物数量和活性不仅未减反而增加.黄荣霞等[10 ] 研究发现,食细菌线虫可刺激石油污染地土壤微生物的增殖,进而增强土壤酶活性;毛小芳等[11 ] 研究发现,食细菌线虫可明显促进细菌增殖和提高土壤微生物的活性(土壤呼吸强度、土壤蔗糖酶、脲酶和磷酸酶的活性均提高).也有一些相反的结论,其认为食细菌线虫抑制或不影响土壤微生物的数量或活性[12 -13 ] .目前,土壤食细菌线虫与微生物之间的关系已备受关注,其是解析土壤微食物网的功能和作用的重要依据,但它们的关系还不清晰,特别是在干旱半干旱的荒漠区土壤食细菌线虫与微生物之间的关系鲜见报道.鉴于此,本研究以腾格里沙漠东南缘的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,研究土壤食细菌线虫与土壤酶活性的关系,揭示食细菌线虫对土壤微生物活性的影响,以期为荒漠生态系统的管理及修复提供科学依据. ...
食细菌线虫对土壤微生物量和微生物群落结构的影响
1
2004
... 土壤微生物和线虫作为土壤生态系统中的重要组分,其广泛分布于各种生境的土壤中,占据土壤食物网的重要节点,是重要的分解者[5 -7 ] .食细菌线虫作为最主要的土壤自由生活线虫,与细菌通过捕食关系形成的食物网结构是土壤微食物网中最重要的部分,可控制食物网能量流动的方向和大小[8 ] .除自身代谢外,土壤食细菌线虫还可通过捕食细菌直接或间接影响土壤能量流动和物质循环[9 ] .土壤食微生物线虫通过与土壤微生物之间的竞争和取食等相互作用彼此产生协同或拮抗作用.理论推测,土壤食细菌线虫通过取食微生物会降低微生物数量和活性,但大量研究发现在食细菌线虫的取食压力下微生物数量和活性不仅未减反而增加.黄荣霞等[10 ] 研究发现,食细菌线虫可刺激石油污染地土壤微生物的增殖,进而增强土壤酶活性;毛小芳等[11 ] 研究发现,食细菌线虫可明显促进细菌增殖和提高土壤微生物的活性(土壤呼吸强度、土壤蔗糖酶、脲酶和磷酸酶的活性均提高).也有一些相反的结论,其认为食细菌线虫抑制或不影响土壤微生物的数量或活性[12 -13 ] .目前,土壤食细菌线虫与微生物之间的关系已备受关注,其是解析土壤微食物网的功能和作用的重要依据,但它们的关系还不清晰,特别是在干旱半干旱的荒漠区土壤食细菌线虫与微生物之间的关系鲜见报道.鉴于此,本研究以腾格里沙漠东南缘的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,研究土壤食细菌线虫与土壤酶活性的关系,揭示食细菌线虫对土壤微生物活性的影响,以期为荒漠生态系统的管理及修复提供科学依据. ...
土壤生态系统中食细菌线虫与细菌相互作用关系研究
1
2017
... 土壤微生物和线虫作为土壤生态系统中的重要组分,其广泛分布于各种生境的土壤中,占据土壤食物网的重要节点,是重要的分解者[5 -7 ] .食细菌线虫作为最主要的土壤自由生活线虫,与细菌通过捕食关系形成的食物网结构是土壤微食物网中最重要的部分,可控制食物网能量流动的方向和大小[8 ] .除自身代谢外,土壤食细菌线虫还可通过捕食细菌直接或间接影响土壤能量流动和物质循环[9 ] .土壤食微生物线虫通过与土壤微生物之间的竞争和取食等相互作用彼此产生协同或拮抗作用.理论推测,土壤食细菌线虫通过取食微生物会降低微生物数量和活性,但大量研究发现在食细菌线虫的取食压力下微生物数量和活性不仅未减反而增加.黄荣霞等[10 ] 研究发现,食细菌线虫可刺激石油污染地土壤微生物的增殖,进而增强土壤酶活性;毛小芳等[11 ] 研究发现,食细菌线虫可明显促进细菌增殖和提高土壤微生物的活性(土壤呼吸强度、土壤蔗糖酶、脲酶和磷酸酶的活性均提高).也有一些相反的结论,其认为食细菌线虫抑制或不影响土壤微生物的数量或活性[12 -13 ] .目前,土壤食细菌线虫与微生物之间的关系已备受关注,其是解析土壤微食物网的功能和作用的重要依据,但它们的关系还不清晰,特别是在干旱半干旱的荒漠区土壤食细菌线虫与微生物之间的关系鲜见报道.鉴于此,本研究以腾格里沙漠东南缘的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,研究土壤食细菌线虫与土壤酶活性的关系,揭示食细菌线虫对土壤微生物活性的影响,以期为荒漠生态系统的管理及修复提供科学依据. ...
石油污染与食细菌线虫对土壤微生物活性及石油降解的影响
1
2017
... 土壤微生物和线虫作为土壤生态系统中的重要组分,其广泛分布于各种生境的土壤中,占据土壤食物网的重要节点,是重要的分解者[5 -7 ] .食细菌线虫作为最主要的土壤自由生活线虫,与细菌通过捕食关系形成的食物网结构是土壤微食物网中最重要的部分,可控制食物网能量流动的方向和大小[8 ] .除自身代谢外,土壤食细菌线虫还可通过捕食细菌直接或间接影响土壤能量流动和物质循环[9 ] .土壤食微生物线虫通过与土壤微生物之间的竞争和取食等相互作用彼此产生协同或拮抗作用.理论推测,土壤食细菌线虫通过取食微生物会降低微生物数量和活性,但大量研究发现在食细菌线虫的取食压力下微生物数量和活性不仅未减反而增加.黄荣霞等[10 ] 研究发现,食细菌线虫可刺激石油污染地土壤微生物的增殖,进而增强土壤酶活性;毛小芳等[11 ] 研究发现,食细菌线虫可明显促进细菌增殖和提高土壤微生物的活性(土壤呼吸强度、土壤蔗糖酶、脲酶和磷酸酶的活性均提高).也有一些相反的结论,其认为食细菌线虫抑制或不影响土壤微生物的数量或活性[12 -13 ] .目前,土壤食细菌线虫与微生物之间的关系已备受关注,其是解析土壤微食物网的功能和作用的重要依据,但它们的关系还不清晰,特别是在干旱半干旱的荒漠区土壤食细菌线虫与微生物之间的关系鲜见报道.鉴于此,本研究以腾格里沙漠东南缘的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,研究土壤食细菌线虫与土壤酶活性的关系,揭示食细菌线虫对土壤微生物活性的影响,以期为荒漠生态系统的管理及修复提供科学依据. ...
不同食细菌线虫取食密度下线虫对细菌数量、活性及土壤氮素矿化的影响
1
2005
... 土壤微生物和线虫作为土壤生态系统中的重要组分,其广泛分布于各种生境的土壤中,占据土壤食物网的重要节点,是重要的分解者[5 -7 ] .食细菌线虫作为最主要的土壤自由生活线虫,与细菌通过捕食关系形成的食物网结构是土壤微食物网中最重要的部分,可控制食物网能量流动的方向和大小[8 ] .除自身代谢外,土壤食细菌线虫还可通过捕食细菌直接或间接影响土壤能量流动和物质循环[9 ] .土壤食微生物线虫通过与土壤微生物之间的竞争和取食等相互作用彼此产生协同或拮抗作用.理论推测,土壤食细菌线虫通过取食微生物会降低微生物数量和活性,但大量研究发现在食细菌线虫的取食压力下微生物数量和活性不仅未减反而增加.黄荣霞等[10 ] 研究发现,食细菌线虫可刺激石油污染地土壤微生物的增殖,进而增强土壤酶活性;毛小芳等[11 ] 研究发现,食细菌线虫可明显促进细菌增殖和提高土壤微生物的活性(土壤呼吸强度、土壤蔗糖酶、脲酶和磷酸酶的活性均提高).也有一些相反的结论,其认为食细菌线虫抑制或不影响土壤微生物的数量或活性[12 -13 ] .目前,土壤食细菌线虫与微生物之间的关系已备受关注,其是解析土壤微食物网的功能和作用的重要依据,但它们的关系还不清晰,特别是在干旱半干旱的荒漠区土壤食细菌线虫与微生物之间的关系鲜见报道.鉴于此,本研究以腾格里沙漠东南缘的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,研究土壤食细菌线虫与土壤酶活性的关系,揭示食细菌线虫对土壤微生物活性的影响,以期为荒漠生态系统的管理及修复提供科学依据. ...
Soil aggregate stratification of nematodes and microbial communities affects the metabolic quotient in an acid soil
1
2013
... 土壤微生物和线虫作为土壤生态系统中的重要组分,其广泛分布于各种生境的土壤中,占据土壤食物网的重要节点,是重要的分解者[5 -7 ] .食细菌线虫作为最主要的土壤自由生活线虫,与细菌通过捕食关系形成的食物网结构是土壤微食物网中最重要的部分,可控制食物网能量流动的方向和大小[8 ] .除自身代谢外,土壤食细菌线虫还可通过捕食细菌直接或间接影响土壤能量流动和物质循环[9 ] .土壤食微生物线虫通过与土壤微生物之间的竞争和取食等相互作用彼此产生协同或拮抗作用.理论推测,土壤食细菌线虫通过取食微生物会降低微生物数量和活性,但大量研究发现在食细菌线虫的取食压力下微生物数量和活性不仅未减反而增加.黄荣霞等[10 ] 研究发现,食细菌线虫可刺激石油污染地土壤微生物的增殖,进而增强土壤酶活性;毛小芳等[11 ] 研究发现,食细菌线虫可明显促进细菌增殖和提高土壤微生物的活性(土壤呼吸强度、土壤蔗糖酶、脲酶和磷酸酶的活性均提高).也有一些相反的结论,其认为食细菌线虫抑制或不影响土壤微生物的数量或活性[12 -13 ] .目前,土壤食细菌线虫与微生物之间的关系已备受关注,其是解析土壤微食物网的功能和作用的重要依据,但它们的关系还不清晰,特别是在干旱半干旱的荒漠区土壤食细菌线虫与微生物之间的关系鲜见报道.鉴于此,本研究以腾格里沙漠东南缘的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,研究土壤食细菌线虫与土壤酶活性的关系,揭示食细菌线虫对土壤微生物活性的影响,以期为荒漠生态系统的管理及修复提供科学依据. ...
Influence of bacterial-feeding nematodes (Cephalobidae )? on soil microbial communities during maize growth
2
2004
... 土壤微生物和线虫作为土壤生态系统中的重要组分,其广泛分布于各种生境的土壤中,占据土壤食物网的重要节点,是重要的分解者[5 -7 ] .食细菌线虫作为最主要的土壤自由生活线虫,与细菌通过捕食关系形成的食物网结构是土壤微食物网中最重要的部分,可控制食物网能量流动的方向和大小[8 ] .除自身代谢外,土壤食细菌线虫还可通过捕食细菌直接或间接影响土壤能量流动和物质循环[9 ] .土壤食微生物线虫通过与土壤微生物之间的竞争和取食等相互作用彼此产生协同或拮抗作用.理论推测,土壤食细菌线虫通过取食微生物会降低微生物数量和活性,但大量研究发现在食细菌线虫的取食压力下微生物数量和活性不仅未减反而增加.黄荣霞等[10 ] 研究发现,食细菌线虫可刺激石油污染地土壤微生物的增殖,进而增强土壤酶活性;毛小芳等[11 ] 研究发现,食细菌线虫可明显促进细菌增殖和提高土壤微生物的活性(土壤呼吸强度、土壤蔗糖酶、脲酶和磷酸酶的活性均提高).也有一些相反的结论,其认为食细菌线虫抑制或不影响土壤微生物的数量或活性[12 -13 ] .目前,土壤食细菌线虫与微生物之间的关系已备受关注,其是解析土壤微食物网的功能和作用的重要依据,但它们的关系还不清晰,特别是在干旱半干旱的荒漠区土壤食细菌线虫与微生物之间的关系鲜见报道.鉴于此,本研究以腾格里沙漠东南缘的人工植被固沙区生物土壤结皮覆盖的沙丘土壤为研究对象,研究土壤食细菌线虫与土壤酶活性的关系,揭示食细菌线虫对土壤微生物活性的影响,以期为荒漠生态系统的管理及修复提供科学依据. ...
... 腾格里沙漠人工植被固沙区土壤食细菌线虫可显著提高藻-地衣结皮和藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性(P <0.05),指示土壤食细菌线虫可提高荒漠区土壤微生物活性.前人的研究也认为食细菌线虫能够提高土壤微生物的活性及土壤酶的活性[19 -20 ] .可能的原因为:①食细菌线虫通过自身的活动将微生物携带到其自身无法迅速到达的区域,扩充了微生物的生存空间[21 ] ;②食细菌线虫的代谢物为微生物的生长提供了可利用的营养物质[22 ] ,加速了微生物的增殖;③由于线虫的选择性取食,改变了优势菌种群的相对丰度,缓解了其他种类微生物的竞争压力,促进了微生物的增殖[13 ,22 ] ;因此,土壤食细菌线虫与微生物之间通过竞争和取食等相互作用不但没有降低微生物的数量和活性反而促进了微生物的繁衍,它们之间存在互利共生关系,它们协同提高土壤C、N和P等养分元素的转化[20 ,23 -24 ] ,可改良土壤质量.但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降. ...
Methods in nematology
1
1960
... 为了尽量减少对土壤物理结构和微生物区系的破坏,本试验采用低温冷冻来杀灭培养钵中原状土壤中的原有线虫.其具体过程为:调节培养钵的土壤含水量至田间持水量的60%,22 ℃下培养7 d后(光照时间∶黑暗时间=1∶1)置于-26 ℃下黑暗冷冻48 h,杀灭土壤中活的线虫;然后,重新调节培养钵的土壤含水量至田间持水量的60%,置于22 ℃下培养7 d后, -26 ℃下冰冻48 h;这样反复培养-冷冻4次后,将其放入22 ℃培养7 d后,采用改良的Baermann漏斗法检测土壤线虫[14 ] ,直到检测不出活线虫为止. ...
土壤食细菌线虫的原位富集培养方法
1
2007
... 采用原位富集培养法培养土壤食细菌线虫[15 ] .将采集的新鲜土壤与新鲜猪粪按1∶1的体积比混合,置于室内自然条件下进行富集培养(平均温度22 ℃),培养40 d左右,期间需定时补充水分.采用改良的Baermann漏斗法分离土壤线虫,光学显微镜下统计线虫的数量,并将其接种到PVC培养钵的土壤中. ...
2
1986
... 采用靛酚蓝比色法测定土壤脲酶的活性[16 ] ,以单位时间内尿素转化为NH4 + - N的量来表示;采用3,5-二硝基水杨酸比色法测定蔗糖酶活性[16 ] ,以单位时间内蔗糖转化为葡萄糖的量来表示;采用2,3,5-三苯基氯化四氮唑(TTC)比色法测定脱氢酶活性,以单位时间内TTC转化为三苯甲臜的量来表示[17 ] ;采用对硝基酚磷酸钠比色法测定碱性磷酸酶活性[18 ] ,以单位时间内对硝基酚磷酸钠转化为p -Nitrophenol的量来表示. ...
... [16 ],以单位时间内蔗糖转化为葡萄糖的量来表示;采用2,3,5-三苯基氯化四氮唑(TTC)比色法测定脱氢酶活性,以单位时间内TTC转化为三苯甲臜的量来表示[17 ] ;采用对硝基酚磷酸钠比色法测定碱性磷酸酶活性[18 ] ,以单位时间内对硝基酚磷酸钠转化为p -Nitrophenol的量来表示. ...
Effects of biological soil crusts on soil enzyme activities in revegetated areas of the Tengger Desert,China
1
2014
... 采用靛酚蓝比色法测定土壤脲酶的活性[16 ] ,以单位时间内尿素转化为NH4 + - N的量来表示;采用3,5-二硝基水杨酸比色法测定蔗糖酶活性[16 ] ,以单位时间内蔗糖转化为葡萄糖的量来表示;采用2,3,5-三苯基氯化四氮唑(TTC)比色法测定脱氢酶活性,以单位时间内TTC转化为三苯甲臜的量来表示[17 ] ;采用对硝基酚磷酸钠比色法测定碱性磷酸酶活性[18 ] ,以单位时间内对硝基酚磷酸钠转化为p -Nitrophenol的量来表示. ...
Use of p -nitrophenyl phosphate for assay of soil phosphatase activity
1
1969
... 采用靛酚蓝比色法测定土壤脲酶的活性[16 ] ,以单位时间内尿素转化为NH4 + - N的量来表示;采用3,5-二硝基水杨酸比色法测定蔗糖酶活性[16 ] ,以单位时间内蔗糖转化为葡萄糖的量来表示;采用2,3,5-三苯基氯化四氮唑(TTC)比色法测定脱氢酶活性,以单位时间内TTC转化为三苯甲臜的量来表示[17 ] ;采用对硝基酚磷酸钠比色法测定碱性磷酸酶活性[18 ] ,以单位时间内对硝基酚磷酸钠转化为p -Nitrophenol的量来表示. ...
Effects of bacterial-feeding nematodes on soil microbial activity and the microbial community in oil-contaminated soil
1
2019
... 腾格里沙漠人工植被固沙区土壤食细菌线虫可显著提高藻-地衣结皮和藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性(P <0.05),指示土壤食细菌线虫可提高荒漠区土壤微生物活性.前人的研究也认为食细菌线虫能够提高土壤微生物的活性及土壤酶的活性[19 -20 ] .可能的原因为:①食细菌线虫通过自身的活动将微生物携带到其自身无法迅速到达的区域,扩充了微生物的生存空间[21 ] ;②食细菌线虫的代谢物为微生物的生长提供了可利用的营养物质[22 ] ,加速了微生物的增殖;③由于线虫的选择性取食,改变了优势菌种群的相对丰度,缓解了其他种类微生物的竞争压力,促进了微生物的增殖[13 ,22 ] ;因此,土壤食细菌线虫与微生物之间通过竞争和取食等相互作用不但没有降低微生物的数量和活性反而促进了微生物的繁衍,它们之间存在互利共生关系,它们协同提高土壤C、N和P等养分元素的转化[20 ,23 -24 ] ,可改良土壤质量.但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降. ...
接种食细菌线虫对连作草莓幼苗生长及其根际土壤酶活性和矿质氮含量影响的研究
2
2014
... 腾格里沙漠人工植被固沙区土壤食细菌线虫可显著提高藻-地衣结皮和藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性(P <0.05),指示土壤食细菌线虫可提高荒漠区土壤微生物活性.前人的研究也认为食细菌线虫能够提高土壤微生物的活性及土壤酶的活性[19 -20 ] .可能的原因为:①食细菌线虫通过自身的活动将微生物携带到其自身无法迅速到达的区域,扩充了微生物的生存空间[21 ] ;②食细菌线虫的代谢物为微生物的生长提供了可利用的营养物质[22 ] ,加速了微生物的增殖;③由于线虫的选择性取食,改变了优势菌种群的相对丰度,缓解了其他种类微生物的竞争压力,促进了微生物的增殖[13 ,22 ] ;因此,土壤食细菌线虫与微生物之间通过竞争和取食等相互作用不但没有降低微生物的数量和活性反而促进了微生物的繁衍,它们之间存在互利共生关系,它们协同提高土壤C、N和P等养分元素的转化[20 ,23 -24 ] ,可改良土壤质量.但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降. ...
... [20 ,23 -24 ],可改良土壤质量.但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降. ...
土壤食细菌线虫与细菌的相互作用及其对N、P矿化生物固定的影响及机理
1
1999
... 腾格里沙漠人工植被固沙区土壤食细菌线虫可显著提高藻-地衣结皮和藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性(P <0.05),指示土壤食细菌线虫可提高荒漠区土壤微生物活性.前人的研究也认为食细菌线虫能够提高土壤微生物的活性及土壤酶的活性[19 -20 ] .可能的原因为:①食细菌线虫通过自身的活动将微生物携带到其自身无法迅速到达的区域,扩充了微生物的生存空间[21 ] ;②食细菌线虫的代谢物为微生物的生长提供了可利用的营养物质[22 ] ,加速了微生物的增殖;③由于线虫的选择性取食,改变了优势菌种群的相对丰度,缓解了其他种类微生物的竞争压力,促进了微生物的增殖[13 ,22 ] ;因此,土壤食细菌线虫与微生物之间通过竞争和取食等相互作用不但没有降低微生物的数量和活性反而促进了微生物的繁衍,它们之间存在互利共生关系,它们协同提高土壤C、N和P等养分元素的转化[20 ,23 -24 ] ,可改良土壤质量.但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降. ...
食细菌线虫Caenorhabditis elegans 的取食偏好性
2
2010
... 腾格里沙漠人工植被固沙区土壤食细菌线虫可显著提高藻-地衣结皮和藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性(P <0.05),指示土壤食细菌线虫可提高荒漠区土壤微生物活性.前人的研究也认为食细菌线虫能够提高土壤微生物的活性及土壤酶的活性[19 -20 ] .可能的原因为:①食细菌线虫通过自身的活动将微生物携带到其自身无法迅速到达的区域,扩充了微生物的生存空间[21 ] ;②食细菌线虫的代谢物为微生物的生长提供了可利用的营养物质[22 ] ,加速了微生物的增殖;③由于线虫的选择性取食,改变了优势菌种群的相对丰度,缓解了其他种类微生物的竞争压力,促进了微生物的增殖[13 ,22 ] ;因此,土壤食细菌线虫与微生物之间通过竞争和取食等相互作用不但没有降低微生物的数量和活性反而促进了微生物的繁衍,它们之间存在互利共生关系,它们协同提高土壤C、N和P等养分元素的转化[20 ,23 -24 ] ,可改良土壤质量.但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降. ...
... ,22 ];因此,土壤食细菌线虫与微生物之间通过竞争和取食等相互作用不但没有降低微生物的数量和活性反而促进了微生物的繁衍,它们之间存在互利共生关系,它们协同提高土壤C、N和P等养分元素的转化[20 ,23 -24 ] ,可改良土壤质量.但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降. ...
Experimental evidence that soil fauna enhance nutrient mineralization and plant nutrient uptake in montane grassland ecosystems
1
1999
... 腾格里沙漠人工植被固沙区土壤食细菌线虫可显著提高藻-地衣结皮和藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性(P <0.05),指示土壤食细菌线虫可提高荒漠区土壤微生物活性.前人的研究也认为食细菌线虫能够提高土壤微生物的活性及土壤酶的活性[19 -20 ] .可能的原因为:①食细菌线虫通过自身的活动将微生物携带到其自身无法迅速到达的区域,扩充了微生物的生存空间[21 ] ;②食细菌线虫的代谢物为微生物的生长提供了可利用的营养物质[22 ] ,加速了微生物的增殖;③由于线虫的选择性取食,改变了优势菌种群的相对丰度,缓解了其他种类微生物的竞争压力,促进了微生物的增殖[13 ,22 ] ;因此,土壤食细菌线虫与微生物之间通过竞争和取食等相互作用不但没有降低微生物的数量和活性反而促进了微生物的繁衍,它们之间存在互利共生关系,它们协同提高土壤C、N和P等养分元素的转化[20 ,23 -24 ] ,可改良土壤质量.但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降. ...
Effect of bacterial-feeding nematode inoculation on wheat growth and N and P up take
1
2001
... 腾格里沙漠人工植被固沙区土壤食细菌线虫可显著提高藻-地衣结皮和藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性(P <0.05),指示土壤食细菌线虫可提高荒漠区土壤微生物活性.前人的研究也认为食细菌线虫能够提高土壤微生物的活性及土壤酶的活性[19 -20 ] .可能的原因为:①食细菌线虫通过自身的活动将微生物携带到其自身无法迅速到达的区域,扩充了微生物的生存空间[21 ] ;②食细菌线虫的代谢物为微生物的生长提供了可利用的营养物质[22 ] ,加速了微生物的增殖;③由于线虫的选择性取食,改变了优势菌种群的相对丰度,缓解了其他种类微生物的竞争压力,促进了微生物的增殖[13 ,22 ] ;因此,土壤食细菌线虫与微生物之间通过竞争和取食等相互作用不但没有降低微生物的数量和活性反而促进了微生物的繁衍,它们之间存在互利共生关系,它们协同提高土壤C、N和P等养分元素的转化[20 ,23 -24 ] ,可改良土壤质量.但当土壤食细菌线虫密度过大时(每克土壤120条和150条),过量的牧食作用导致微生物数量和活性急剧下降,土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性也因此降低,土壤C、N、P元素的转化率降低,诱导土壤质量下降. ...
Responses of soil microbial biomass and community composition to biological soil crusts in the revegetated areas of the Tengger Desert
1
2013
... 接种相同密度的食细菌线虫,藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性均高于藻-地衣结皮.相比于发育早期的藻-地衣结皮,发育晚期的藓类结皮拥有更厚的结皮层,其厚度约为藻-地衣结皮的4—6倍,厚的结皮层为微生物提供丰富的营养来源(高的有机质和氮含量等,表1 )、稳定的土壤温度、较高的土壤湿度[25 -26 ] ,促进了微生物的增殖.这些大量的微生物资源促进了其捕食者-食细菌线虫的繁衍,而食细菌线虫的增殖又反过来促进了土壤微生物的繁衍,通过食细菌线虫与微生物间的这种互利共生关系,最终提高了土壤微生物的活性,加速了土壤C、N和P元素的转化,改良了荒漠区的土壤质量. ...
我国北方风沙危害区生态重建与恢复:腾格里沙漠土壤水分与植被承载力的探讨
1
2014
... 接种相同密度的食细菌线虫,藓类结皮下土壤脱氢酶、蔗糖酶、脲酶和碱性磷酸酶的活性均高于藻-地衣结皮.相比于发育早期的藻-地衣结皮,发育晚期的藓类结皮拥有更厚的结皮层,其厚度约为藻-地衣结皮的4—6倍,厚的结皮层为微生物提供丰富的营养来源(高的有机质和氮含量等,表1 )、稳定的土壤温度、较高的土壤湿度[25 -26 ] ,促进了微生物的增殖.这些大量的微生物资源促进了其捕食者-食细菌线虫的繁衍,而食细菌线虫的增殖又反过来促进了土壤微生物的繁衍,通过食细菌线虫与微生物间的这种互利共生关系,最终提高了土壤微生物的活性,加速了土壤C、N和P元素的转化,改良了荒漠区的土壤质量. ...




 甘公网安备 62010202000688号
甘公网安备 62010202000688号