0 引言
生物土壤结皮(Biological Soil Crusts,BSCs)是由苔藓、地衣、藻类、真菌、细菌等与地表土壤颗粒共同形成的有机复合体[1]。BSCs的发育演替不仅能稳定表层土壤,改善土壤通气、孔隙度及水分分布状况,还能调节土壤中物质循环、促进维管植物的定植、提高微生物多样性,在干旱半干旱地区生态修复过程中尤为重要[2-3]。作为BSCs的主要成员,细菌在土壤碳循环、氮循环、胶结沙粒以及稳定土壤团聚体方面发挥关键作用[4];而真菌可以通过其丝状形态以及胞外聚合物将BSCs颗粒物紧密联系在一起,促进BSCs的演替与功能发挥[5];BSCs中包含多种固氮蓝藻和地衣,如Anabaenaazotica、Lyngbya crytoraginatus、Nostoc flagelliforme、Oscillatora pseudogeminate和Collema sp.等[6]。所以,BSCs具有固氮作用[7],能够显著增加结皮层的土壤氮含量。BSCs每年可向土壤输入氮素0.7~100 kg·hm-2[8];Collema sp.浸湿30 min后,就会向周围环境中释放硝态氮[9]。此外,BSCs还可通过胞外酶的释放催化分解复杂有机物质,其酶活力特征可作为评价土壤状况以及微生物群落代谢的重要指标。
在BSCs演替过程中,土壤微生物群落与土壤性状存在耦合关系和协同变化。目前,关于BSCs对土壤养分、酶活力以及微生物群落结构的影响已有大量研究报道,但关于BSCs演替过程中结皮层细菌、固氮菌、真菌群落结构以及酶活力的协同变化特征鲜有报道。因此,我们在库布齐沙漠北缘的杨树固沙林,选择不同演替阶段的BSCs,研究细菌、固氮菌、真菌群落结构多样性以及土壤酶活力变化特征,对提高微生物介导的BSCs养分循环各环节的认识以及BSCs演替过程中微生物群落动态特征提供科学依据。
1 材料与方法
1.1 研究区概况
研究地位于库布齐沙漠内蒙古林业科学研究院达拉特旗研究基地(40°22′N、109°51′E,海拔1 002 m)。属于中温带大陆性季风气候,年降水量240~360 mm,年平均蒸发量2 160 mm,极端最高气温40.2 ℃,极端最低气温-34.5 ℃,≥10 ℃有效积温3 197.4 ℃,无霜期130~140 d。研究区天然植物主要有寸苔草(Carex duriuscula)、披碱草(Elymus dahuricus)、兰刺头(Echinops sphaerocephalus)、沙米(Agriophyllum squarrosum)、猪毛菜(Salsolacollina)、苦豆子(Sophoraalopecuroides)、油蒿(Artemisia ordosica)和雾冰藜(Bassia dasyphylla)等。固沙林树种主要为杨树(Populus spp.)、小叶锦鸡儿(Caraganamicrophylla)、沙柳(Salix psammophila)和沙枣(Elaeagnusangustifolia)等。
1.2 研究方法
1.2.1 样品采集
鉴于目前在野外状态下无法判断BSCs的形成时间,故依据样地造林时间来推断BSCs的发育时间或演替阶段。根据固沙林营造时间及植被恢复情况,于2021年7月,在造林30年的杨树固沙林地采集BSCs样本。按照临近原则,收集藻结皮(A30)、藻藓混生结皮(AM30,藓结皮数量<40%)和藓结皮(M30),并以无BSCs覆盖的裸沙土为对照样地(CK)。选择4个具有代表性的BSCs演替阶段样地,每个样地20 m×20 m,在每个样地中,采用随机取样法,选择5个取样点进行采样,并将每个样地的5个采样点结皮层土壤样品进行混合,获得大约500 g的代表性样品。藻结皮层取样深度约为0.5 cm,藻藓混生结皮和藓结皮取样深度约为1 cm,对照样地取样深度为1 cm。取样时,抖落结皮下层的土壤,将结皮装入无菌自封袋中均匀混合,放入4 ℃车载冰箱带回实验室,并保存于-80 ℃超低温冰箱中,用于土壤微生物高通量测序;另取一份土壤样本在实验室风干,用于土壤酶活力检测。
1.2.2 土壤指标测定
土壤酶活力测定方法参考《土壤酶及其研究法》[10]。土壤纤维素酶和蔗糖酶活力测定采用3,5-二硝基水杨酸比色法;脲酶活力测定采用靛酚蓝比色法;脱氢酶活力测定采用2,3,5-氯化三苯基四氮唑(TTC)比色法;过氧化氢酶活力测定采用分光光度法。
1.2.3 土壤微生物测定
根据Tiangen Biotech公司试剂盒“genomic DNA isolation kit”说明书进行土壤微生物群落总DNA提取,使用1%琼脂糖凝胶电泳和Nanodrop 2000检测DNA纯度和浓度,并分别以16S rRNA基因、nifH基因和ITS基因作为细菌、固氮菌和真菌分子生态学分析的靶标基因,采用Illumina Miseq平台对靶标基因进行高通量测序分析,扩增引物分别为338F/806R(338F:5'-ACTCCTACGGGAGGCAGCAG-3';806R:5'-GCACTACHVGGGTWTCTAAT-3')、nifHF/nifHR(nifHF:5'-AAAGGYGGWATCGGYAARTCCACCAC-3';nifHR:5'-TTGTTSGCSGCRTACATSGCCATCAT-3')和ITS1F/ITS2R(ITS1F: 5'-CTTGGTCATTTAGAGGAAGTAA-3';ITS2R:5'-GCTGCGTTCTTCATCGATGC-3')。PCR扩增步骤参考张路等[11]的方法进行。委托上海美吉生物医药科技有限公司对扩增产物进行测序。
使用FLASH(V1.2.7,
1.3 数据处理
将有效序列通过UPARSE软件在97%相似水平上进行聚类并产生操作分类单元(Operational Taxonomic Units,OTU)。选取OTU的代表性序列进行物种注释,细菌、固氮菌和真菌分别采用SILVA、FGR和UNITE数据库进行,获得分类学信息并分别在门、纲、目、科、属、种、OTU水平统计各样本的群落组成。采用R3.3.2软件绘制土壤细菌、固氮菌、真菌维恩图和热图,采用Origin2017绘制物种相对丰度图;采用SPSS19.0对土壤酶活力进行统计分析。
2 结果与分析
2.1 BSCs演替阶段土壤酶活力变化特征
在30年固沙林样地,因BSCs演替类型的差异,土壤酶活力差异显著(表1)。和对照样地相比,藻结皮(A30)和藓结皮(M30)中参与土壤碳循环的纤维素酶和蔗糖酶活力显著(P<0.05)提高,但藻藓混生结皮(AM30)差异不明显;同时,随着BSCs的演替等级的提高,参与氮循环的脲酶活力由对照样地的12.01±0.72 mg·d-1·g-1提高至藓结皮的17.01±0.56 mg·d-1·g-1。参与氧化还原反应的脱氢酶活力和过氧化氢酶活力在不同演替阶段存在显著差异,其酶活力依次为A30>M30>AM30>CK。
表1 不同演替阶段BSCs酶活力变化特征
Table 1
| 样地 | 纤维素酶 /(mg·d-1·g-1) | 蔗糖酶 /(mg·d-1·g-1) | 脲酶 /(mg·d-1·g-1) | 脱氢酶 /(μg·d-1·g-1) | 过氧化氢酶 /(mg·d-1·g-1) |
|---|---|---|---|---|---|
| 对照(CK) | 0.96±0.04b | 7.99±0.85c | 12.01±0.72c | 5.30±0.43c | 26.55±0.54d |
| 藻结皮(A30) | 1.59±0.19a | 26.38±0.07a | 14.05±1.00b | 15.95±1.54a | 35.91±0.54a |
| 藻藓混生结皮(AM30) | 0.97±0.07b | 13.65±2.23b | 14.00±0.72b | 5.44±0.25c | 29.49±0.64c |
| 藓结皮(M30) | 1.62±0.28a | 26.53±0.11a | 17.01±0.56a | 8.28±1.95b | 32.42±0.03b |
同列不同字母表示差异显著(P<0.05)。
2.2 BSCs微生物多样性指数分析
α-多样性指数是用于描述物种多样性的重要指标。其中,Coverage指数可反映被测物种的覆盖程度,Shannon指数反映物种多样性,Chao指数则反映物种的丰富度。细菌、固氮菌和真菌Coverage指数为0.991~0.999,能够反映样本的真实情况(表2)。细菌和固氮菌的Shannon指数均由藻结皮(A30)、藻藓混生结皮(AM30)、藓结皮(M30)依次递增,真菌逐渐递减。固氮菌的Chao指数在藓结皮中明显升高,细菌和真菌Chao指数无明显差异。
表2 α-多样性指数
Table 2
| 样地 | 细菌 | 固氮菌 | 真菌 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Coverage | Shannon | Chao | Coverage | Shannon | Chao | Coverage | Shannon | Chao | |
| 对照(CK) | 0.991 | 5.33 | 1939 | 0.999 | 1.85 | 41 | 0.998 | 2.84 | 421 |
| 藻结皮(A30) | 0.992 | 4.90 | 1809 | 0.999 | 1.35 | 33 | 0.998 | 3.49 | 391 |
| 藻藓混生结皮(AM30) | 0.991 | 5.31 | 2105 | 0.999 | 1.71 | 37 | 0.998 | 2.89 | 419 |
| 藓结皮(M30) | 0.993 | 6.06 | 2103 | 0.999 | 2.42 | 67 | 0.998 | 2.70 | 395 |
2.3 BSCs演替阶段土壤细菌群落变化特征
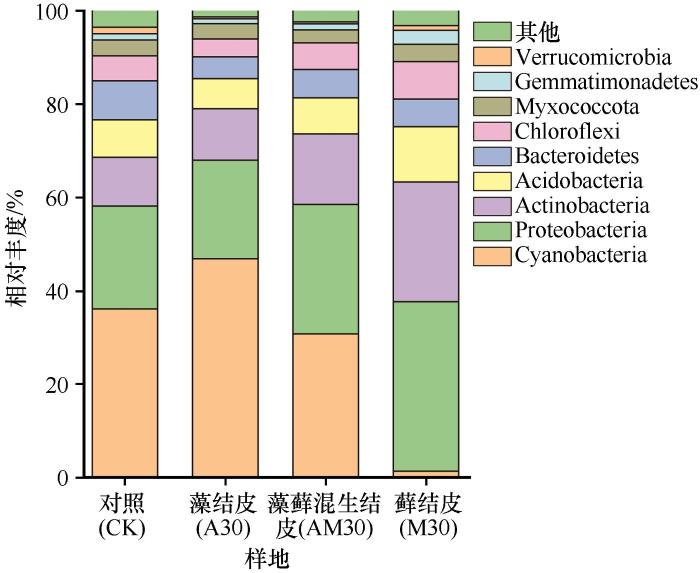
在门水平相对丰度大于1%的有9门,剩余序列归为其他(图1)。4个供试样本均包括蓝细菌门(Cyanobacteria,1.4%~46.9%)、变形菌门(Proteobacteria,21.1%~36.2%)、放线菌门(Actinobacteria,10.5%~25.7%)、酸杆菌门(Acidobacteria,6.4%~11.8%)、拟杆菌门(Bacteroidetes,4.7%~8.3%)、绿弯菌门(Chloroflexi,3.9%~8.0%)、黏球菌门(Myxococcota,2.8%~3.7%)、芽单胞菌门(Gemmatimonadetes,1.1%~3.0%)和疣微菌门(Verrucomicrobia,0.4%~1.4%)。Cyanobacteria是对照样地(CK)、藻结皮(A30)和藻藓混生结皮(AM30)的优势门;Proteobacteria是藓结皮(M30)的优势门。Proteobacteria、Actinobacteria、Acidobacteria、Chloroflexi和Gemmatimonadetes的丰度随BSCs演替阶段逐渐增加。这说明BSCs不同演替阶段,细菌群落结构变化差异较大。
图1
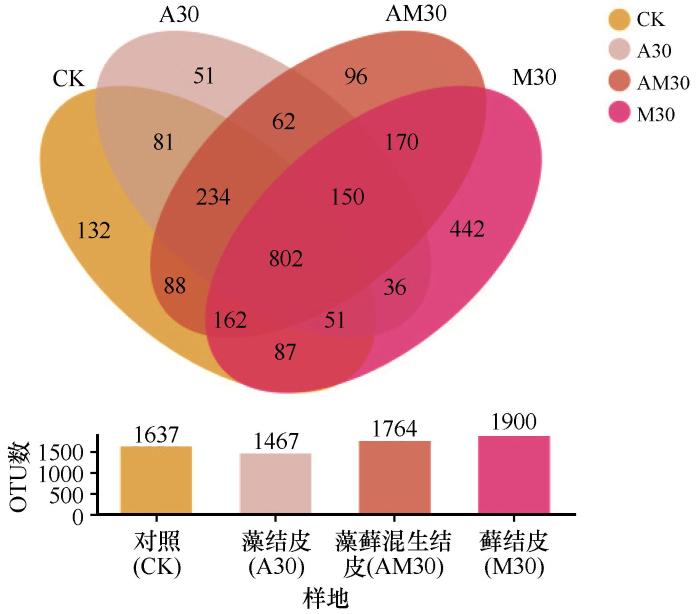
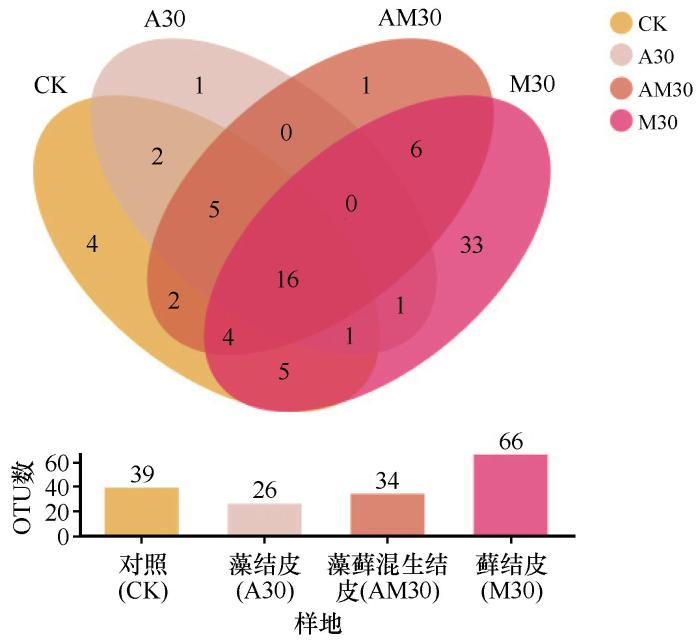
维恩图呈现了不同样本在OTU水平共有的和特有的OTU数量(图2)。对照样地、藻结皮、藻藓混生结皮和藓结皮中共有的OTU数量为802;对照样地、藻结皮、藻藓混生结皮和藓结皮特有的OTU数量分别132、51、96和442。藓结皮特有OTU数量是对照样地、藻结皮和藻藓混生结皮的3.3、8.7倍和4.6倍。由此可知,随着BSCs演替等级的提高,细菌特有OTU数量逐渐增多。藻结皮、藻藓混生结皮和藓结皮依次为1 467、1 764和1 900,说明随BSCs正向演替,细菌OTU数量逐渐增加。
图2
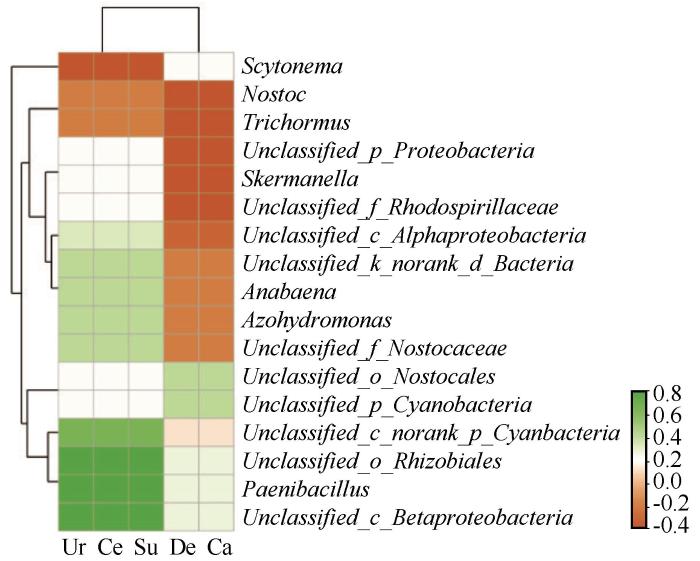
属水平的TOP20的细菌分别为Unclassified_f_Sphingomonadaceae、norank_f_norank_o_Rhizobiales、芽球菌属(Blastococcus)、Ellin6055、Unclassified_f_Micromonosporaceae、鞘氨醇单胞菌(Sphingomonas)、苔藓杆菌属(Bryobacter)、RB41、norank_f_norank_o_Chloroplast、红杆菌属(Rubrobacter)、Rubellimicrobium、norank_f_Coleafasciculaceae、Tychonema_CCAP_1459-11B、Phormidium_ IAM_M-71、Mastigocladopsis_PCC-10914、norank_ f_norank_o_Cyanobacteriales、norank_f_Beijerinckiaceae、嗜地皮杆菌(Geodermatophilus)、微枝形杆菌属(Microvirga)和norank_f_AKIW781。土壤脲酶(Ur)、纤维素酶(Ce)、蔗糖酶(Su)、脱氢酶(De)和过氧化氢酶(Ca)活性对TOP20的细菌整体影响并不明显(图3)。相比而言,脲酶、纤维素酶和蔗糖酶与norank_f_norank_o_Rhizobiales呈显著正相关,与Rubellimicrobium呈显著负相关。
图3
图3
土壤酶活力与细菌属水平相对丰度热图
(脲酶,Ur;纤维素酶,Ce;蔗糖酶,Su;脱氢酶,De;过氧化氢酶,Ca)
Fig.3
Heatmap of soil enzyme activities and relative abundance of bacteria at genus level
2.4 BSCs演替阶段土壤固氮菌群落变化特征
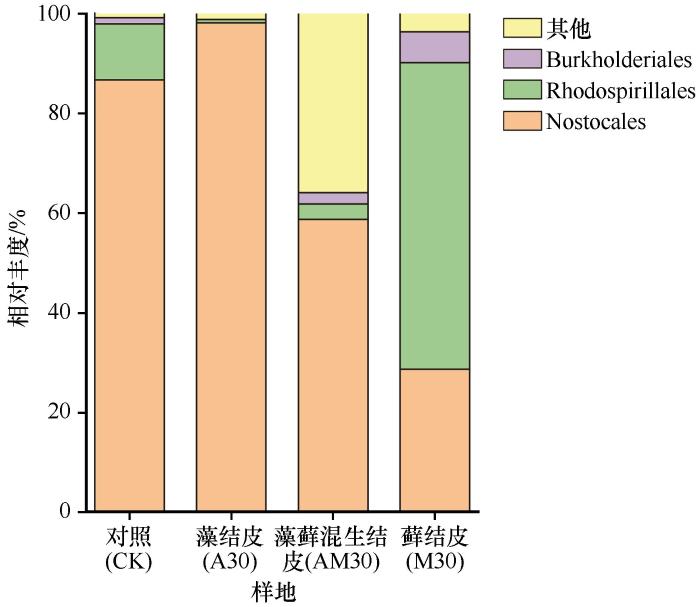
BSCs是干旱半干旱地区土壤氮素的重要来源,固氮菌在其中发挥了巨大作用。固氮菌类群在4个土壤样本中分布差异较大(图4),相对丰度大于1%的有3目,该3目分别为念珠藻目(Nostocales,28.7%~98.1%)、红螺菌目(Rhodospirillales,0.7%~61.4%)和伯克霍尔德菌目(Burkholderiales,0~6.2%)。Nostocales是对照样地、藻结皮和藻藓混生结皮的优势目,Rhodospirillales是藓结皮的优势目。Burkholderiales在藻藓混生结皮和藓结皮中丰度逐渐升高,分别为2.2%和6.2%。藻结皮中的固氮菌类群相对单一,随着BSCs演替等级的增加,固氮菌类群分布逐渐均匀。
图4
图4
土壤固氮菌在目水平上的相对丰度
Fig.4
Relative abundance of soil nitrogen-fixing bacteria at order level
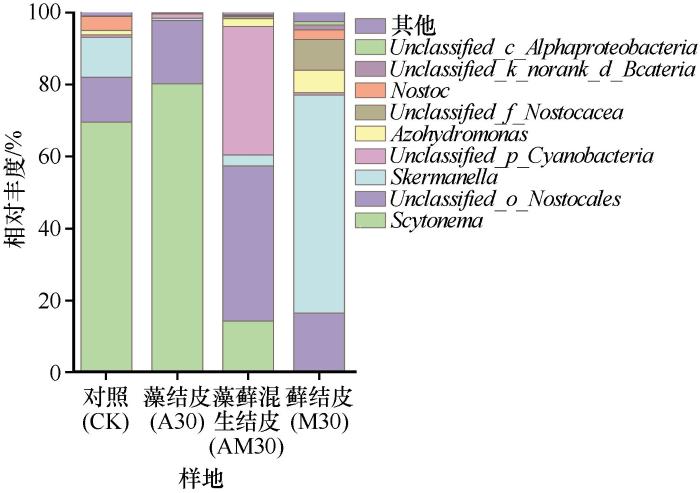
图5显示,伪枝藻属(Scytonema)为对照样地(69.5%)和藻结皮(80.2%)中的优势属;Unclassified_o_Nostocales(43.1%)和Unclassified_p_Cyanobacteria(35.7%)为藻藓混生结皮的优势属;斯科曼氏球菌属(Skermanella,60.6%)为藓结皮的优势属。Scytonema在藻结皮、藻藓混生结皮和藓结皮中的丰度依次递减,分别为80.2%、14.3%和0.3%;Skermanella在藻结皮、藻藓混生结皮和藓结皮中的丰度依次递增,分别为0.7%、3.0%和60.6%,偶氮氢单胞菌属(Azohydromonas)的丰度随BSCs演替等级增加依次递增,分别为0、2.2%和6.2%,Unclassified_ f_Nostocaceae的丰度随BSCs演替依次递增,分别为0、0.6%和8.5%,说明Skermanella、Azohydromonas和Unclassified_f_Nostocaceae随着BSCs演替等级增加其种群比例逐渐提升。此外,Unclassified_c_Alphaproteobacteria仅在藓结皮中出现,其丰度为1.0%。总体而言,随着BSCs演替等级增加,固氮菌多样性逐渐增加。
图5
图5
土壤固氮菌在属水平上的相对丰度
Fig.5
Relative abundance of soil nitrogen-fixing bacteria at genus level
图6
图6
土壤固氮菌在OTU水平上的维恩图
Fig.6
Venn diagram of soil nitrogen-fixing bacteria at the OTU level
图7所示,属水平的TOP20的固氮菌分别为伪枝藻属(Scytonema)、念珠藻属(Nostoc)、三离藻属(Trichormus)、Unclassified_p_Proteobacteria、斯科曼氏球菌属(Skermanella)、Unclassified_f_Rhodospirillaceae、Unclassified_c_Alphaproteobacteria、Unclassified_k_norank_d_Bacteria、鱼腥藻属(Anabaena)、偶氮氢单胞菌属(Azohydromonas)、Unclassified_f_Nostocaceae、Unclassified_o_Nostocales、Unclassified_p_Cyanobacteria、Unclassified_c_norank_p_Cyanbacteria、Unclassified_o_Rhizobiales、类芽孢杆菌属(Paenibacillus)和Unclassified_c_Betaproteobacteria。土壤脲酶、纤维素酶、蔗糖酶、脱氢酶和过氧化氢酶活性对TOP20的固氮菌属没有显著影响。但脲酶、纤维素酶和蔗糖酶与伪枝藻属呈负相关关系。
图7
图7
土壤酶活力与固氮菌属水平相对丰度热图
脲酶,Ur;纤维素酶,Ce;蔗糖酶,Su;脱氢酶,De;过氧化氢酶,Ca
Fig.7
Heatmap of soil enzyme activities and relative abundance of nitrogen-fixing bacteria at genus level
2.5 BSCs演替阶段土壤真菌群落变化特征
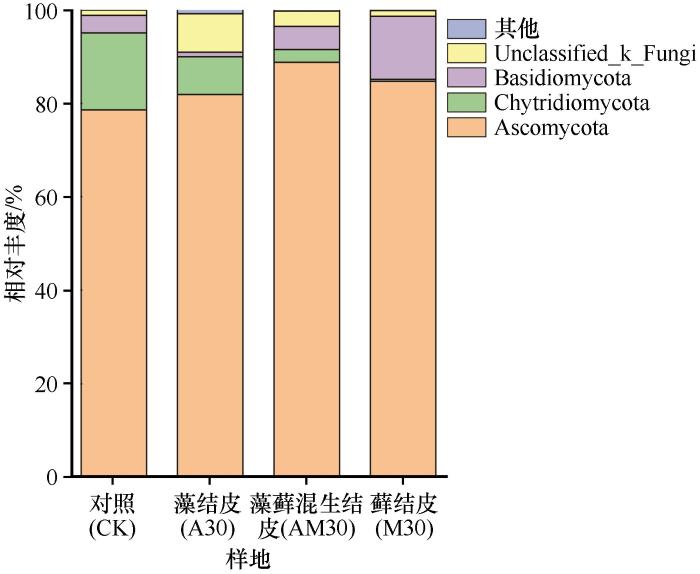
图8显示,在门水平相对丰度大于1%的真菌有4门,分别为子囊菌门(Ascomycota,78.6%~88.8%)、壶菌门(Chytridiomycota,0.4%~16.5%)、担子菌门(Basidiomycota,1.0%~13.5%)和未分类的真菌(Unclassified_k_Fungi,1.1%~8.2%)。Ascomycota是4个土壤样本的优势门;Chytridiomycota丰度随着BSCs演替等级增加逐渐降低,其丰度依次为16.5%、8.1%、2.7%和0.4%;Basidiomycota丰度在藻结皮、藻藓混生结皮和藓结皮中的丰度逐渐升高,分别为1.0%、5.0%和13.5%;说明随着BSCs演替等级增加,Chytridiomycota种群比例逐渐降低,Basidiomycota种群比例逐渐升高。
图8
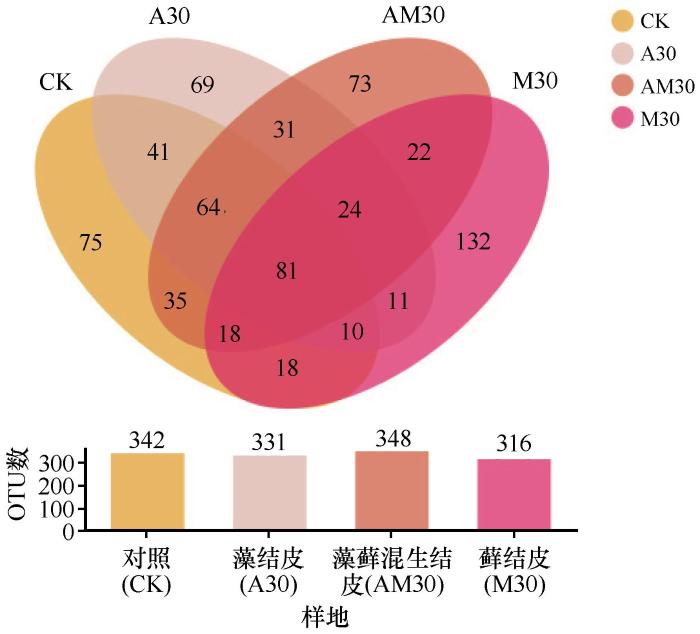
对照样地、藻结皮、藻藓混生结皮和藓结皮中共有真菌OTU数量为81,特有OTU数量分别为75、69、73和132(图9)。藓结皮特有OTU数量是对照样地、藻结皮和藻藓混生结皮的1.8、1.9、1.8倍。对照样地、藻结皮、藻藓混生结皮和藓结皮中真菌OTU总数量分别为342、331、348和316。随着BSCs演替等级增加,其真菌OTU总数量变化不明显,但是特有真菌种类在藓结皮中明显增多。
图9
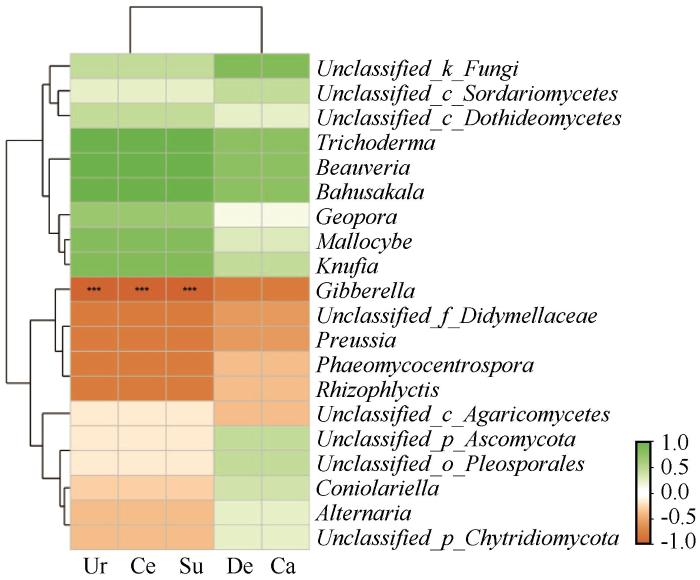
如图10所示,属水平的TOP20的真菌分别为Unclassified_k_Fungi、Unclassified_c_Sordariomycetes、Unclassified_c_Dothideomycetes、木霉属(Trichoderma)、白僵菌属(Beauveria)、Bahusakala、地孔菌属(Geopora)、茸盖属(Mallocybe)、Knufia、赤霉菌属(Gibberella)、Unclassified_f_Didymellaceae、光黑壳属(Preussia)、刺孢属(Phaeomycocentrospora)、囊根壶菌属(Rhizophlyctis)、Unclassified_c_Agaricomycetes、Unclassified_p_Ascomycota、Unclassified_o_Pleosporales、Coniolariella、链格孢属(Alternaria)和Unclassified_p_Chytridiomycota。土壤脲酶、纤维素酶和蔗糖酶与Gibberella呈显著负相关。
图10
图10
土壤酶活力与真菌属水平相对丰度热图
脲酶,Ur;纤维素酶,Ce;蔗糖酶,Su;脱氢酶,De;过氧化氢酶,Ca
Fig.10
Heatmap of soil enzyme activities and relative abundance of fungi at genus level
3 讨论
3.1 BSCs正向演替与土壤酶活力的关系
BSCs的演替阶段反映了干旱半干旱生态系统养分循环和区域生态环境的健康状况。微生物通过氧化、氨化、固氮以及有机物质分解等过程,将必需的无机养分释放到土壤中,在此过程中土壤酶发挥着至关重要的作用[12]。而BSCs是荒漠生态系统参与碳循环的重要驱动力。大量的研究表明,BSCs演替后期的藓结皮的碳循环能力显著高于早期藻结皮[2,13-15]。本研究表明,参与土壤碳循环的纤维素酶和蔗糖酶活力在藻结皮和藓结皮中均显著高于对照样地,但藻结皮和藓结皮间无显著变化。Liu等[16]采用GeoChip功能基因芯片技术发现,BSCs不同演替阶段其微生物参与碳循环的功能基因组成结构相似。Li等[17]采用宏基因组测序方法进一步证实了该观点。此外,蓝细菌门是流沙稳定的先驱者,也是BSCs演替过程中碳循环的主要贡献者[18]。本研究发现,蓝细菌门的丰度在藻结皮土壤样本中最高(图1),可能在参与土壤碳循环的纤维素酶和蔗糖酶活力的改善方面做出了重要贡献。
3.2 BSCs正向演替与土壤细菌群落的关系
BSCs的演替阶段对细菌群落结构的影响具有一定差异,细菌群落结构的变化预示着环境改变为细菌提供了特异性的生存条件,从而对特异菌群进行选择[21]。本研究表明,蓝细菌门是对照样地、藻结皮和藻藓混生结皮的优势门;变形菌门是藓结皮的优势门;放线菌门、酸杆菌门、绿弯菌门和芽单胞菌门的相对丰度随BSCs演替逐渐增加。张尚鹏[3]对黄土丘陵区BSCs研究发现,蓝细菌门是浅色藻结皮、深色藻结皮和藻藓混生结皮的优势细菌门,变形菌门是藓结皮的优势细菌门;酸杆菌门、放线菌门、绿弯菌门、芽单胞菌门和疣微菌门的丰度随BSCs的正向演替逐渐升高,其研究结果与本研究结果基本一致。蓝细菌门在BSCs初始发育中发挥着关键作用,可产生大量的丝状蓝藻胶鞘和分泌胞外多糖促进流沙面的固定[22]。随着BSCs演替等级提高,土壤肥力、酶活力及熟化程度不断提高,促进了高代谢活性细菌的多样性和丰富度,从而引起资源争夺,蓝细菌门逐渐退出竞争[23]。此外,随着苔藓、地衣等植物的拓殖和繁衍,蓝细菌缺少足够的光照激活光合作用,易发生自溶反应[24],两方面的共同作用最终使蓝细菌门在藓结皮中的丰度下降。变形菌门和放线菌门通常被认为是具有高代谢活性的富营养型细菌,在养分丰富的情况下会发生富集[25],随着BSCs演替等级的增加,优势菌门由固沙先锋细菌蓝细菌门逐渐转变成富营养型的变形菌门。
本研究中,酸杆菌门、绿弯菌门和芽单胞菌门的丰度随BSCs的正向演替逐渐增加;细菌OTU数量、特有OTU数量均随BSCs演替逐渐增加。大量的研究表明,土壤细菌多样性随着BSCs正向演替能够得到显著的提高[7,18,26]。随着BSCs的不断发育,结皮层厚度逐渐增加,保水能力、微生物分解速率以及土壤有机物质的降解速率得到提升[27],改变了结皮层微生物群落结构和功能;而微生物群落通过调控生物地球化学循环过程又改善了土壤性状,最终BSCs系统趋于良性稳态循环发展,为荒漠生态系统的恢复做出了重要贡献。本研究发现,土壤酶活力对TOP20的属水平细菌丰度虽然无显著影响,但具有相关性。不同细菌群落组成在不同BSCs演替阶段对土壤酶活力的改善具有不同作用,表明它们在土壤生物地球化学循环和生态系统过程中具有潜在的积极作用[18]。
3.3 BSCs正向演替与土壤固氮菌群落的关系
BSCs的氮循环过程基本由细菌完成[28],固氮细菌对BSCs的形成和演替有着重要的影响[29]。本研究基于nifH基因测序对不同类型的BSCs进行固氮菌群落结构的分析,结果表明,伪枝藻属(Scytonema)为对照样地(69.5%)和藻结皮(80.2%)中的优势属; Unclassified_o_Nostocales(43.1%)和Unclassified_p_Cyanobacteria(35.7%)为藻藓混生结皮的优势属;斯科曼氏球菌属(Skermanella,60.6%)为藓结皮的优势属。唐凯等[30]研究表明,浑善达克沙地的成熟藻结皮、地衣结皮和苔藓结皮中均以未分类的念珠藻科和伪枝藻属为主,BSCs由低级、中级到高级演替过程中,斯科曼氏球菌属丰度逐渐增加,并在苔藓结皮中成为仅次于未分类的念珠藻科和伪枝藻属的第三优势属,其研究结果与本研究相似。
伪枝藻属为典型的丝状蓝藻,在其生长过程中能够分泌大量的胞外多糖(Extracellular polysaccharides,EPS)保护藻体自身抵抗干旱、紫外线等逆境胁迫[31]。在土壤藻的拓殖初期,常以大型丝状蓝藻为主,通过藻丝体将土壤颗粒紧密黏连,使沙土表层形成复杂的有韧性的结合体,为藻结皮向藓结皮转变以及高等植物的入侵提供适宜的生境[32],且随着土壤脲酶、纤维素酶和蔗糖酶活力的提升,伪枝藻属种群数量逐渐降低。斯科曼氏球菌属属于富营养固氮菌,孙棋棋等[33]研究认为,过量的施氮条件促进了斯科曼氏球菌属和偶氮氢单胞菌属(Azohydromonas)的生长。在OTU水平,固氮菌OTU总数量和特有种类均由藻结皮—藻藓混生结皮—藓结皮逐级增加。由此说明,随着BSCs的正向演替,固氮细菌多样性持续增加[34],体现了BSCs向高级阶段演替,并趋于稳定[30]。
3.4 BSCs正向演替与土壤真菌群落的关系
子囊菌门在BSCs各演替阶段均很丰富已被很多学者证实[34-37]。本研究中,子囊菌门是对照样地、藻结皮、藻藓混生结皮和藓结皮的优势门;随着BSCs的正向演替,担子菌门丰度逐渐升高,壶菌门丰度逐渐降低。担子菌门的相对丰度随BSCs演替等级提高逐渐升高,是因为多数担子菌可以与植物根系形成菌根,藻结皮向藓结皮演替过程中,苔藓、地衣等隐花植物逐步定植促进了担子菌门的丰度增加[38-39]。此外,担子菌门属于真菌中最高等的门,与高稳定的有机物质组分呈正相关性[36],进一步说明随着BSCs的正向演替,真菌群落逐渐向高等真菌演替。有研究报道,壶菌门在无BSCs覆盖的表土中相对丰度较低[34],与本研究随BSCs正向演替壶菌门丰度逐渐降低相似。关于壶菌门在BSCs中的报道较为少见,有待进一步研究和探索。
4 结论
在30年杨树固沙林样地,藻结皮、藻藓混生结皮和藓结皮中的微生物群落结构和多样性差异明显。随着BSCs演替等级提高,土壤微生物多样性不断提高,其微生物多样性提高顺序依次是固氮菌>细菌>真菌;优势细菌由固沙先驱者蓝细菌门逐渐转变成富营养型的变形菌门;固氮菌优势属由丝状伪枝藻属逐渐转变成富营养型的斯科曼氏球菌属;真菌中最高等的担子菌门相对丰度随BSCs正向演替逐渐增加。富营养型以及高等微生物多样性增加显著提高了土壤参与碳、氮循环的酶活力,增加了BSCs微环境的复杂性,体现了BSCs由初级向高级阶段稳定性发展。
参考文献
Association of ant nests with successional stages of biological soil crusts in the Tengger Desert,Northern China
[J].
Ecophysiological response against temperature in Klebsormidium (Streptophyta) strains isolated from biological soil crusts of Arctic and Antarctica indicate survival during global warming
[J].
黄土丘陵区不同类型生物结皮下的土壤生态化学计量特征
[J].
A culture-independent study of free living fungi in biological soil crusts of the Colorado Plateau:their diversity and relative contribution to microbial biomass
[J].
Changes in functional gene structure and metabolic potential of the microbial community in biological soil crusts along a revegetation chronosequence in the Tengger Desert
[J].
Comparative metagenomics of two distinct biological soil crusts in the Tengger Desert,China
[J].
Development of bacterial communities in biological soil crusts along a revegetation chronosequence in the Tengger Desert,northwest China
[J].
The evolution of development in Streptomyces analysed by genome comparisons
[J].
Microbial extracellular polymeric substances: ecological function and impact on soil aggregation
[J].
Assessing level of development and successional stages in biological soil crusts with biological indicators
[J].
Microbial growth and enzyme kinetics in rhizosphere hotspots are modulated by soil organics and nutrient availability
[J].
Biological soil crusts and wetting events:effects on soil N and C cycles
[J].
Bacteria and fungi differentially contribute to carbon and nitrogen cycles during biological soil crust succession in arid ecosystems
[J].
Spatial patterns of hypolithic cyanobacterial diversity in Northern Australia
[J].
Recovery of microbial community structure of biological soil crusts in successional stages of Shapotou desert revegetation,northwest China
[J].
Diversity of free-living and lichenized fungal communities in biological soil crusts of the sultanate of oman and their role in improving soil properties
[J].
Development of biological soil crust prompts convergent succession of prokaryotic communities
[J].





 甘公网安备 62010202000688号
甘公网安备 62010202000688号