Economics of salt-induced land degradation and restoration
1
2014
... 盐渍化土壤中存在较高浓度的可溶性盐离子,超过了植物所能耐受的阈值范围,从而限制了绝大多数粮食作物的生长和发育[1-2].对过去40年全球范围土壤盐碱化大尺度时空变化的综合分析显示,1980—2018年,大约16.5 万km2的农业用地受到盐碱化的影响[3],并且由于气候变化,预计未来80年世界许多地区的土壤盐渍化面积将增加[4].土壤盐渍化首先会导致植物经历渗透胁迫,进而引起细胞脱水,而过量的Na+积累则会破坏离子平衡并引发严重的氧化胁迫[5].在盐碱环境中,盐生植物会产生一系列形态、生理、代谢和分子水平的变化,使其能够在盐渍土壤中完成其生命周期[5].荒漠地区的植物通过多种形态和生理反应适应干旱、盐碱及流沙环境.它们通过选择性离子吸收、离子稳态调节和增强抗氧化能力等内在生理适应机制,在荒漠与半荒漠地区生存和扩展[6]. ...
Salt tolerance mechanisms of plants
3
2020
... 盐渍化土壤中存在较高浓度的可溶性盐离子,超过了植物所能耐受的阈值范围,从而限制了绝大多数粮食作物的生长和发育[1-2].对过去40年全球范围土壤盐碱化大尺度时空变化的综合分析显示,1980—2018年,大约16.5 万km2的农业用地受到盐碱化的影响[3],并且由于气候变化,预计未来80年世界许多地区的土壤盐渍化面积将增加[4].土壤盐渍化首先会导致植物经历渗透胁迫,进而引起细胞脱水,而过量的Na+积累则会破坏离子平衡并引发严重的氧化胁迫[5].在盐碱环境中,盐生植物会产生一系列形态、生理、代谢和分子水平的变化,使其能够在盐渍土壤中完成其生命周期[5].荒漠地区的植物通过多种形态和生理反应适应干旱、盐碱及流沙环境.它们通过选择性离子吸收、离子稳态调节和增强抗氧化能力等内在生理适应机制,在荒漠与半荒漠地区生存和扩展[6]. ...
... 植物相关的微生物群落被视为植物的第二基因组,展现出丰富的功能多样性和强大的环境适应能力[2] .促进植物生长的根际细菌(PGPR)具有出色的根部定殖能力,盐生植物的特殊根部微生物群中包含大量的植物根际促生菌[7-8].与对照组相比,在盐处理的灭菌土壤中生长的盐生植物海马齿(Sesuvium portulacastrum)根际土壤优势菌群为蜡样芽孢杆菌(Bacillus cereus)、嗜水气单胞菌(Aeromonas hydrophila)、绿脓杆菌(Pseudomonas aeruginosa)、Corynebacterium xerosis和大肠杆菌[9].研究表明,一些根际细菌能够缓解高盐对农作物生长的影响,并促进植物对盐碱环境的适应[10-13]:Pseudomonas pseudoalcaligenes和Bacillus subtilis通过一系列生理调节过程显著改善了大豆在高盐胁迫下的生长[13];Piriformospora indica提高了盐胁迫番茄植株的鲜重和干重,并且在盐胁迫下Piriformospora indica定殖提高了番茄叶片的叶绿素b、吲哚乙酸、过氧化氢酶和超氧化物歧化酶的活性[14];将玉米根际细菌Bacillus sp. MT7引入番茄根际已被证明能显著增强番茄的盐耐受性[14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
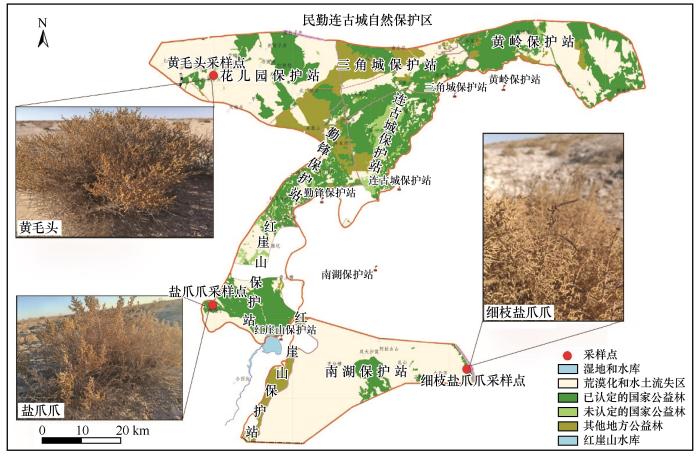
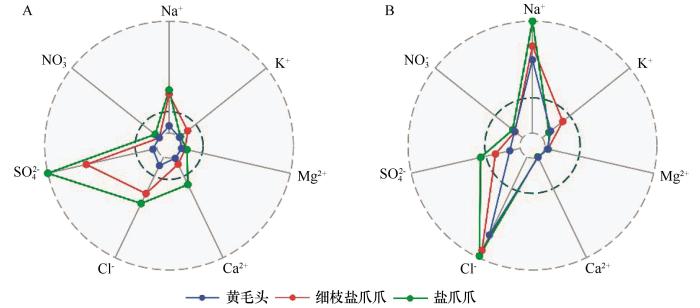
... 盐爪爪属中的不同物种对盐分的适应性存在显著差异,导致了它们在分布上的明显差异[18-20].盐爪爪属的6个种在其分布地区的土壤中,平均总含盐量较高,但其变化范围却很广[18,20].连古城自然保护区生态环境复杂且独特[25],土壤盐分的集聚和分布受地下水分布差异的显著影响.地下水在这一地区的分布并不均匀,由于地形、地质和气候的多样性,不同区域的地下水位、含水层的深度以及水质存在较大差异.这些因素直接影响了土壤的水分状况和盐分的动态平衡[26].本研究调查显示,在连古城自然保护区内,同属植物的分布存在明显差异,3种植物的分布区完全不重叠,不同区域的土壤盐分含量差异显著.特别是在盐爪爪的分布区域,其土壤盐分含量(92.33 g·kg-1)明显高于其他种类,如黄毛头(13.53 g·kg-1)和细枝盐爪爪(72.85 g·kg-1)所处区域的土壤.这3种植物分布的红崖山保护站(盐爪爪)和南湖保护站(细枝盐爪爪)的盐渍土以硫酸盐-氯化物为主,花儿园保护站(黄毛头)则以氯化物为主,这与之前的研究结果相符[18,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
Global predictions of primary soil salinization under changing climate in the 21st century
2
2021
... 盐渍化土壤中存在较高浓度的可溶性盐离子,超过了植物所能耐受的阈值范围,从而限制了绝大多数粮食作物的生长和发育[1-2].对过去40年全球范围土壤盐碱化大尺度时空变化的综合分析显示,1980—2018年,大约16.5 万km2的农业用地受到盐碱化的影响[3],并且由于气候变化,预计未来80年世界许多地区的土壤盐渍化面积将增加[4].土壤盐渍化首先会导致植物经历渗透胁迫,进而引起细胞脱水,而过量的Na+积累则会破坏离子平衡并引发严重的氧化胁迫[5].在盐碱环境中,盐生植物会产生一系列形态、生理、代谢和分子水平的变化,使其能够在盐渍土壤中完成其生命周期[5].荒漠地区的植物通过多种形态和生理反应适应干旱、盐碱及流沙环境.它们通过选择性离子吸收、离子稳态调节和增强抗氧化能力等内在生理适应机制,在荒漠与半荒漠地区生存和扩展[6]. ...
... 土壤盐渍化是全球普遍存在的环境与资源问题[3-4],会导致土地利用率和生物多样性的降低.很多植物如碱蓬(Suaeda glauca)、白刺(Nitraria tangutorum)、柽柳(Tamarix chinensis)、沙枣(Elaeagnus angustifolia)等常分布于盐碱地[23].盐渍土的盐含量通常用电导率(EC)来表示,当土壤电导率超过4 dS·m-1时,通常认为土壤已经盐渍化,这可能会对植物造成损伤或导致植株根系死亡[24].本研究的结果说明,3种盐爪爪属植物在连古城自然保护区分布区域的土壤都是盐渍土,这3种植物在盐渍生境中能形成优势群落或称为优势种. ...
Negative correlation between soil salinity and soil organic carbon variability
2
2024
... 盐渍化土壤中存在较高浓度的可溶性盐离子,超过了植物所能耐受的阈值范围,从而限制了绝大多数粮食作物的生长和发育[1-2].对过去40年全球范围土壤盐碱化大尺度时空变化的综合分析显示,1980—2018年,大约16.5 万km2的农业用地受到盐碱化的影响[3],并且由于气候变化,预计未来80年世界许多地区的土壤盐渍化面积将增加[4].土壤盐渍化首先会导致植物经历渗透胁迫,进而引起细胞脱水,而过量的Na+积累则会破坏离子平衡并引发严重的氧化胁迫[5].在盐碱环境中,盐生植物会产生一系列形态、生理、代谢和分子水平的变化,使其能够在盐渍土壤中完成其生命周期[5].荒漠地区的植物通过多种形态和生理反应适应干旱、盐碱及流沙环境.它们通过选择性离子吸收、离子稳态调节和增强抗氧化能力等内在生理适应机制,在荒漠与半荒漠地区生存和扩展[6]. ...
... 土壤盐渍化是全球普遍存在的环境与资源问题[3-4],会导致土地利用率和生物多样性的降低.很多植物如碱蓬(Suaeda glauca)、白刺(Nitraria tangutorum)、柽柳(Tamarix chinensis)、沙枣(Elaeagnus angustifolia)等常分布于盐碱地[23].盐渍土的盐含量通常用电导率(EC)来表示,当土壤电导率超过4 dS·m-1时,通常认为土壤已经盐渍化,这可能会对植物造成损伤或导致植株根系死亡[24].本研究的结果说明,3种盐爪爪属植物在连古城自然保护区分布区域的土壤都是盐渍土,这3种植物在盐渍生境中能形成优势群落或称为优势种. ...
Elucidating the molecular mechanisms mediating plant salt-stress responses
2
2018
... 盐渍化土壤中存在较高浓度的可溶性盐离子,超过了植物所能耐受的阈值范围,从而限制了绝大多数粮食作物的生长和发育[1-2].对过去40年全球范围土壤盐碱化大尺度时空变化的综合分析显示,1980—2018年,大约16.5 万km2的农业用地受到盐碱化的影响[3],并且由于气候变化,预计未来80年世界许多地区的土壤盐渍化面积将增加[4].土壤盐渍化首先会导致植物经历渗透胁迫,进而引起细胞脱水,而过量的Na+积累则会破坏离子平衡并引发严重的氧化胁迫[5].在盐碱环境中,盐生植物会产生一系列形态、生理、代谢和分子水平的变化,使其能够在盐渍土壤中完成其生命周期[5].荒漠地区的植物通过多种形态和生理反应适应干旱、盐碱及流沙环境.它们通过选择性离子吸收、离子稳态调节和增强抗氧化能力等内在生理适应机制,在荒漠与半荒漠地区生存和扩展[6]. ...
... [5].荒漠地区的植物通过多种形态和生理反应适应干旱、盐碱及流沙环境.它们通过选择性离子吸收、离子稳态调节和增强抗氧化能力等内在生理适应机制,在荒漠与半荒漠地区生存和扩展[6]. ...
Enzymatic activity in halophytes
1
2021
... 盐渍化土壤中存在较高浓度的可溶性盐离子,超过了植物所能耐受的阈值范围,从而限制了绝大多数粮食作物的生长和发育[1-2].对过去40年全球范围土壤盐碱化大尺度时空变化的综合分析显示,1980—2018年,大约16.5 万km2的农业用地受到盐碱化的影响[3],并且由于气候变化,预计未来80年世界许多地区的土壤盐渍化面积将增加[4].土壤盐渍化首先会导致植物经历渗透胁迫,进而引起细胞脱水,而过量的Na+积累则会破坏离子平衡并引发严重的氧化胁迫[5].在盐碱环境中,盐生植物会产生一系列形态、生理、代谢和分子水平的变化,使其能够在盐渍土壤中完成其生命周期[5].荒漠地区的植物通过多种形态和生理反应适应干旱、盐碱及流沙环境.它们通过选择性离子吸收、离子稳态调节和增强抗氧化能力等内在生理适应机制,在荒漠与半荒漠地区生存和扩展[6]. ...
Microbiome structure and function in rhizosphere of Jerusalem artichoke grown in saline land
1
2020
... 植物相关的微生物群落被视为植物的第二基因组,展现出丰富的功能多样性和强大的环境适应能力[2] .促进植物生长的根际细菌(PGPR)具有出色的根部定殖能力,盐生植物的特殊根部微生物群中包含大量的植物根际促生菌[7-8].与对照组相比,在盐处理的灭菌土壤中生长的盐生植物海马齿(Sesuvium portulacastrum)根际土壤优势菌群为蜡样芽孢杆菌(Bacillus cereus)、嗜水气单胞菌(Aeromonas hydrophila)、绿脓杆菌(Pseudomonas aeruginosa)、Corynebacterium xerosis和大肠杆菌[9].研究表明,一些根际细菌能够缓解高盐对农作物生长的影响,并促进植物对盐碱环境的适应[10-13]:Pseudomonas pseudoalcaligenes和Bacillus subtilis通过一系列生理调节过程显著改善了大豆在高盐胁迫下的生长[13];Piriformospora indica提高了盐胁迫番茄植株的鲜重和干重,并且在盐胁迫下Piriformospora indica定殖提高了番茄叶片的叶绿素b、吲哚乙酸、过氧化氢酶和超氧化物歧化酶的活性[14];将玉米根际细菌Bacillus sp. MT7引入番茄根际已被证明能显著增强番茄的盐耐受性[14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
干旱区盐碱土微生物特征及其影响因素研究进展
1
2024
... 植物相关的微生物群落被视为植物的第二基因组,展现出丰富的功能多样性和强大的环境适应能力[2] .促进植物生长的根际细菌(PGPR)具有出色的根部定殖能力,盐生植物的特殊根部微生物群中包含大量的植物根际促生菌[7-8].与对照组相比,在盐处理的灭菌土壤中生长的盐生植物海马齿(Sesuvium portulacastrum)根际土壤优势菌群为蜡样芽孢杆菌(Bacillus cereus)、嗜水气单胞菌(Aeromonas hydrophila)、绿脓杆菌(Pseudomonas aeruginosa)、Corynebacterium xerosis和大肠杆菌[9].研究表明,一些根际细菌能够缓解高盐对农作物生长的影响,并促进植物对盐碱环境的适应[10-13]:Pseudomonas pseudoalcaligenes和Bacillus subtilis通过一系列生理调节过程显著改善了大豆在高盐胁迫下的生长[13];Piriformospora indica提高了盐胁迫番茄植株的鲜重和干重,并且在盐胁迫下Piriformospora indica定殖提高了番茄叶片的叶绿素b、吲哚乙酸、过氧化氢酶和超氧化物歧化酶的活性[14];将玉米根际细菌Bacillus sp. MT7引入番茄根际已被证明能显著增强番茄的盐耐受性[14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
The role of rhizobacteria in salinity effects on biochemical constituents of the halophyte Sesuvium portulacastrum
1
2012
... 植物相关的微生物群落被视为植物的第二基因组,展现出丰富的功能多样性和强大的环境适应能力[2] .促进植物生长的根际细菌(PGPR)具有出色的根部定殖能力,盐生植物的特殊根部微生物群中包含大量的植物根际促生菌[7-8].与对照组相比,在盐处理的灭菌土壤中生长的盐生植物海马齿(Sesuvium portulacastrum)根际土壤优势菌群为蜡样芽孢杆菌(Bacillus cereus)、嗜水气单胞菌(Aeromonas hydrophila)、绿脓杆菌(Pseudomonas aeruginosa)、Corynebacterium xerosis和大肠杆菌[9].研究表明,一些根际细菌能够缓解高盐对农作物生长的影响,并促进植物对盐碱环境的适应[10-13]:Pseudomonas pseudoalcaligenes和Bacillus subtilis通过一系列生理调节过程显著改善了大豆在高盐胁迫下的生长[13];Piriformospora indica提高了盐胁迫番茄植株的鲜重和干重,并且在盐胁迫下Piriformospora indica定殖提高了番茄叶片的叶绿素b、吲哚乙酸、过氧化氢酶和超氧化物歧化酶的活性[14];将玉米根际细菌Bacillus sp. MT7引入番茄根际已被证明能显著增强番茄的盐耐受性[14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
Piriformospora indica alters Na+/K+ homeostasis,antioxidant enzymes and LeNHX1 expression of greenhouse tomato grown under salt stress
1
2019
... 植物相关的微生物群落被视为植物的第二基因组,展现出丰富的功能多样性和强大的环境适应能力[2] .促进植物生长的根际细菌(PGPR)具有出色的根部定殖能力,盐生植物的特殊根部微生物群中包含大量的植物根际促生菌[7-8].与对照组相比,在盐处理的灭菌土壤中生长的盐生植物海马齿(Sesuvium portulacastrum)根际土壤优势菌群为蜡样芽孢杆菌(Bacillus cereus)、嗜水气单胞菌(Aeromonas hydrophila)、绿脓杆菌(Pseudomonas aeruginosa)、Corynebacterium xerosis和大肠杆菌[9].研究表明,一些根际细菌能够缓解高盐对农作物生长的影响,并促进植物对盐碱环境的适应[10-13]:Pseudomonas pseudoalcaligenes和Bacillus subtilis通过一系列生理调节过程显著改善了大豆在高盐胁迫下的生长[13];Piriformospora indica提高了盐胁迫番茄植株的鲜重和干重,并且在盐胁迫下Piriformospora indica定殖提高了番茄叶片的叶绿素b、吲哚乙酸、过氧化氢酶和超氧化物歧化酶的活性[14];将玉米根际细菌Bacillus sp. MT7引入番茄根际已被证明能显著增强番茄的盐耐受性[14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
Salt stress alleviation in citrus plants by plant growth-promoting rhizobacteria Pseudomonas putida and Novosphingobium sp
0
2018
Phytobeneficial bacteria improve saline stress tolerance in Vicia faba and modulate microbial interaction network
0
2020
Microbially mediated plant salt tolerance and microbiome-based solutions for saline agriculture
2
2016
... 植物相关的微生物群落被视为植物的第二基因组,展现出丰富的功能多样性和强大的环境适应能力[2] .促进植物生长的根际细菌(PGPR)具有出色的根部定殖能力,盐生植物的特殊根部微生物群中包含大量的植物根际促生菌[7-8].与对照组相比,在盐处理的灭菌土壤中生长的盐生植物海马齿(Sesuvium portulacastrum)根际土壤优势菌群为蜡样芽孢杆菌(Bacillus cereus)、嗜水气单胞菌(Aeromonas hydrophila)、绿脓杆菌(Pseudomonas aeruginosa)、Corynebacterium xerosis和大肠杆菌[9].研究表明,一些根际细菌能够缓解高盐对农作物生长的影响,并促进植物对盐碱环境的适应[10-13]:Pseudomonas pseudoalcaligenes和Bacillus subtilis通过一系列生理调节过程显著改善了大豆在高盐胁迫下的生长[13];Piriformospora indica提高了盐胁迫番茄植株的鲜重和干重,并且在盐胁迫下Piriformospora indica定殖提高了番茄叶片的叶绿素b、吲哚乙酸、过氧化氢酶和超氧化物歧化酶的活性[14];将玉米根际细菌Bacillus sp. MT7引入番茄根际已被证明能显著增强番茄的盐耐受性[14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
... [13];Piriformospora indica提高了盐胁迫番茄植株的鲜重和干重,并且在盐胁迫下Piriformospora indica定殖提高了番茄叶片的叶绿素b、吲哚乙酸、过氧化氢酶和超氧化物歧化酶的活性[14];将玉米根际细菌Bacillus sp. MT7引入番茄根际已被证明能显著增强番茄的盐耐受性[14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
Cross-competence and affectivity of maize rhizosphere bacteria Bacillus sp.MT7 in tomato rhizosphere
2
2020
... 植物相关的微生物群落被视为植物的第二基因组,展现出丰富的功能多样性和强大的环境适应能力[2] .促进植物生长的根际细菌(PGPR)具有出色的根部定殖能力,盐生植物的特殊根部微生物群中包含大量的植物根际促生菌[7-8].与对照组相比,在盐处理的灭菌土壤中生长的盐生植物海马齿(Sesuvium portulacastrum)根际土壤优势菌群为蜡样芽孢杆菌(Bacillus cereus)、嗜水气单胞菌(Aeromonas hydrophila)、绿脓杆菌(Pseudomonas aeruginosa)、Corynebacterium xerosis和大肠杆菌[9].研究表明,一些根际细菌能够缓解高盐对农作物生长的影响,并促进植物对盐碱环境的适应[10-13]:Pseudomonas pseudoalcaligenes和Bacillus subtilis通过一系列生理调节过程显著改善了大豆在高盐胁迫下的生长[13];Piriformospora indica提高了盐胁迫番茄植株的鲜重和干重,并且在盐胁迫下Piriformospora indica定殖提高了番茄叶片的叶绿素b、吲哚乙酸、过氧化氢酶和超氧化物歧化酶的活性[14];将玉米根际细菌Bacillus sp. MT7引入番茄根际已被证明能显著增强番茄的盐耐受性[14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
... [14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
Do ectoparasites on fish gills ‘talk’ with gut microbiota far away?
1
2023
... 植物相关的微生物群落被视为植物的第二基因组,展现出丰富的功能多样性和强大的环境适应能力[2] .促进植物生长的根际细菌(PGPR)具有出色的根部定殖能力,盐生植物的特殊根部微生物群中包含大量的植物根际促生菌[7-8].与对照组相比,在盐处理的灭菌土壤中生长的盐生植物海马齿(Sesuvium portulacastrum)根际土壤优势菌群为蜡样芽孢杆菌(Bacillus cereus)、嗜水气单胞菌(Aeromonas hydrophila)、绿脓杆菌(Pseudomonas aeruginosa)、Corynebacterium xerosis和大肠杆菌[9].研究表明,一些根际细菌能够缓解高盐对农作物生长的影响,并促进植物对盐碱环境的适应[10-13]:Pseudomonas pseudoalcaligenes和Bacillus subtilis通过一系列生理调节过程显著改善了大豆在高盐胁迫下的生长[13];Piriformospora indica提高了盐胁迫番茄植株的鲜重和干重,并且在盐胁迫下Piriformospora indica定殖提高了番茄叶片的叶绿素b、吲哚乙酸、过氧化氢酶和超氧化物歧化酶的活性[14];将玉米根际细菌Bacillus sp. MT7引入番茄根际已被证明能显著增强番茄的盐耐受性[14];根际微生物群落还可以提升葡萄藤对盐胁迫的耐受性,不同品种的葡萄藤对此表现出不同的响应[15]. ...
中国的盐生植物
1
1999
... 盐爪爪属(Kalidium)植物是稀盐型真盐盐生植物[16],通过叶的肉质化来减缓植物体内的盐分,包含6个种——尖叶盐爪爪(Kalidium cuspidatum)、细枝盐爪爪(Kalidium gracile)、盐爪爪(Kalidium foliatum)、黄毛头(Kalidium sinicum)、里海盐爪爪(Kalidium caspicum)以及圆叶盐爪爪(Kalidium schrenkianum)[17-20].盐爪爪属植物具有较宽的耐盐幅度和较低的耐盐下限[20].在中国,这些盐生植物主要分布在荒漠与半荒漠的盐碱地区[17-21].在盐爪爪属植物广泛分布的区域,这6种植物作为天然饲料和牧草,成为当地牧民冬季补饲牲畜的重要食物来源.这些植物的生态适应性使其能够在盐碱环境中生长,为牲畜提供了丰富的营养,进而在维持当地农、牧业可持续发展方面发挥了关键作用[18,20].民勤连古城国家级自然保护区是中国典型的荒漠生态类型保护区,仅有3种盐爪爪属植物(盐爪爪、细枝盐爪爪和黄毛头)作为优势种群呈现片段化分布,不同物种分布的区域不重叠.然而,盐生植物盐爪爪属抗盐性与微生物群落结构之间相互作用,以及与土壤理化性质的关系尚不清楚,这种片段化分布是否与土壤异质性相关? ...
Identification of Kalidium species (Chenopodiaceae) by DNA barcoding
3
2017
... 盐爪爪属(Kalidium)植物是稀盐型真盐盐生植物[16],通过叶的肉质化来减缓植物体内的盐分,包含6个种——尖叶盐爪爪(Kalidium cuspidatum)、细枝盐爪爪(Kalidium gracile)、盐爪爪(Kalidium foliatum)、黄毛头(Kalidium sinicum)、里海盐爪爪(Kalidium caspicum)以及圆叶盐爪爪(Kalidium schrenkianum)[17-20].盐爪爪属植物具有较宽的耐盐幅度和较低的耐盐下限[20].在中国,这些盐生植物主要分布在荒漠与半荒漠的盐碱地区[17-21].在盐爪爪属植物广泛分布的区域,这6种植物作为天然饲料和牧草,成为当地牧民冬季补饲牲畜的重要食物来源.这些植物的生态适应性使其能够在盐碱环境中生长,为牲畜提供了丰富的营养,进而在维持当地农、牧业可持续发展方面发挥了关键作用[18,20].民勤连古城国家级自然保护区是中国典型的荒漠生态类型保护区,仅有3种盐爪爪属植物(盐爪爪、细枝盐爪爪和黄毛头)作为优势种群呈现片段化分布,不同物种分布的区域不重叠.然而,盐生植物盐爪爪属抗盐性与微生物群落结构之间相互作用,以及与土壤理化性质的关系尚不清楚,这种片段化分布是否与土壤异质性相关? ...
... [17-21].在盐爪爪属植物广泛分布的区域,这6种植物作为天然饲料和牧草,成为当地牧民冬季补饲牲畜的重要食物来源.这些植物的生态适应性使其能够在盐碱环境中生长,为牲畜提供了丰富的营养,进而在维持当地农、牧业可持续发展方面发挥了关键作用[18,20].民勤连古城国家级自然保护区是中国典型的荒漠生态类型保护区,仅有3种盐爪爪属植物(盐爪爪、细枝盐爪爪和黄毛头)作为优势种群呈现片段化分布,不同物种分布的区域不重叠.然而,盐生植物盐爪爪属抗盐性与微生物群落结构之间相互作用,以及与土壤理化性质的关系尚不清楚,这种片段化分布是否与土壤异质性相关? ...
... 因此,基于我们在前期野外调查的基础[17-20],收集了3种植物在民勤连古城国家级自然保护区的样品以及根际土壤样品,对根际土壤进行了16S rDNA测序和土壤离子测定,分析了3种盐爪爪属植物生长区域的植物根际细菌群落多样性与土壤理化性质之间的相关性. ...
Soil chemical properties strongly influence distributions of six Kalidium Species in Northwest China
5
2022
... 盐爪爪属(Kalidium)植物是稀盐型真盐盐生植物[16],通过叶的肉质化来减缓植物体内的盐分,包含6个种——尖叶盐爪爪(Kalidium cuspidatum)、细枝盐爪爪(Kalidium gracile)、盐爪爪(Kalidium foliatum)、黄毛头(Kalidium sinicum)、里海盐爪爪(Kalidium caspicum)以及圆叶盐爪爪(Kalidium schrenkianum)[17-20].盐爪爪属植物具有较宽的耐盐幅度和较低的耐盐下限[20].在中国,这些盐生植物主要分布在荒漠与半荒漠的盐碱地区[17-21].在盐爪爪属植物广泛分布的区域,这6种植物作为天然饲料和牧草,成为当地牧民冬季补饲牲畜的重要食物来源.这些植物的生态适应性使其能够在盐碱环境中生长,为牲畜提供了丰富的营养,进而在维持当地农、牧业可持续发展方面发挥了关键作用[18,20].民勤连古城国家级自然保护区是中国典型的荒漠生态类型保护区,仅有3种盐爪爪属植物(盐爪爪、细枝盐爪爪和黄毛头)作为优势种群呈现片段化分布,不同物种分布的区域不重叠.然而,盐生植物盐爪爪属抗盐性与微生物群落结构之间相互作用,以及与土壤理化性质的关系尚不清楚,这种片段化分布是否与土壤异质性相关? ...
... 按照Liu等[18]的方法,对于土壤及植物样品进行处理,分析土壤的pH值和总含盐量.将取回的土壤样品风干后过2 mm筛,并按土水比1/5制备待测液.用电导率仪(DDSJ-318)对土壤中的电导率(单位:mS·cm-1)进行测定.总含盐量根据线性回归方程算出,公式为y=0.0159x,R2=0.9811(x为所测的电导率值,y为总含盐量).土壤pH用电位法pH计(pHS-25)测定.使用美国戴安(Dionex)公司的多功能分析型离子色谱仪(ICS-5000)测定土壤样品中钠离子(Na⁺)、钾离子(K⁺)、钙离子(Ca²⁺)、镁离子(Mg²⁺)、碳酸根离子(CO)、氯离子(Cl⁻)、硝酸根离子(NO)及硫酸根离子(SO)的含量.所用的阴离子柱和阳离子柱分别为AS11-HC和CS12A,配套的保护柱为AG11-HC和CG12A.根据样品浓度选择进样量为25 μL,淋洗液使用30 mM的NaOH和20 mM的甲基磺酸.在分析所有样品之前,均进行了空白测试,且测试结果低于检测限.通过对标准样品的重复测试,计算得出的数据误差控制在10%以内,以满足数据精度的要求.土壤有机碳(Soil Organic Carbon,SOC)通过SKALAR碳分析仪进行测定,土壤有机质(Soil organic matter,SOM)通过SOM=1.724×SOC算出. ...
... 盐爪爪属中的不同物种对盐分的适应性存在显著差异,导致了它们在分布上的明显差异[18-20].盐爪爪属的6个种在其分布地区的土壤中,平均总含盐量较高,但其变化范围却很广[18,20].连古城自然保护区生态环境复杂且独特[25],土壤盐分的集聚和分布受地下水分布差异的显著影响.地下水在这一地区的分布并不均匀,由于地形、地质和气候的多样性,不同区域的地下水位、含水层的深度以及水质存在较大差异.这些因素直接影响了土壤的水分状况和盐分的动态平衡[26].本研究调查显示,在连古城自然保护区内,同属植物的分布存在明显差异,3种植物的分布区完全不重叠,不同区域的土壤盐分含量差异显著.特别是在盐爪爪的分布区域,其土壤盐分含量(92.33 g·kg-1)明显高于其他种类,如黄毛头(13.53 g·kg-1)和细枝盐爪爪(72.85 g·kg-1)所处区域的土壤.这3种植物分布的红崖山保护站(盐爪爪)和南湖保护站(细枝盐爪爪)的盐渍土以硫酸盐-氯化物为主,花儿园保护站(黄毛头)则以氯化物为主,这与之前的研究结果相符[18,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
... [18,20].连古城自然保护区生态环境复杂且独特[25],土壤盐分的集聚和分布受地下水分布差异的显著影响.地下水在这一地区的分布并不均匀,由于地形、地质和气候的多样性,不同区域的地下水位、含水层的深度以及水质存在较大差异.这些因素直接影响了土壤的水分状况和盐分的动态平衡[26].本研究调查显示,在连古城自然保护区内,同属植物的分布存在明显差异,3种植物的分布区完全不重叠,不同区域的土壤盐分含量差异显著.特别是在盐爪爪的分布区域,其土壤盐分含量(92.33 g·kg-1)明显高于其他种类,如黄毛头(13.53 g·kg-1)和细枝盐爪爪(72.85 g·kg-1)所处区域的土壤.这3种植物分布的红崖山保护站(盐爪爪)和南湖保护站(细枝盐爪爪)的盐渍土以硫酸盐-氯化物为主,花儿园保护站(黄毛头)则以氯化物为主,这与之前的研究结果相符[18,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
... [18,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
六种不同盐爪爪属(Kalidium)植物的抗盐差异性分析
7
2018
... 盐爪爪属(Kalidium)植物是稀盐型真盐盐生植物[16],通过叶的肉质化来减缓植物体内的盐分,包含6个种——尖叶盐爪爪(Kalidium cuspidatum)、细枝盐爪爪(Kalidium gracile)、盐爪爪(Kalidium foliatum)、黄毛头(Kalidium sinicum)、里海盐爪爪(Kalidium caspicum)以及圆叶盐爪爪(Kalidium schrenkianum)[17-20].盐爪爪属植物具有较宽的耐盐幅度和较低的耐盐下限[20].在中国,这些盐生植物主要分布在荒漠与半荒漠的盐碱地区[17-21].在盐爪爪属植物广泛分布的区域,这6种植物作为天然饲料和牧草,成为当地牧民冬季补饲牲畜的重要食物来源.这些植物的生态适应性使其能够在盐碱环境中生长,为牲畜提供了丰富的营养,进而在维持当地农、牧业可持续发展方面发挥了关键作用[18,20].民勤连古城国家级自然保护区是中国典型的荒漠生态类型保护区,仅有3种盐爪爪属植物(盐爪爪、细枝盐爪爪和黄毛头)作为优势种群呈现片段化分布,不同物种分布的区域不重叠.然而,盐生植物盐爪爪属抗盐性与微生物群落结构之间相互作用,以及与土壤理化性质的关系尚不清楚,这种片段化分布是否与土壤异质性相关? ...
... [20].在中国,这些盐生植物主要分布在荒漠与半荒漠的盐碱地区[17-21].在盐爪爪属植物广泛分布的区域,这6种植物作为天然饲料和牧草,成为当地牧民冬季补饲牲畜的重要食物来源.这些植物的生态适应性使其能够在盐碱环境中生长,为牲畜提供了丰富的营养,进而在维持当地农、牧业可持续发展方面发挥了关键作用[18,20].民勤连古城国家级自然保护区是中国典型的荒漠生态类型保护区,仅有3种盐爪爪属植物(盐爪爪、细枝盐爪爪和黄毛头)作为优势种群呈现片段化分布,不同物种分布的区域不重叠.然而,盐生植物盐爪爪属抗盐性与微生物群落结构之间相互作用,以及与土壤理化性质的关系尚不清楚,这种片段化分布是否与土壤异质性相关? ...
... ,20].民勤连古城国家级自然保护区是中国典型的荒漠生态类型保护区,仅有3种盐爪爪属植物(盐爪爪、细枝盐爪爪和黄毛头)作为优势种群呈现片段化分布,不同物种分布的区域不重叠.然而,盐生植物盐爪爪属抗盐性与微生物群落结构之间相互作用,以及与土壤理化性质的关系尚不清楚,这种片段化分布是否与土壤异质性相关? ...
... 因此,基于我们在前期野外调查的基础[17-20],收集了3种植物在民勤连古城国家级自然保护区的样品以及根际土壤样品,对根际土壤进行了16S rDNA测序和土壤离子测定,分析了3种盐爪爪属植物生长区域的植物根际细菌群落多样性与土壤理化性质之间的相关性. ...
... 盐爪爪属中的不同物种对盐分的适应性存在显著差异,导致了它们在分布上的明显差异[18-20].盐爪爪属的6个种在其分布地区的土壤中,平均总含盐量较高,但其变化范围却很广[18,20].连古城自然保护区生态环境复杂且独特[25],土壤盐分的集聚和分布受地下水分布差异的显著影响.地下水在这一地区的分布并不均匀,由于地形、地质和气候的多样性,不同区域的地下水位、含水层的深度以及水质存在较大差异.这些因素直接影响了土壤的水分状况和盐分的动态平衡[26].本研究调查显示,在连古城自然保护区内,同属植物的分布存在明显差异,3种植物的分布区完全不重叠,不同区域的土壤盐分含量差异显著.特别是在盐爪爪的分布区域,其土壤盐分含量(92.33 g·kg-1)明显高于其他种类,如黄毛头(13.53 g·kg-1)和细枝盐爪爪(72.85 g·kg-1)所处区域的土壤.这3种植物分布的红崖山保护站(盐爪爪)和南湖保护站(细枝盐爪爪)的盐渍土以硫酸盐-氯化物为主,花儿园保护站(黄毛头)则以氯化物为主,这与之前的研究结果相符[18,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
... ,20].连古城自然保护区生态环境复杂且独特[25],土壤盐分的集聚和分布受地下水分布差异的显著影响.地下水在这一地区的分布并不均匀,由于地形、地质和气候的多样性,不同区域的地下水位、含水层的深度以及水质存在较大差异.这些因素直接影响了土壤的水分状况和盐分的动态平衡[26].本研究调查显示,在连古城自然保护区内,同属植物的分布存在明显差异,3种植物的分布区完全不重叠,不同区域的土壤盐分含量差异显著.特别是在盐爪爪的分布区域,其土壤盐分含量(92.33 g·kg-1)明显高于其他种类,如黄毛头(13.53 g·kg-1)和细枝盐爪爪(72.85 g·kg-1)所处区域的土壤.这3种植物分布的红崖山保护站(盐爪爪)和南湖保护站(细枝盐爪爪)的盐渍土以硫酸盐-氯化物为主,花儿园保护站(黄毛头)则以氯化物为主,这与之前的研究结果相符[18,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
... ,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
1
1979
... 盐爪爪属(Kalidium)植物是稀盐型真盐盐生植物[16],通过叶的肉质化来减缓植物体内的盐分,包含6个种——尖叶盐爪爪(Kalidium cuspidatum)、细枝盐爪爪(Kalidium gracile)、盐爪爪(Kalidium foliatum)、黄毛头(Kalidium sinicum)、里海盐爪爪(Kalidium caspicum)以及圆叶盐爪爪(Kalidium schrenkianum)[17-20].盐爪爪属植物具有较宽的耐盐幅度和较低的耐盐下限[20].在中国,这些盐生植物主要分布在荒漠与半荒漠的盐碱地区[17-21].在盐爪爪属植物广泛分布的区域,这6种植物作为天然饲料和牧草,成为当地牧民冬季补饲牲畜的重要食物来源.这些植物的生态适应性使其能够在盐碱环境中生长,为牲畜提供了丰富的营养,进而在维持当地农、牧业可持续发展方面发挥了关键作用[18,20].民勤连古城国家级自然保护区是中国典型的荒漠生态类型保护区,仅有3种盐爪爪属植物(盐爪爪、细枝盐爪爪和黄毛头)作为优势种群呈现片段化分布,不同物种分布的区域不重叠.然而,盐生植物盐爪爪属抗盐性与微生物群落结构之间相互作用,以及与土壤理化性质的关系尚不清楚,这种片段化分布是否与土壤异质性相关? ...
1960-2021年民勤沙区10种典型荒漠植物种群变化特征
1
2023
... 民勤连古城国家级自然保护区位于河西走廊东部、石羊河流域下游地区的甘肃省民勤县的荒漠区域内,地理位置在38°10′08″—39°09′10″N、103°30′00″—103°57′40″E,是中国面积最大的荒漠生态类型国家级自然保护区(图1).保护区东北部被腾格里沙漠包围,西北部有巴丹吉林沙漠环绕,呈半环形包围民勤绿洲.连古城自然保护区海拔在1 180~1 550 m,地面被沙层覆盖,新月形沙丘链及沙垄比重较大(图1),其中无植被覆盖的流沙每年移动范围可达4~10 m.保护区现有天然林面积约2.3×105 hm2,主要灌木群落有红砂群落、盐爪爪群落、黄毛头群落、细枝盐爪爪群落、沙拐枣群落、柽柳群落、白刺群落等[22]. ...
沙枣对氯化钠和硫酸钠胁迫差异性响应的生理机制
1
2013
... 土壤盐渍化是全球普遍存在的环境与资源问题[3-4],会导致土地利用率和生物多样性的降低.很多植物如碱蓬(Suaeda glauca)、白刺(Nitraria tangutorum)、柽柳(Tamarix chinensis)、沙枣(Elaeagnus angustifolia)等常分布于盐碱地[23].盐渍土的盐含量通常用电导率(EC)来表示,当土壤电导率超过4 dS·m-1时,通常认为土壤已经盐渍化,这可能会对植物造成损伤或导致植株根系死亡[24].本研究的结果说明,3种盐爪爪属植物在连古城自然保护区分布区域的土壤都是盐渍土,这3种植物在盐渍生境中能形成优势群落或称为优势种. ...
Genes and salt tolerance:bringing them together
1
2005
... 土壤盐渍化是全球普遍存在的环境与资源问题[3-4],会导致土地利用率和生物多样性的降低.很多植物如碱蓬(Suaeda glauca)、白刺(Nitraria tangutorum)、柽柳(Tamarix chinensis)、沙枣(Elaeagnus angustifolia)等常分布于盐碱地[23].盐渍土的盐含量通常用电导率(EC)来表示,当土壤电导率超过4 dS·m-1时,通常认为土壤已经盐渍化,这可能会对植物造成损伤或导致植株根系死亡[24].本研究的结果说明,3种盐爪爪属植物在连古城自然保护区分布区域的土壤都是盐渍土,这3种植物在盐渍生境中能形成优势群落或称为优势种. ...
民勤连古城自然保护区生态系统稳定性研究
1
2020
... 盐爪爪属中的不同物种对盐分的适应性存在显著差异,导致了它们在分布上的明显差异[18-20].盐爪爪属的6个种在其分布地区的土壤中,平均总含盐量较高,但其变化范围却很广[18,20].连古城自然保护区生态环境复杂且独特[25],土壤盐分的集聚和分布受地下水分布差异的显著影响.地下水在这一地区的分布并不均匀,由于地形、地质和气候的多样性,不同区域的地下水位、含水层的深度以及水质存在较大差异.这些因素直接影响了土壤的水分状况和盐分的动态平衡[26].本研究调查显示,在连古城自然保护区内,同属植物的分布存在明显差异,3种植物的分布区完全不重叠,不同区域的土壤盐分含量差异显著.特别是在盐爪爪的分布区域,其土壤盐分含量(92.33 g·kg-1)明显高于其他种类,如黄毛头(13.53 g·kg-1)和细枝盐爪爪(72.85 g·kg-1)所处区域的土壤.这3种植物分布的红崖山保护站(盐爪爪)和南湖保护站(细枝盐爪爪)的盐渍土以硫酸盐-氯化物为主,花儿园保护站(黄毛头)则以氯化物为主,这与之前的研究结果相符[18,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
不同地下水埋深对砂土灌区土壤表层盐分累积的影响
1
2024
... 盐爪爪属中的不同物种对盐分的适应性存在显著差异,导致了它们在分布上的明显差异[18-20].盐爪爪属的6个种在其分布地区的土壤中,平均总含盐量较高,但其变化范围却很广[18,20].连古城自然保护区生态环境复杂且独特[25],土壤盐分的集聚和分布受地下水分布差异的显著影响.地下水在这一地区的分布并不均匀,由于地形、地质和气候的多样性,不同区域的地下水位、含水层的深度以及水质存在较大差异.这些因素直接影响了土壤的水分状况和盐分的动态平衡[26].本研究调查显示,在连古城自然保护区内,同属植物的分布存在明显差异,3种植物的分布区完全不重叠,不同区域的土壤盐分含量差异显著.特别是在盐爪爪的分布区域,其土壤盐分含量(92.33 g·kg-1)明显高于其他种类,如黄毛头(13.53 g·kg-1)和细枝盐爪爪(72.85 g·kg-1)所处区域的土壤.这3种植物分布的红崖山保护站(盐爪爪)和南湖保护站(细枝盐爪爪)的盐渍土以硫酸盐-氯化物为主,花儿园保护站(黄毛头)则以氯化物为主,这与之前的研究结果相符[18,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
Mechanisms of plant responses and adaptation to soil salinity
1
2020
... 盐爪爪属中的不同物种对盐分的适应性存在显著差异,导致了它们在分布上的明显差异[18-20].盐爪爪属的6个种在其分布地区的土壤中,平均总含盐量较高,但其变化范围却很广[18,20].连古城自然保护区生态环境复杂且独特[25],土壤盐分的集聚和分布受地下水分布差异的显著影响.地下水在这一地区的分布并不均匀,由于地形、地质和气候的多样性,不同区域的地下水位、含水层的深度以及水质存在较大差异.这些因素直接影响了土壤的水分状况和盐分的动态平衡[26].本研究调查显示,在连古城自然保护区内,同属植物的分布存在明显差异,3种植物的分布区完全不重叠,不同区域的土壤盐分含量差异显著.特别是在盐爪爪的分布区域,其土壤盐分含量(92.33 g·kg-1)明显高于其他种类,如黄毛头(13.53 g·kg-1)和细枝盐爪爪(72.85 g·kg-1)所处区域的土壤.这3种植物分布的红崖山保护站(盐爪爪)和南湖保护站(细枝盐爪爪)的盐渍土以硫酸盐-氯化物为主,花儿园保护站(黄毛头)则以氯化物为主,这与之前的研究结果相符[18,20],也与土壤中主要离子(如Na+、Cl-、Mg2+、Ca2+、SO)的浓度变化趋势吻合.3种盐生植物地上部分的离子含量呈现出与其生长地区土壤离子含量相似的分布模式,其中Na⁺和Cl⁻的比例最高.这表明,这些盐生植物主要渗透调节是依赖无机离子,尤其是Na⁺和Cl⁻,作为渗透调节物质以适应盐胁迫环境[2,27]. ...
Diversity and probiotic activities of endophytic bacteria associated with the coastal halophyte Messerschmidia sibirica
3
2019
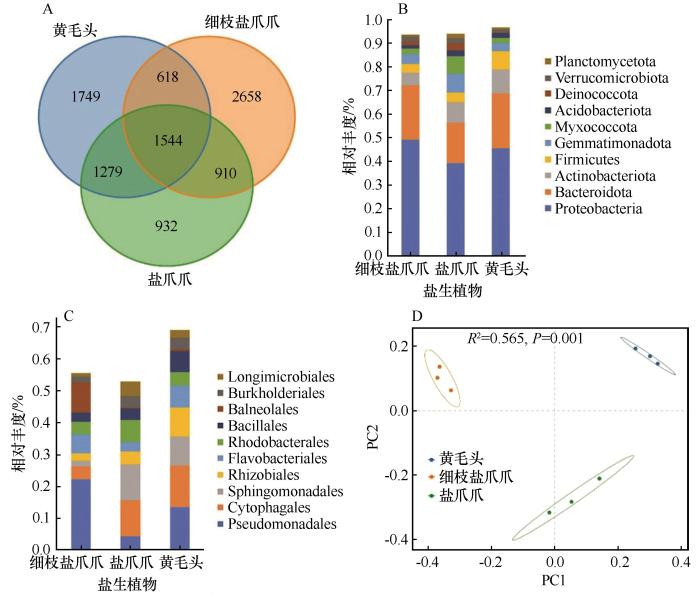
... 盐生植物因其对盐胁迫的高耐受性,被认为是PGPR优良的储藏库.例如:滨海盐生植物砂引草(Tournefortia sibirica)广泛分布在中国山东半岛,其内生细菌主要包括变形菌门、厚壁菌门和放线菌门[28];在民勤连古城自然保护区的3种盐爪爪分布区域的根际细菌群落中,丰度最高的5种优势细菌分别为变形菌门、拟杆菌门、放线菌门、芽单胞菌门和厚壁菌门.这些优势细菌与盐渍土壤微生物组的主要细菌群落存在相似性[28-30] . ...
... [28-30] . ...
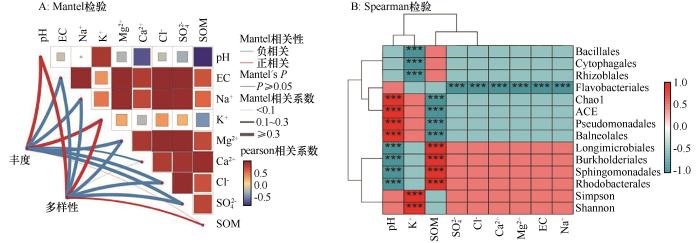
... 微生物与盐生植物之间的相互作用大多源于微生物对植物生长的促进作用,许多以前的研究已经证明,有增强植物耐盐性的PGPR富集在耐盐植物的根际区域[28].许多耐盐根际微生物已经被深入研究,揭示了它们在植物适应盐碱胁迫中的促进作用[36].例如:盐生植物补血草(Limonium sinense)招募的弯曲芽孢杆菌KLBMP 4941可以促进植物体在盐胁迫下的生长[37].在盐胁迫之外,根系微生物多样性受到多种生物和非生物因素的影响,尤其是干旱胁迫[38]、土壤类型[39]、土壤理化性质[40]和地理位置[41].同时,土壤pH值和土壤有机质与细菌群落结构存在显著相关性,且土壤pH值被广泛认为是影响微生物群落组成的因素[41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...
Microbial diversity and functions in saline soils:a review from a biogeochemical perspective
0
2024
Endophytic and rhizosphere bacteria associated with the roots of the halophyte Salicornia europaea L:community structure and metabolic potential
2
2016
... 盐生植物因其对盐胁迫的高耐受性,被认为是PGPR优良的储藏库.例如:滨海盐生植物砂引草(Tournefortia sibirica)广泛分布在中国山东半岛,其内生细菌主要包括变形菌门、厚壁菌门和放线菌门[28];在民勤连古城自然保护区的3种盐爪爪分布区域的根际细菌群落中,丰度最高的5种优势细菌分别为变形菌门、拟杆菌门、放线菌门、芽单胞菌门和厚壁菌门.这些优势细菌与盐渍土壤微生物组的主要细菌群落存在相似性[28-30] . ...
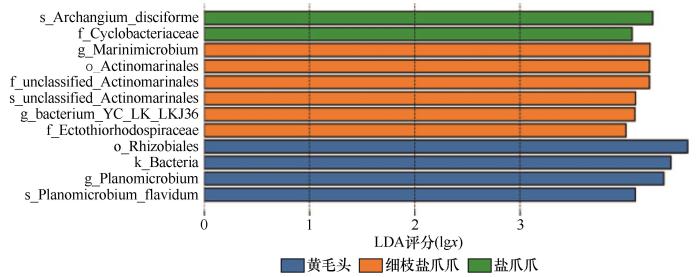
... 与土壤中一般微生物群落相比,盐生植物的根际微生物群落普遍呈现出更高的丰度,这一特征被认为与其耐盐性密切相关[35].盐角草(Salicornia europaea)根际和内生菌主要属于厚壁菌门、放线菌门和变形菌门,并且在较高盐度条件下,细菌的总生物量显著增加[30].本研究的LEfSe分析揭示了不同盐爪爪物种根际土壤中的重要生物标志物群.3种盐爪爪属植物均具有特定的生物标志物,这些标志物不仅可以作为其根际环境的指示器,还可能在植物的适应机制中发挥重要作用.例如,s_Archangium_disciforme和f_Cyclobacteriaceae被确定为盐爪爪的主要生物标志物,而g_Marinimicrobium、o_Actinomarinales和g_bacterium_YC_LK_LKJ36则是细枝盐爪爪的特征性微生物.这些发现为深入了解盐爪爪属物种的适应机制及其根际微生物的功能提供了重要线索. ...
Purines enrich root-associated Pseudomonas and improve wild soybean growth under salt stress
1
2024
... 不同盐爪爪属物种的根际微生物群落组成与结构存在显著差异.例如,细枝盐爪爪根际土壤中主要的优势菌门为变形菌门和拟杆菌门,而盐爪爪和黄毛头的根际土壤则还包含放线菌门和芽单胞菌门.PCoA分析表明不同盐爪爪属物种的根际微生物群落存在明显差异,PC1解释37.86%,PC2解释了19.79%,并且R2值为0.565, P<0.05,检验可信度很高.在盐胁迫条件下,耐盐植物野生大豆(Glycine soja)能够通过根系分泌嘌呤类物质,吸引由假单胞菌主导的微生物,这些微生物能够增强植物对盐碱环境的适应能力,从而增强植物的耐盐性[31].耐盐微生物通过多种机制实现其耐盐特性,包括维持离子平衡、调节渗透压与水分吸收、促进养分吸收,以及分泌有机酸以降低土壤pH值.这些机制共同作用,有助于植物在高盐环境中生存和发育[32].例如,假单胞菌属被发现能通过促进土壤氮循环和提升养分吸收来增强植物的耐盐性[33].这些细菌会分泌1-氨基环丙烷-1-羧酸(ACC)脱氨酶,促进根系生长,同时有效保护植物免受生物和非生物胁迫[34]. ...
Potential of plant growth-promoting rhizobacteria-plant interactions in mitigating salt stress for sustainable agriculture:a review
1
2022
... 不同盐爪爪属物种的根际微生物群落组成与结构存在显著差异.例如,细枝盐爪爪根际土壤中主要的优势菌门为变形菌门和拟杆菌门,而盐爪爪和黄毛头的根际土壤则还包含放线菌门和芽单胞菌门.PCoA分析表明不同盐爪爪属物种的根际微生物群落存在明显差异,PC1解释37.86%,PC2解释了19.79%,并且R2值为0.565, P<0.05,检验可信度很高.在盐胁迫条件下,耐盐植物野生大豆(Glycine soja)能够通过根系分泌嘌呤类物质,吸引由假单胞菌主导的微生物,这些微生物能够增强植物对盐碱环境的适应能力,从而增强植物的耐盐性[31].耐盐微生物通过多种机制实现其耐盐特性,包括维持离子平衡、调节渗透压与水分吸收、促进养分吸收,以及分泌有机酸以降低土壤pH值.这些机制共同作用,有助于植物在高盐环境中生存和发育[32].例如,假单胞菌属被发现能通过促进土壤氮循环和提升养分吸收来增强植物的耐盐性[33].这些细菌会分泌1-氨基环丙烷-1-羧酸(ACC)脱氨酶,促进根系生长,同时有效保护植物免受生物和非生物胁迫[34]. ...
Comprehensive effects of salt stress and peanut cultivars on the rhizosphere bacterial community diversity of peanut
1
2022
... 不同盐爪爪属物种的根际微生物群落组成与结构存在显著差异.例如,细枝盐爪爪根际土壤中主要的优势菌门为变形菌门和拟杆菌门,而盐爪爪和黄毛头的根际土壤则还包含放线菌门和芽单胞菌门.PCoA分析表明不同盐爪爪属物种的根际微生物群落存在明显差异,PC1解释37.86%,PC2解释了19.79%,并且R2值为0.565, P<0.05,检验可信度很高.在盐胁迫条件下,耐盐植物野生大豆(Glycine soja)能够通过根系分泌嘌呤类物质,吸引由假单胞菌主导的微生物,这些微生物能够增强植物对盐碱环境的适应能力,从而增强植物的耐盐性[31].耐盐微生物通过多种机制实现其耐盐特性,包括维持离子平衡、调节渗透压与水分吸收、促进养分吸收,以及分泌有机酸以降低土壤pH值.这些机制共同作用,有助于植物在高盐环境中生存和发育[32].例如,假单胞菌属被发现能通过促进土壤氮循环和提升养分吸收来增强植物的耐盐性[33].这些细菌会分泌1-氨基环丙烷-1-羧酸(ACC)脱氨酶,促进根系生长,同时有效保护植物免受生物和非生物胁迫[34]. ...
Phylogeny of the 1-aminocyclopropane-1-carboxylic acid deaminase-encoding gene acdS in phytobeneficial and pathogenic Proteobacteria and relation with strain biogeography
1
2006
... 不同盐爪爪属物种的根际微生物群落组成与结构存在显著差异.例如,细枝盐爪爪根际土壤中主要的优势菌门为变形菌门和拟杆菌门,而盐爪爪和黄毛头的根际土壤则还包含放线菌门和芽单胞菌门.PCoA分析表明不同盐爪爪属物种的根际微生物群落存在明显差异,PC1解释37.86%,PC2解释了19.79%,并且R2值为0.565, P<0.05,检验可信度很高.在盐胁迫条件下,耐盐植物野生大豆(Glycine soja)能够通过根系分泌嘌呤类物质,吸引由假单胞菌主导的微生物,这些微生物能够增强植物对盐碱环境的适应能力,从而增强植物的耐盐性[31].耐盐微生物通过多种机制实现其耐盐特性,包括维持离子平衡、调节渗透压与水分吸收、促进养分吸收,以及分泌有机酸以降低土壤pH值.这些机制共同作用,有助于植物在高盐环境中生存和发育[32].例如,假单胞菌属被发现能通过促进土壤氮循环和提升养分吸收来增强植物的耐盐性[33].这些细菌会分泌1-氨基环丙烷-1-羧酸(ACC)脱氨酶,促进根系生长,同时有效保护植物免受生物和非生物胁迫[34]. ...
Patterns in the microbial community of salt-tolerant plants and the functional genes associated with salt stress alleviation
1
2021
... 与土壤中一般微生物群落相比,盐生植物的根际微生物群落普遍呈现出更高的丰度,这一特征被认为与其耐盐性密切相关[35].盐角草(Salicornia europaea)根际和内生菌主要属于厚壁菌门、放线菌门和变形菌门,并且在较高盐度条件下,细菌的总生物量显著增加[30].本研究的LEfSe分析揭示了不同盐爪爪物种根际土壤中的重要生物标志物群.3种盐爪爪属植物均具有特定的生物标志物,这些标志物不仅可以作为其根际环境的指示器,还可能在植物的适应机制中发挥重要作用.例如,s_Archangium_disciforme和f_Cyclobacteriaceae被确定为盐爪爪的主要生物标志物,而g_Marinimicrobium、o_Actinomarinales和g_bacterium_YC_LK_LKJ36则是细枝盐爪爪的特征性微生物.这些发现为深入了解盐爪爪属物种的适应机制及其根际微生物的功能提供了重要线索. ...
Halotolerant rhizobacteria Pseudomonas pseudoalcaligenes and Bacillus subtilis mediate systemic tolerance in hydroponically grown soybean (Glycine max L.) against salinity stress
1
2020
... 微生物与盐生植物之间的相互作用大多源于微生物对植物生长的促进作用,许多以前的研究已经证明,有增强植物耐盐性的PGPR富集在耐盐植物的根际区域[28].许多耐盐根际微生物已经被深入研究,揭示了它们在植物适应盐碱胁迫中的促进作用[36].例如:盐生植物补血草(Limonium sinense)招募的弯曲芽孢杆菌KLBMP 4941可以促进植物体在盐胁迫下的生长[37].在盐胁迫之外,根系微生物多样性受到多种生物和非生物因素的影响,尤其是干旱胁迫[38]、土壤类型[39]、土壤理化性质[40]和地理位置[41].同时,土壤pH值和土壤有机质与细菌群落结构存在显著相关性,且土壤pH值被广泛认为是影响微生物群落组成的因素[41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...
Root exudates-driven rhizosphere recruitment of the plant growth-promoting rhizobacterium Bacillus flexus KLBMP 4941 and its growth-promoting effect on the coastal halophyte Limonium sinense under salt stress
1
2020
... 微生物与盐生植物之间的相互作用大多源于微生物对植物生长的促进作用,许多以前的研究已经证明,有增强植物耐盐性的PGPR富集在耐盐植物的根际区域[28].许多耐盐根际微生物已经被深入研究,揭示了它们在植物适应盐碱胁迫中的促进作用[36].例如:盐生植物补血草(Limonium sinense)招募的弯曲芽孢杆菌KLBMP 4941可以促进植物体在盐胁迫下的生长[37].在盐胁迫之外,根系微生物多样性受到多种生物和非生物因素的影响,尤其是干旱胁迫[38]、土壤类型[39]、土壤理化性质[40]和地理位置[41].同时,土壤pH值和土壤有机质与细菌群落结构存在显著相关性,且土壤pH值被广泛认为是影响微生物群落组成的因素[41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...
The structure and function of microbial community in rhizospheric soil of American Ginseng (Panax quinquefolius L.) changed with planting years
1
2022
... 微生物与盐生植物之间的相互作用大多源于微生物对植物生长的促进作用,许多以前的研究已经证明,有增强植物耐盐性的PGPR富集在耐盐植物的根际区域[28].许多耐盐根际微生物已经被深入研究,揭示了它们在植物适应盐碱胁迫中的促进作用[36].例如:盐生植物补血草(Limonium sinense)招募的弯曲芽孢杆菌KLBMP 4941可以促进植物体在盐胁迫下的生长[37].在盐胁迫之外,根系微生物多样性受到多种生物和非生物因素的影响,尤其是干旱胁迫[38]、土壤类型[39]、土壤理化性质[40]和地理位置[41].同时,土壤pH值和土壤有机质与细菌群落结构存在显著相关性,且土壤pH值被广泛认为是影响微生物群落组成的因素[41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...
The establishment of winter wheat root system architecture in field soils:the effect of soil type on root development in a temperate climate
1
2023
... 微生物与盐生植物之间的相互作用大多源于微生物对植物生长的促进作用,许多以前的研究已经证明,有增强植物耐盐性的PGPR富集在耐盐植物的根际区域[28].许多耐盐根际微生物已经被深入研究,揭示了它们在植物适应盐碱胁迫中的促进作用[36].例如:盐生植物补血草(Limonium sinense)招募的弯曲芽孢杆菌KLBMP 4941可以促进植物体在盐胁迫下的生长[37].在盐胁迫之外,根系微生物多样性受到多种生物和非生物因素的影响,尤其是干旱胁迫[38]、土壤类型[39]、土壤理化性质[40]和地理位置[41].同时,土壤pH值和土壤有机质与细菌群落结构存在显著相关性,且土壤pH值被广泛认为是影响微生物群落组成的因素[41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...
低覆盖度行带式固沙林带间土壤微生物群落多样性
1
2024
... 微生物与盐生植物之间的相互作用大多源于微生物对植物生长的促进作用,许多以前的研究已经证明,有增强植物耐盐性的PGPR富集在耐盐植物的根际区域[28].许多耐盐根际微生物已经被深入研究,揭示了它们在植物适应盐碱胁迫中的促进作用[36].例如:盐生植物补血草(Limonium sinense)招募的弯曲芽孢杆菌KLBMP 4941可以促进植物体在盐胁迫下的生长[37].在盐胁迫之外,根系微生物多样性受到多种生物和非生物因素的影响,尤其是干旱胁迫[38]、土壤类型[39]、土壤理化性质[40]和地理位置[41].同时,土壤pH值和土壤有机质与细菌群落结构存在显著相关性,且土壤pH值被广泛认为是影响微生物群落组成的因素[41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...
Geographic locality greatly influences fungal endophyte communities in Cephalotaxus harringtonia
2
2013
... 微生物与盐生植物之间的相互作用大多源于微生物对植物生长的促进作用,许多以前的研究已经证明,有增强植物耐盐性的PGPR富集在耐盐植物的根际区域[28].许多耐盐根际微生物已经被深入研究,揭示了它们在植物适应盐碱胁迫中的促进作用[36].例如:盐生植物补血草(Limonium sinense)招募的弯曲芽孢杆菌KLBMP 4941可以促进植物体在盐胁迫下的生长[37].在盐胁迫之外,根系微生物多样性受到多种生物和非生物因素的影响,尤其是干旱胁迫[38]、土壤类型[39]、土壤理化性质[40]和地理位置[41].同时,土壤pH值和土壤有机质与细菌群落结构存在显著相关性,且土壤pH值被广泛认为是影响微生物群落组成的因素[41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...
... [41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...
干旱区荒漠绿洲过渡带建植梭梭(Haloxylon ammodendron)林后土壤线虫群落演变
1
2024
... 微生物与盐生植物之间的相互作用大多源于微生物对植物生长的促进作用,许多以前的研究已经证明,有增强植物耐盐性的PGPR富集在耐盐植物的根际区域[28].许多耐盐根际微生物已经被深入研究,揭示了它们在植物适应盐碱胁迫中的促进作用[36].例如:盐生植物补血草(Limonium sinense)招募的弯曲芽孢杆菌KLBMP 4941可以促进植物体在盐胁迫下的生长[37].在盐胁迫之外,根系微生物多样性受到多种生物和非生物因素的影响,尤其是干旱胁迫[38]、土壤类型[39]、土壤理化性质[40]和地理位置[41].同时,土壤pH值和土壤有机质与细菌群落结构存在显著相关性,且土壤pH值被广泛认为是影响微生物群落组成的因素[41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...
降水量对连古城自然保护区荒漠植被凋落物分解和氮状态的影响
1
2021
... 微生物与盐生植物之间的相互作用大多源于微生物对植物生长的促进作用,许多以前的研究已经证明,有增强植物耐盐性的PGPR富集在耐盐植物的根际区域[28].许多耐盐根际微生物已经被深入研究,揭示了它们在植物适应盐碱胁迫中的促进作用[36].例如:盐生植物补血草(Limonium sinense)招募的弯曲芽孢杆菌KLBMP 4941可以促进植物体在盐胁迫下的生长[37].在盐胁迫之外,根系微生物多样性受到多种生物和非生物因素的影响,尤其是干旱胁迫[38]、土壤类型[39]、土壤理化性质[40]和地理位置[41].同时,土壤pH值和土壤有机质与细菌群落结构存在显著相关性,且土壤pH值被广泛认为是影响微生物群落组成的因素[41-42].3种盐爪爪属植物的分布区域都位于连古城自然保护区已设定的国家公益林内.这些区域的生态环境得到了保护,有助于维持植物的生长和分布.在这些区域,植被凋落物的分解过程对土壤肥力和养分循环起着调节作用[43].同时,这个过程也不可避免地影响土壤的pH值和根际微生物的活动.本研究结果显示,对于3种盐爪爪属植物而言,土壤pH值是驱动根际细菌群落多样性变化的最重要因素:土壤pH值与Pseudomonadales和Balneolales的丰度显著正相关,与α-多样性指数也显著正相关.这表明,在pH适宜的环境下,这些细菌类群可能更加繁盛,进而促进了土壤微生物的多样性.相反,土壤pH值与Longimicrobiales、Burkholderiales、Sphingomonadales和Rhodobacterales等类群呈显著负相关,这意味着在碱性极端的土壤环境中,这些细菌的丰度可能受到抑制,反映出它们对pH值的敏感性. ...




 甘公网安备 62010202000688号
甘公网安备 62010202000688号