0 引言
叶际微生态系统是植物-微生物互作的关键界面,其真菌群落在空间维度呈现附生与内生的二元分化特征,这种分化源于叶表的物理化学屏障与叶内营养基质的显著差异[1]。该生态系统通过外质(apoplast)中的可溶性糖、氨基酸等营养基质,支撑着全球约4×10⁸ km²的特殊生境,单位叶重微生物载量可达10¹² CFU·g-1[2]。在此共生网络中,真菌与细菌、原生动物、病毒、蓝藻、放线菌及线虫等形成复杂互作关系[3-4]。其中,病原真菌的侵染机制尤为突出,全球已鉴定的19 000余种植物病原真菌[5]通过气溶胶扩散、昆虫媒介等跨尺度传播[6],利用效应蛋白抑制寄主免疫(如水杨酸信号通路干扰)并降解细胞壁成分(如纤维素与果胶)获取碳源[7]。这种双重策略导致叶际真菌群落重构——病原菌压缩互利共生真菌的生存空间,同时激活拮抗菌株富集[4]。气候变化通过改变温度-降水格局,正加速病原真菌的地理扩散与毒力进化,使新发真菌病害导致的生物多样性丧失风险较30年前显著增加[8-10]。
本研究以腾格里沙漠东南缘植被恢复区的常见固沙植物沙木蓼(Atraphaxis frutescens)为对象,整合高通量测序技术与生理组学分析,比较健康植株与患病植株的叶表-叶内真菌群落组成结构差异。重点解析以下科学问题:①植物真菌病害胁迫如何影响叶际真菌的群落组成结构特征,②真菌群落动态与寄主植物碳氮磷含量(C/N/P)、防御信号通路(水杨酸)及抗逆相关代谢产物(抗氧化酶系统、木质素生物合成)的相互关系。
1 材料与方法
1.1 研究区域概况
研究地点位于中国科学院宁夏沙坡头沙漠生态系统国家野外科学观测研究站(以下简称“沙坡头站”,37°27′N、104°57′E,海拔约1 250 m)。沙坡头站位于宁夏中卫市境内,地处腾格里沙漠东南缘,是中国北方荒漠与草原过渡带的重要生态监测区域。该地区多年平均降水量为186 mm,降水集中在6—8月;年蒸发量高达3 000 mm,年均气温为9.6 ℃,年均风速为2.8 m·s-1,气候干旱且蒸发强烈。土壤类型主要为钙积正常干旱土与砂质新成土的复域,植被类型属草原化荒漠地带,具有典型的荒漠生态系统特征。
1.2 样品采集
本研究于2024年8月在沙坡头站开展,以优势固沙灌木沙木蓼为研究对象,针对其叶斑类真菌病在植被恢复区的高发态势(区域发病率达75%),系统解析健康植株(Healthy plants,H)与染病植株(Diseased plants,D)叶际内外真菌群落的结构异质性。试验采用配对设计,在相同微环境条件(坡向、冠幅、邻株间距)下,分别筛选16株表型健康(无病斑或形态异常)与16株典型叶斑病(且具褐色坏死斑,图1)个体。样区植株平均发病率可达62.7%,植物生长盛期(7—9月)局部样地发病率可达75%。病株典型症状叶部褐色坏死斑,伴随黄化晕圈。病害始发于5月初,严重度与发病率在9月中旬达到峰值。通过分层随机分组法将各处理组植株划分为4个生物学重复单元(n=4混样/组,每混样含4株),形成“H1~H4”健康组与“D1~D4”患病组试验体系。
图1
使用75%乙醇(V/V)火焰灭菌解剖剪,按一株一消毒原则(接触病株后器械立即浸入乙醇燃烧皿复烧灭菌),于每株第3~5节位采集10片成熟功能叶。同混样单元的40片叶片(4株×10片)封装至Whirl-Pak®无菌采样袋,经液氮(-196 ℃/5 min)闪冻后,通过干冰低温运输链(<-70 ℃/48 h)转运至实验室,最终分装储存于Thermo Scientific™ ULT-1386-3-V50型超低温冰箱(-80 ℃)直至DNA提取,全过程严格实施无菌操作规范。
1.3 叶片生理指标测定
本研究采用德国Elementar公司Vario EL cube型全自动元素分析系统测定C、N、P含量,样品经真空干燥后过100目筛,通过动态燃烧-色谱分离联用技术进行分析,其中燃烧管(氦气载气,流速200 mL·min-1)和还原管分别设置为1 150 ℃与850 ℃,混合气体经多级色谱柱梯度分离:CO₂吸附柱(Porapak QS)40 ℃吸附/90 ℃解吸、H₂O柱(MgClO₄)40 ℃/150 ℃、SO₂柱(Chromosorb G)140 ℃/240 ℃,最终由高精度TCD检测器完成定量(校准物质为磺胺酸,C 41.84%、N 16.27%);生理指标检测委托上海生工生物工程股份有限公司完成,包括基于WST-8法在450 nm检测超氧化物歧化酶活性(以抑制NBT光化还原50%定义酶活单位)、采用乙酰化显色法通过乙酸酐-高氯酸衍生于280 nm测定木质素(香草醛标准曲线)、采用双抗体夹心ELISA法在450/630 nm双波长检测水杨酸(灵敏度0.1 ng·mL-1)。
1.4 叶际真菌的DNA提取、PCR扩增及测序
样品按内生真菌与附生真菌分类进行检测。基因组DNA提取采用Omega E.Z.N.A.® Mag-Bind Soil DNA试剂盒(OMEGA Bio-Tek,USA)完成。取200 mg植物叶片样品经液氮研磨后,加入800 μL SLX-Mlus裂解液与20 μL蛋白酶K(56 ℃消化1 h),经磁珠吸附-洗脱法纯化DNA。DNA质量经1%琼脂糖凝胶电泳(电压120 V,时间30 min)评估完整性,浓度通过Qubit® 3.0荧光定量系统(Thermo Fisher Scientific,Q33216)测定,上述操作均由上海生工生物工程股份有限公司标准化实施。真菌ITS区扩增使用PAGE纯化引物对ITS1F(正向:5’-CTTGGTCATTTAGAGGAAGTAA-3’)及ITS2(反向:5’-GCTGCGTTCTTCATCGATGC-3’),PCR反应体系(30 μL)包含:10 ng·μL-1模板DNA 2 μL、10 μM正反向引物各1 μL、2× Hieff® Robust PCR Master Mix(Yeasen Biotechnology,10105ES03,China)15 μL,ddH₂O补足至30 μL。热循环参数设置为:95 ℃预变性3 min;预扩增阶段5个循环(94 ℃ 30 s→55 ℃ 30 s→ 72 ℃ 30 s);主扩增阶段20个循环(95 ℃ 30 s→55°C 30 s→72°C 30 s);终延伸72 ℃ 5 min。扩增产物经2%琼脂糖凝胶电泳(1×TAE缓冲液)分离后,使用AxyPrep DNA凝胶回收试剂盒(Axygen,AP-GX-250)纯化,Qubit® 3.0定量合格样本(浓度≥20 ng·μL-1,总量≥100 ng)送建库。最终在Illumina MiSeq PE250平台(Illumina,USA)进行2×250 bp双端测序,原始数据经Cutadapt v1.9.1去除接头序列,USEARCH v11.0剔除嵌合体,获得有效序列用于后续分析。
1.5 测序数据处理和物种标注
原始测序数据经多级质控流程处理:首先通过CutAdapt (v1.18)清除引物及接头序列;随后采用PEAR (v0.9.8)对双端reads进行合并(最小重叠长度20 bp,质量阈值Q ≥ 20);进一步使用PRINSEQ (v0.20.4) 实施动态修剪,基于滑动窗口法截除非重叠区Phred质量值< 20的碱基;在此基础上,通过UPARSE算法对去冗余序列(剔除singleton)进行97%相似度聚类,并采用UCHIME de novo模式去除嵌合体;最终通过BLASTn(e-value≤1e-5)比对UNITE真菌数据库(Version 9.0_2023-07-10,
1.6 数据处理
利用mothur软件(v1.45.3,
2 结果
2.1 真菌群落多样性
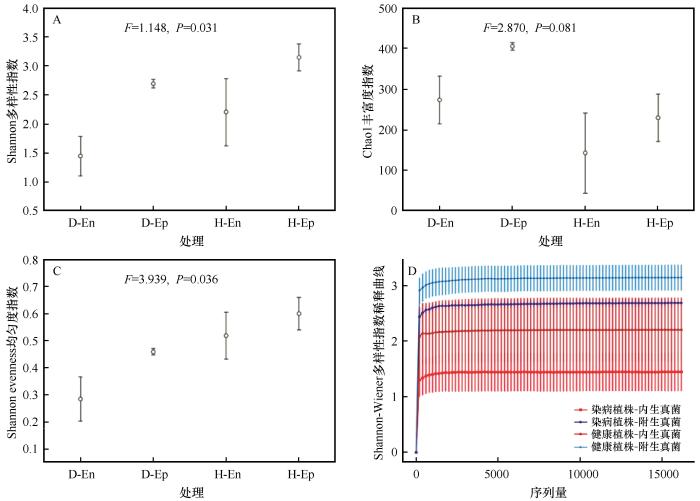
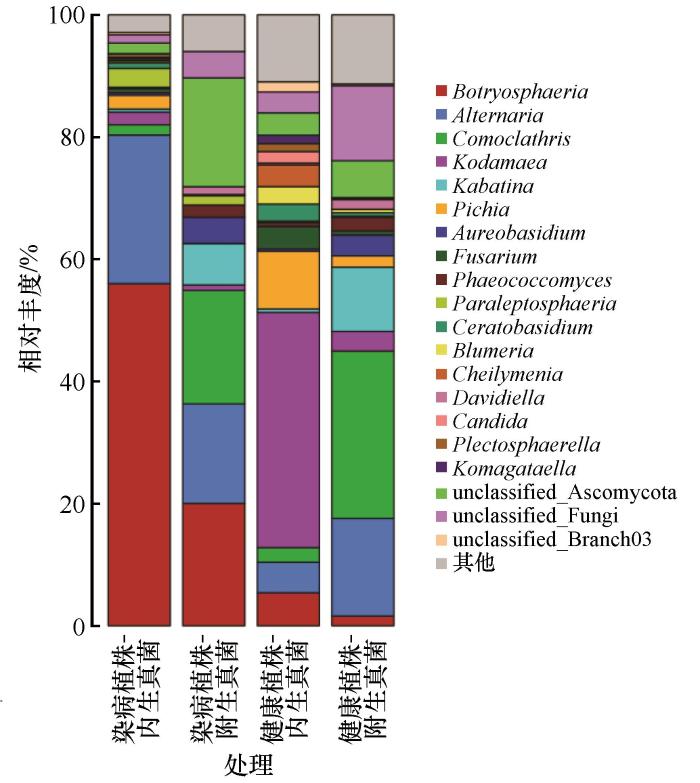
本研究通过Illumina NovaSeq 6000平台双端测序获得2 697 300条原始序列,经Demux模块根据特异性条形码拆分为16个生物学样本。通过QIIME2 v2021.8的DADA2流程进行质控筛选(Phred评分阈值<20),排除239 131条嵌合体及低质量序列后,保留2 458 169条高质量序列。基于97%相似度阈值聚类获得799个操作分类单元(OTUs),并以最小测序量(每样本121 969条)为基准进行测序深度均一化处理。Shannon-Wiener多样性指数稀释曲线分析显示,当测序量达150 000条时所有样本均达到渐近线(图2),证实测序深度足以覆盖样本中OTUs的多样性特征。进一步利用SILVA 138.1数据库进行系统分类学注释,明确OTUs在门至种水平的分类学组成(表1),其中子囊菌门(Ascomycota,相对丰度>84%)与担子菌门(Basidiomycota,相对丰度>1.4%)为优势菌群(图3、4)。
图2
图2
沙木蓼受病害侵染叶际内外真菌群落α多样性指数
Fig.2
α-diversity indices of epiphytic and endophytic fungal communities in the phyllosphere of disease-infected Atraphaxis bracteata
表1 各分类水平微生物类群(平均值±标准差)
Table 1
| 处理 | 门 | 纲 | 目 | 科 | 属 | 种 |
|---|---|---|---|---|---|---|
| 染病植株-内生真菌 | 6.00±1.41 | 38.75±6.02 | 17.75+20.6 | 73.75±17.58 | 115.00±35.17 | 154.75±53.43 |
| 染病植株-附生真菌 | 7.75±0.96 | 48.75±3.50 | 22.00±1.83 | 102.00±8.16 | 176.50±11.24 | 251.00±15.38 |
| 健康植株-内生真菌 | 6.00±3.16 | 27.50±10.57 | 16.25±9.98 | 46.50±14.20 | 107.75±75.53 | 104.50+63.00 |
| 健康植株-附生真菌 | 5.75±1.50 | 37.50±8.10 | 18.75±2.22 | 72.25±18.30 | 111.75±33.19 | 150.25±52.20 |
图3
图3
沙木蓼受病害侵染叶际内外真菌群落相似性分析(ANOSIM)
Fig.3
Analysis of similarities (ANOSIM) of epiphytic and endophytic fungal communities in the phyllosphere of disease-infected Atraphaxis bracteata
图4
图4
沙木蓼受病害侵染叶际内外真菌群落属水平上相对丰度
Fig.4
Relative abundance at the genus level of epiphytic and endophytic fungal communities in the phyllosphere of disease-infected Atraphaxis bracteate
染病植株中,Shannon多样性指数(F=4.148,P<0.05)与均匀度指数(F=3.939,P<0.05)沿内生真菌至附生真菌梯度呈显著上升趋势;而健康植株处理组的内生-附生梯度上,虽然Shannon多样性指数与均匀度指数同样显著递增(P<0.05),但其附生真菌多样性指数均值(2.87±0.15)显著高于染病组附生真菌(2.12±0.11,t=5.237,P<0.01)。值得注意的是,Chao1丰富度指数在染病组附生真菌中达到峰值(286±23 OTUs),显著高于健康组附生真菌(198±17 OTUs,t=3.812,P<0.01)及两处理组内生真菌(染病植株组:152±14 OTUs;健康植株组:135±11 OTUs,图2)。
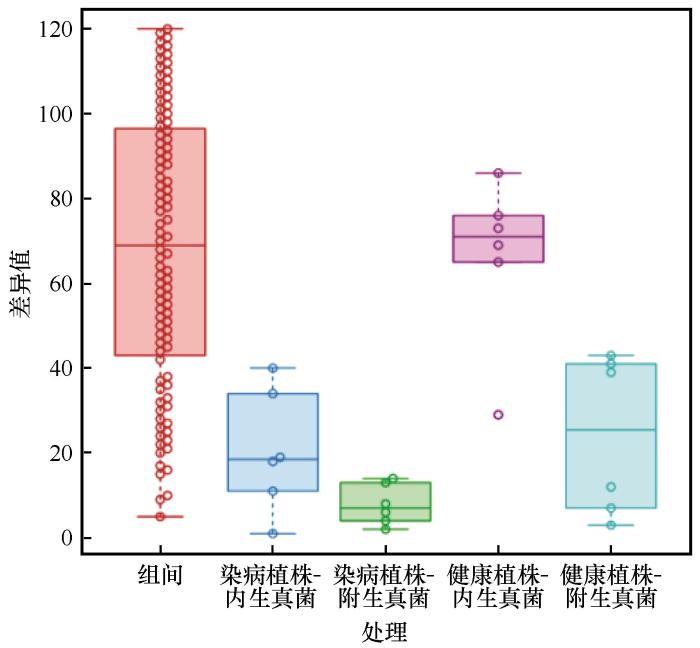
基于操作分类单元(OTUs)的Bray-Curtis距离,本研究对沙木蓼受病害侵染叶际内外真菌群落的β多样性进行了分析,相似性分析(ANOSIM)结果可视化如图3。该分析表明各真菌群落间存在显著差异(r=0.642、P=0.001,图3),说明4类植物叶际真菌群落结构的组间差异显著大于组内差异。进一步通过置换多元方差分析(PERMANOVA)对不同类群真菌群落进行比较,结果显示各类群真菌群落之间均存在显著差异,且该差异模式在病害作用下呈系统性增强(健康植株组R2=0.719,P=0.04;染病植株组R2=0.854,P=0.028)。尤其值得注意的是,附生真菌群落在染病植株中表现出更低的β多样性离散度(Bray-Curtis距离均值:0.24±0.04),显著低于内生真菌群落(0.37±0.04;F=7.892,P<0.01)。
2.2 真菌群落组成与指示菌属
通过对染病植株处理组与健康植株处理组内生及附生真菌群落的组成分析发现,子囊菌门(Ascomycota)是4类真菌群落的核心构成类群(染病植株-内生真菌中相对丰度为96.74%,染病植株-附生真菌中相对丰度为93.95%,健康植株-内生真菌中相对丰度为88.19%,健康植株-附生真菌为84.22%)。染病植株处理组的病原相关属葡萄座腔菌属(Botryosphaeria)在内生真菌群落中相对丰度达56.00%,在附生真菌群落中为20.04%;在健康植株叶际内生真菌群落中相对丰度5.41%,而附生真菌群落中仅为1.60%。而健康植株中,叶际真菌群落中Kodamaea在内生真菌群落中的相对丰度为38.48%,显著高于染病植株真菌群落中该属的相对丰度0.50%(图4)。
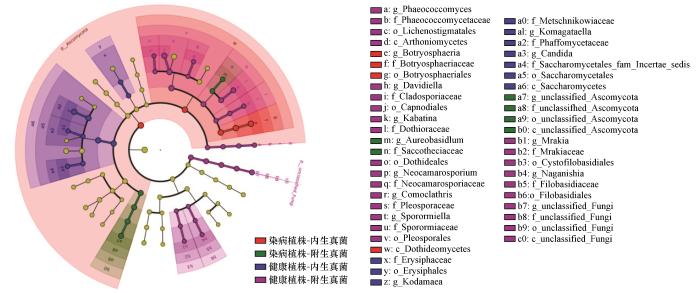
通过LEfSe分析(LDA Effect Size,LDA>2)对健康与染病植株叶际内外真菌群落的差异属进行筛选,结果表明,染病植株组内生真菌群落中病原相关属Botryosphaeria(LDA=5.5,P<0.05)显著富集,而健康植株组内生真菌群落的共生功能属Kodamaea(LDA=5.3)、Komagataella(LDA=4.0)及Candida(LDA=4.03)丰度显著更高(P<0.05);附生真菌群落中,染病植株组Aureobasidium(LDA=4.3,P<0.05)显著富集,而健康植株组附生群落的Phaeococcomyces(LDA=4.2)、Davidiella(LDA=4.1)、Kabatina(LDA=4.7)、Neocamarosporium(LDA=4.4)、Comoclathris(LDA=5.0)、Sporormiella(LDA=4.3)、Mrakia(LDA=4.2)及 Naganishia(LDA=4.0)等属丰度显著占优(P<0.05,图5)。
Fig.5
Fig.5
Linear discriminant analysis (LDA) effect size (LEfSe) at the genus level
2.3 真菌群落与营养元素和抗性指标
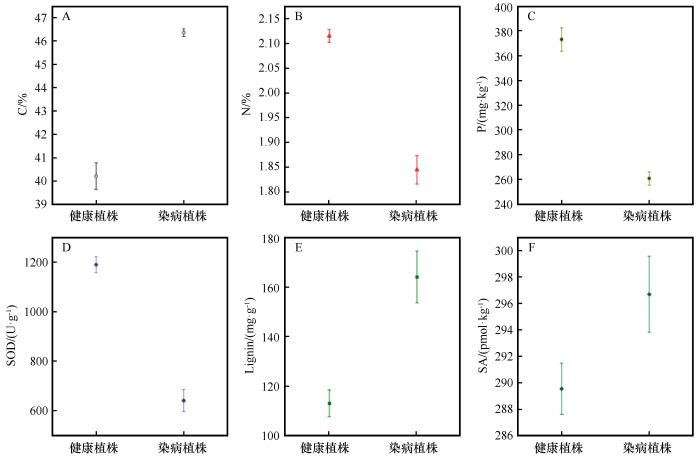
图6
图6
沙木蓼健康植株及受病害侵染植株叶部组织碳C、氮N、磷P、超氧化物歧化酶SOD、木质素lignin、水杨酸SA,含量差异分析
Fig.6
Comparative analysis of carbon (C),nitrogen (N),phosphorus (P),superoxide dismutase (SOD),lignin and salicylic acid (SA) contents in leaf tissues of healthy and disease-infected Atraphaxis bracteata
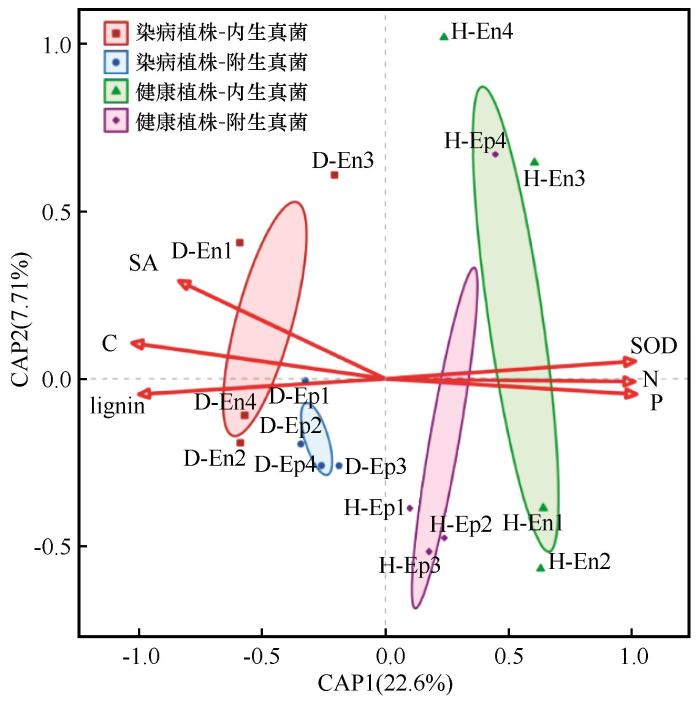
图7
图7
沙木蓼受病害侵染叶际内外真菌群落距离冗余分析
Fig.7
Distance-based redundancy analysis (dbRDA) of epiphytic and endophytic fungal communities in the phyllosphere of disease-infected Atraphaxis bracteata leaves
3 讨论
本研究整合微生物生态学与植物生理学多维数据,揭示了荒漠固沙植物沙木蓼在真菌病害胁迫下叶际微生态系统结构与功能的协同变化规律。相较于健康植株,病害胁迫诱导的叶际真菌群落重构呈现出显著的生态位分异特征。内生真菌群落向病原主导型转化,而附生真菌群落在维持较高丰富度的同时发生功能型转化。这一发现与病原入侵-微生物网络重组理论契合,表明植物病害可通过改变叶际微生境资源分配驱动真菌群落的改变。
病害胁迫诱导叶际真菌群落发生显著的生态位分化,内生真菌向病原主导型转化,病害植株内生真菌群落的α多样性显著降低(图2),Botryosphaeria属在内生群落的爆发性增殖(相对丰度56.00%),不仅直接抑制寄主免疫应答(SOD活性降低54.3%),其分泌的细胞壁降解酶还可能破坏植物表皮结构[12],为附生真菌的定殖创造新的生态位[16]。β多样性分析显示染病组附生真菌群落离散度显著降低(图3),暗示病原胁迫可能通过选择压力促使附生真菌形成功能趋同的耐胁迫类群,如Aureobasidium等腐生菌属[17]的富集(图5)。附生真菌群落在染病植株中呈现物种丰富度扩张但功能均质化的现象:Chao1指数上升44.9%(图2),但Shannon多样性降低26.1%,且群落离散度(β多样性)显著低于内生真菌(图3)。这一现象可能由叶际微环境的双重胁迫驱动:一方面,病原侵染导致叶表细胞裂解释放大量碳源(如可溶性糖和脂类),为腐生型附生真菌(如Aureobasidium)的定殖提供基质,从而扩张物种库[18-19];另一方面,寄主植物氧化防御系统(SOD活性抑制,r=-0.78)与次生代谢产物(如木质素积累,r=0.65)的失衡,形成强烈的氧化与化感选择压力,淘汰了某些互惠型真菌(如Kabatina和Phaeococcomyces),其在健康植株上的优势可能暗示以下作用:可能参与分解有机质、抑制病原菌定殖,或协助植物适应环境胁迫。但是仍需结合具体代谢功能或基因组数据确认其互惠性[20],使群落向耐胁迫或机会性病原类群趋同。这种“量增质降”模式印证了微生物生态学胁迫筛选假说——环境扰动虽短暂增加资源可利用性,但长期通过代谢毒性筛选出具有特定抗逆机制的类群,导致功能冗余度下降[21-22]。
内生真菌群落的响应则呈现截然不同的特征。病原属Botryosphaeria的相对丰度在染病植株中高达59.15%(图3),其富集与寄主植物SOD活性抑制及木质素积累显著正相关(图7)。这提示Botryosphaeria可能通过代谢策略建立致病优势:其分泌的效应蛋白(如细胞壁降解酶或效应分子)可能抑制寄主植物抗氧化酶活性,同时劫持苯丙烷代谢通路,诱导木质素在侵染部位异常沉积[23]。这种沉积虽短期增强细胞壁物理屏障,但长期导致叶肉细胞僵化与营养运输受阻,反而为Botryosphaeria创造低氧、高碳的微生境[24]。更值得注意的是,健康植株中可能的互惠共生属Kodamaea和Komagataella的完全缺失(图5,Kodamaea作为酵母菌可能能够产生植物激素,帮助植物吸收养分,或抑制植物病原菌的生长[25],而Komagataella可能涉及代谢过程)。该属的酵母是甲醇营养型的,意味着它们能够利用甲醇作为碳和能源可能削弱寄主植物对病原菌的“生物防线”——这些共生菌通常通过营养竞争、空间占位或抗菌代谢物(如萜类化合物)抑制病原增殖[26]。因此,病害进程可能不仅是病原菌的主动侵袭,更是寄主植物-微生物互作网络崩溃导致的系统性防御失效。
病害侵染引发沙木蓼叶片碳氮磷代谢的协同失衡与微生物组功能重塑,形成多层次的营养竞争与防御调控网络。碳代谢重构(含量+28.6%)通过双重途径驱动微生物群落演化。①淀粉与可溶性糖的积累激活病原菌糖信号通路(如SnRK1激酶),促使其分泌侵袭性酶系(例如果胶酶)加速组织侵染[27];②寄主植物光合作用基因抑制导致能量代谢异养化,依赖附生真菌腐生代谢分解有机物[28]。氮匮乏(含量降低19.4%)则削弱寄主植物防御能力。氮作为PR-1蛋白与一氧化氮合成的关键元素,其缺乏限制抗病应答,迫使真菌群落转向蛋白酶分泌或菌丝网络等高效氮获取策略[29]。与此同时,磷含量显著降低30.1%(P=0.002)与病原属Botryosphaeria的异常增殖(相对丰度56.00%)直接相关——其分泌的酸性磷酸酶(APase)加速有机磷矿化[30],但毒素或胞外多糖可能抑制寄主植物PHT1磷转运基因表达,导致矿化-吸收解耦现象。
dbRDA分析显示木质素与水杨酸(SA)对真菌群落结构的解释力最强,暗示寄主植物防御代谢产物兼具抗病与微生物组调控的“生态工程师”功能。SA通过抑制茉莉酸(JA)通路优先激活系统获得性抗性(SAR),但可能抑制SA敏感共生菌生长[31],加剧磷素稳态失衡。附生群落的低β多样性反映营养胁迫下的趋同进化:优势菌(如Botryosphaeria)通过高亲和力磷酸盐转运系统(PHO84同源基因)适应低磷环境[32],而碳氮代谢紊乱进一步强化低多样性-低效循环正反馈——碳富集虽提供能量,但氮磷匮乏限制微生物功能冗余,导致磷滞留能力下降。这种碳-氮-磷代谢机制揭示:病原菌通过劫持寄主植物营养循环、抑制共生菌功能、驱动群落结构简化,形成系统性营养剥夺策略。
此外,本研究通过dbRDA分析一定程度上揭示了叶际真菌群落的生态位分化特征及附生真菌功能可塑性对植物健康状态的指示作用,同时基于代谢-微生物互作(如Botryosphaeria属相对丰度与超氧化物歧化酶活性、木质素含量的协同响应模式),为荒漠生态系统的植被修复提供了微生物组调控的理论框架。但是,值得注意的是dbRDA仅解析了30.31%的群落变异(剩余变异可能源于未被捕获的细菌-真菌互作、寄主植物表观遗传异质性或中性扩散过程等),但其核心目标聚焦于关键环境驱动力的排序关系也就是侧重于病原-寄主植物互作机制而非全面解构群落构建机制。分析中已捕捉到显著富集真菌类群与病理进程高度耦合的驱动因子(如病原菌与防御代谢的正相关),因此30.31%的解释率仍具有生物学合理性。但是,基于此局限性,未来研究需在三方面深化探索:首先,通过构建跨营养级合成微生物群落模拟植物-真菌互作场景,验证生态位分配理论在荒漠生境中的普适性;其次,开发基于多维代谢标志物(如水杨酸/木质素动态比值等)的病害早期预警技术,提升植物健康管理的时效性;最后,系统挖掘功能可塑性真菌类群的生防潜力,并整合微环境异质性量化模型与寄主植物表观基因组学数据,构建多尺度联动的植物-微生物协同适应机制解析体系。
参考文献
Fungal composition and diversity of the tobacco leaf phyllosphere during curing of leaves
[J].
A brief from the leaf: latest research to inform our understanding of the phyllosphere microbiome
[J].
Phyllosphere microbiome: diversity and functions
[J].
Trichoderma:the current status of its application in agriculture for the biocontrol of fungal phytopathogens and stimulation of plant growth
[J].
A review of plant leaf fungal diseases and its environment speciation
[J].
H2O2 from the oxidative burst orchestrates the plant hypersensitive disease resistance response
[J].
Evolutionary ecology of plant diseases in natural ecosystems
[J].
Forest ecosystem responses to exotic pests and pathogens in eastern North America
[J].
Drought resistance of desert riparian forests: vegetation growth index and leaf physiological index approach
[J].
Fusaric acid-evoked oxidative stress affects plant defence system by inducing biochemical changes at subcellular level
[J].
Foliar fungal diseases respond differently to nitrogen and phosphorus additions in Tibetan alpine meadows
[J].
Pathogen impacts on plant communities: unifying theory,concepts,and empirical work
[J].
Emerging fungal threats to animal,plant and ecosystem health
[J].
Global warming shifts the composition of the abundant bacterial Phyllosphere microbiota as indicated by a cultivation-dependent and -independent study of the grassland phyllosphere of a long-term warming field experiment
[J].
Aureobasidium spp.:diversity,versatility,and agricultural utility
[J].
Phenotypic plasticity in fungi:a review with observations on Aureobasidium pullulans
[J].
Comparative pathogenicity of opportunistic black yeasts in Aureobasidium
[J].
The plant endomicrobiome:structure and strategies to produce stress resilient future crop
[J].
Microbial mitigation-exacerbation continuum:a novel framework for microbiome effects on hosts in the face of stress
[J].
Do plant-microbe interactions support the stress gradient hypothesis?
[J].
A systematic review of abiotic factors influencing the production of plant cell wall-degrading enzymes in Botryosphaeriaceae
[J].
Effect of phenolic compounds on growth and ligninolytic enzyme production in Botryosphaeria isolates
[J].
Plant-microbiome interactions:from community assembly to plant health
[J].
Grass-endophyte symbiosis: a neglected aboveground interaction with multiple belowground consequences
[J].
The SnRK1 energy sensor in plant biotic interactions
[J].
Fungal endophyte infection of ryegrass reprograms host metabolism and alters development
[J].
Plant ‘pathogenesis-related’ proteins and their role in defense against pathogens
[J].
Plant invasion alters soil phosphorus cycling on tropical coral islands: insights from Wollastonia biflora and Chromolaena odorata invasions
[J].
Antagonism between acibenzolar-S-methyl-induced systemic acquired resistance and jasmonic acid-induced systemic acquired susceptibility to Colletotrichum orbiculare infection in cucumber
[J].
Expression analysis of three phosphate transporter genes in the fast-growing mutants of Gracilariopsis lemaneiformis (Rhodophyta) under low phosphorus condition
[J].





 甘公网安备 62010202000688号
甘公网安备 62010202000688号