0 引言
地球上每年产生超过5×104 Tg的陆生植物生物量[1],其中约95%以凋落物的形式返回到土壤,被微生物分解转化为土壤有机质,并以温室气体的形式释放到大气中[2]。凋落物分解受凋落物初始化学成分、微生物及非生物环境条件相互作用的影响[3]。在局地尺度上,凋落物化学组分被认为对整个分解过程中质量损失具有持续影响,即初始凋落物质量假说[4]。凋落物氮(N)含量,纤维素和木质素的相对含量被认为是影响凋落物分解快慢的关键因素[5]。已有研究结果表明,微生物对初始N含量较高的凋落物具有偏好性使得凋落物能更快地分解[6];而木质素、纤维素组成的聚合物,必须首先通过微生物分泌的胞外酶降解才能被进一步同化利用,因而表现出较低的分解速率[7]。因此,凋落物类型的化学组分差异会导致其分解速率显著不同,并深刻影响土壤微生物群落结构。
土壤微生物作为凋落物分解的主要驱动者,其群落结构直接影响土壤有机质分解、养分矿化及土壤碳(C)汇的形成。具有不同化学组成的凋落物为土壤微生物提供了丰富的C源和N源,促进其生长和代谢活动,从而对土壤微生物群落组成和丰度产生显著影响;同时微生物群落结构也会随凋落物类型和分解阶段发生适应性变化[8-9]。具有较低C∶N的凋落物通常支持细菌能量通道,细菌丰度会随着C∶N较低的叶凋落物输入而显著增加,从而促进凋落物的快速周转[10]。相比之下,具有较高C∶N的凋落物通常促进寡养微生物(即真菌)的生长,这些微生物通过大量C投入来分解顽固性化合物[11]。细菌和真菌群落结构对不同类型凋落物的响应具有较大差异,并且在凋落物分解过程中发挥的作用不同。此外,微生物群落变化也会影响土壤理化性质,如pH、酶活性及养分有效性[12]。因此,研究凋落物分解过程中微生物群落的动态变化,有助于揭示沙地生态系统的养分循环机制,并为生态恢复提供科学依据。
科尔沁沙地位于中国“两屏三带”中北方防沙带的东段,也是“三北”工程“三大标志性战役”的主战区。要实现科学有效的沙化土地治理和植被恢复,需要深入认识沙地植被群落对生态系统物质周转的影响,制定相应的恢复与管理对策。植被恢复是沙地生态系统修复的核心措施,而凋落物作为植物与土壤间物质循环的重要纽带,其分解过程直接影响土壤养分增加、有机质积累及微生物群落演替[13]。因此,本研究选取科尔沁沙地6种优势物种,包括固沙灌木小叶锦鸡儿(Caragana microphylla)和盐蒿(Artemisia halodendron),一年生禾草狗尾草(Setarria viridis)和多年生禾草糙隐子草(Cleistogenes squarrosa)、一年生杂类草尖头叶藜(Chenopodium acuminatum)和多年生半灌木达乌里胡枝子(Lespedeza bicolor),研究其凋落物分解特征及分解后的土壤微生物群落结构,探究凋落物初始化学组分、微生物群落结构及分解速率之间的关系,揭示凋落物初始化学组分对微生物群落结构的影响,以期加深对科尔沁沙地生态系统物质周转过程的理解,同时为区域建立与环境相适应的植物群落系统及其可持续管理提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于中国农牧交错带东段的科尔沁沙地(42.3°—44.5°N,113.5°—123.5°E),处于大陆性半干旱、半湿润季风气候区,平均海拔178.5 m。年平均气温为5.8~6.4 ℃,最热月和最冷月分别为7月和1月,平均气温分别为20.3~23.5 ℃和-12.6~16.8 ℃。多年平均降水量为343~451 mm,其中80%分布在6—8月。年平均蒸发量为1 500~2 500 mm。土壤以风沙土为主,土壤有机质含量为0.08%~0.49%,细砂粒、中砂粒和极细砂粒分别占总质量的20%~58%、40%~67%和0.1%~15%。原生植被以疏林草原植被类型为主,在气候变化和过度人类活动的共同影响下,发展出固定沙丘、半固定沙丘、流动沙丘和丘间低地镶嵌分布的沙丘景观,并形成以沙生植物盐蒿、小叶锦鸡儿、狗尾草、糙隐子草、达乌里胡枝子等一年生和多年生灌草为优势种的沙质草地植被群落。
1.2 试验设置
以科尔沁沙地6种典型植物为研究对象,包括狗尾草、糙隐子草、达乌里胡枝子、小叶锦鸡儿、盐蒿和尖头叶藜。于2018年9月下旬植物枯萎期,在固定沙丘、半固定沙丘和丘间低地对6种植物进行凋落物采集,其中狗尾草在3种生境中均有采集,糙隐子草、达乌里胡枝子和尖头叶藜在固定沙丘和半固定沙丘采集,小叶锦鸡儿和盐蒿在半固定沙丘采集。采集后,将同一物种的凋落物充分混合,组成复合样品。采集到的凋落物在实验室内风干至恒重后备用。并取部分样品测定凋落物化学成分,包括纤维素、半纤维素、木质素、C和N含量。
凋落物分解试验于2019年5月在内蒙古自治区通辽市奈曼沙漠化研究站开展。凋落物分解试验采用尼龙网袋法,尼龙网袋(5 cm×10 cm)孔径为0.5 mm。将装有5 g凋落物(烘干重)的尼龙网袋埋于土壤下10 cm处。为避免土壤异质性和各物种凋落物的相互影响等因素对凋落物分解速率的影响,用PVC管将6种物种的凋落物分隔开进行分解。PVC管内填装取自固定沙丘表层充分混匀的均质新鲜土壤。每一组PVC管用尼龙网(2 mm)覆盖,防止外源凋落物及其他杂物输入,并定期人工去除PVC管内生长的植物。凋落物分解试验周期为15个月。根据取样次数需要,共设置40组PVC管,分为8组,每组5个重复。
1.3 样品采集与分析
考虑到凋落物在分解前期质量损失较快,分解后期质量损失较慢,取样时间设置为分解1、2、3、4、5、11、13、15月,共计取样8次。每次取回的凋落物样品在清水中小心清洗,去除大部分沙粒。之后置于60 ℃条件下烘干至恒重,称取重量并测定灰分进行质量矫正。凋落物样品的灰分含量在马弗炉中550 ℃下燃烧3 h测定。在分解第15个月,同步采集凋落物分解袋邻近的土壤样品,在冰箱-20 ℃保存,后续进行微生物群落结构测定。
凋落物C含量和N含量采用元素分析仪测定。纤维素、半纤维素和木质素含量采用比色法测定。
通过E.Z.N.A.®土壤DNA Kit试剂盒,从0.4 g混合均匀的土壤中提取总基因组DNA。采用1.0%琼脂糖凝胶电泳和NanoDrop®ND-2000分光光度计测定DNA的质量和浓度,并在-80 ℃保存,以便进一步使用。在提取的DNA上使用ABI GeneAmp@ 9700型PCR进行扩增。采用通用引物338F-860R对细菌进行扩增,SSU0817F-1196R对真菌进行扩增,利用AxyPrep DNA Gel Extraction Kit进行回收产物纯化,并用Quantus™ Fluorometer对回收产物进行定量检测。使用NEXTFLEX Rapid DNA-Seq Kit对纯化后的PCR产物进行建库,原始数据上传至NCBI数据库。使用Fastp软件对双端原始测序序列进行质量控制,使用FLASH软件进行拼接。通过UPARSE软件将序列聚类为具有高相似性(≥97%)的操作分类单元OTU。将每个OTU的代表性序列基于SILVA数据库,使用RDP分类器进行分类学注释。对OUT进行分类,从界、门、纲、目、科、属、种水平进行注释,分析各分类水平物种组成及多样性。利用上海美吉生物医药科技有限公司云平台对数据进行前期分析。
1.4 数据分析
凋落物质量损失比例(Dt )计算公式为:
式中:Mi 为初始凋落物去灰分质量(g);Mt 为分解第t个月剩余凋落物的去灰分质量(g)。
凋落物分解速率采用Olson指数衰减模型计算:
式中:Mt 为分解第t个月剩余凋落物的去灰分质量(g);Mi 为初始凋落物去灰分质量(g);K为凋落物分解速率(g·g-1·m-1),乘以103表示为g·kg-1·m-1,表示为每千克凋落物每月的质量损失克数。
微生物α多样性研究选取Shannon指数及ACE指数分别表征微生物群落的多样性及丰富度。其中,Shannon指数(H)同时结合物种丰富度和均匀度,其数值越高,表明该样本群落多样性越高。计算公式为:
式中:S为OTU总数目;pi 为第i条序列的相对丰度。
ACE指数(
式中:Sabund表示丰富物种的数量,通常指样本中出现频率较高的物种;Srare表示稀有物种的数量,通常指样本中出现频率较低的物种;CACE为校正系数,用于调整稀有物种对丰富度的影响;F1表示样本中仅出现1次的物种数量;
利用SPSS进行统计分析,Origin作图。利用单因素方差分析(one-way ANOVA)检验各物种间凋落物化学成分、质量损失比例及分解速率的差异性。采用冗余分析(Redundance Analysis,RDA)分析凋落物化学组分与微生物群落的相互关系。通过Spearman相关性分析确定凋落物化学组分、分解速率及微生物群落结构之间的关系。考虑到高丰度微生物类群通常最有可能主导分解功能、响应环境变化,且数据可靠、易于分析,而某些低丰度但高活性的类群也可能在凋落物分解过程中发挥重要作用,本研究在土壤微生物群落组分分析中关注相对丰度前10的微生物类群。
2 结果与分析
2.1 凋落物化学组分和分解速率
不同植物物种间凋落物的化学组成存在显著差异(表1)。具体而言,狗尾草和糙隐子草凋落物表现出较高的纤维素和半纤维素含量,以及C∶N比和木质素∶N比,但其N含量相对较低。木质素含量在不同物种间表现出显著差异(P<0.05),其中达乌里胡枝子和盐蒿的木质素含量最高,其次为糙隐子草、狗尾草、小叶锦鸡儿和尖头叶藜。就N含量而言,尖头叶藜和小叶锦鸡儿凋落物的N含量最高,显著高于达乌里胡枝子和盐蒿(P<0.05),而狗尾草和糙隐子草的N含量则显著低于其他物种(P<0.05)。
表1 不同物种凋落物化学组分比较
Table 1
| 化学组成 | 狗尾草 | 糙隐子草 | 达乌里胡枝子 | 小叶锦鸡儿 | 盐蒿 | 尖头叶藜 |
|---|---|---|---|---|---|---|
| 纤维素/(mg·g-1) | 460.29±5.11a | 460.72±7.90a | 270.09±6.43bc | 283.00±6.79bc | 289.95±6.85b | 265.08±11.92c |
| 半纤维素/(mg·g-1) | 242.06±5.97a | 248.30±2.00a | 78.11±2.55c | 98.22±4.54d | 83.52±0.22c | 50.89±1.89d |
| 木质素/(mg·g-1) | 95.30±2.53d | 105.26±1.86c | 145.18±5.00a | 74.85±2.80e | 123.34±2.40b | 56.79±1.31f |
| C含量/% | 42.02±0.30d | 45.04±0.16b | 45.98±0.14a | 44.27±0.25c | 44.10±0.09c | 37.38±0.46e |
| N含量/% | 0.77±0.02e | 1.23±0.09d | 2.44±0.01c | 3.18±0.02b | 2.48±0.01c | 3.32±0.01a |
| C∶N | 54.48±1.11a | 37.46±2.50b | 18.87±0.17c | 13.91±0.10d | 17.75±0.08c | 11.23±0.11d |
| 木质素∶N | 12.32±0.19a | 8.75±0.57b | 5.96±0.24c | 2.34±0.07e | 4.96±0.11d | 1.71±0.04d |
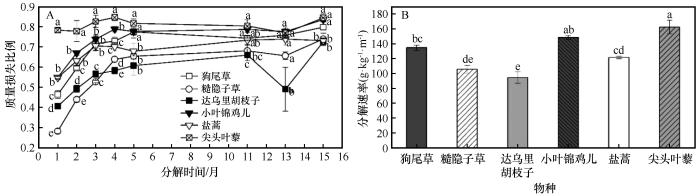
不同植物物种凋落物分解动态表现出显著差异性(图1,P<0.05)。分解初期(0~4个月),各物种凋落物质量损失较快,随后逐渐趋于平缓(图1A)。物种间分解速率整体表现为:尖头叶藜>小叶锦鸡儿>狗尾草>盐蒿>达乌里胡枝子>糙隐子草,但其相对排序随分解进程而有所变化(图1A、B)。具体而言,在分解初期(0~4个月),各物种间质量损失率差异显著(P<0.05),其中尖头叶藜的质量损失最快,显著高于小叶锦鸡儿和盐蒿,而狗尾草、达乌里胡枝子和糙隐子草的质量损失显著低于其他物种(P<0.05)。分解至第15个月时,狗尾草、小叶锦鸡儿和尖头叶藜的质量损失比例显著高于糙隐子草、盐蒿和达乌里胡枝子(P<0.05)。
图1
图1
不同物种凋落物分解过程中质量损失比例及分解速率的比较
Fig.1
Comparison of the mass loss fraction and decomposition rate during the decomposition process of litter from different species
2.2 土壤微生物群落结构
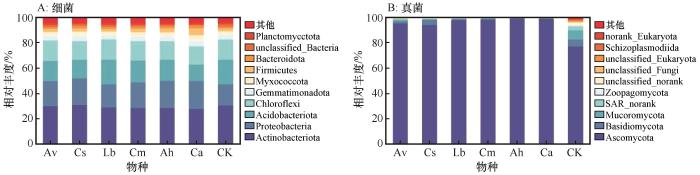
从门水平来看,经过15个月分解,各物种凋落物处理的土壤细菌群落中相对丰度大于10%的为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria,图2A)。与对照组相比,变形菌门相对丰度明显增加。酸杆菌门相对丰度除了达乌里胡枝子外,其他物种凋落物处理均低于对照组。芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)相对丰度在尖头叶藜分解后明显升高。土壤真菌群落中子囊菌门(Ascomycota)为优势菌门(图2B)。与对照组相比,子囊菌门相对丰度明显增加,而担子菌门(Basidiomycota)、毛霉菌门(Mucoromycota)、SAR_norank和捕虫霉亚门(Zoopagomycota)相对丰度明显降低。
图2
图2
微生物群落门水平上的物种组成
Fig.2
The species composition of microbial communities at the phylum level
图3
图3
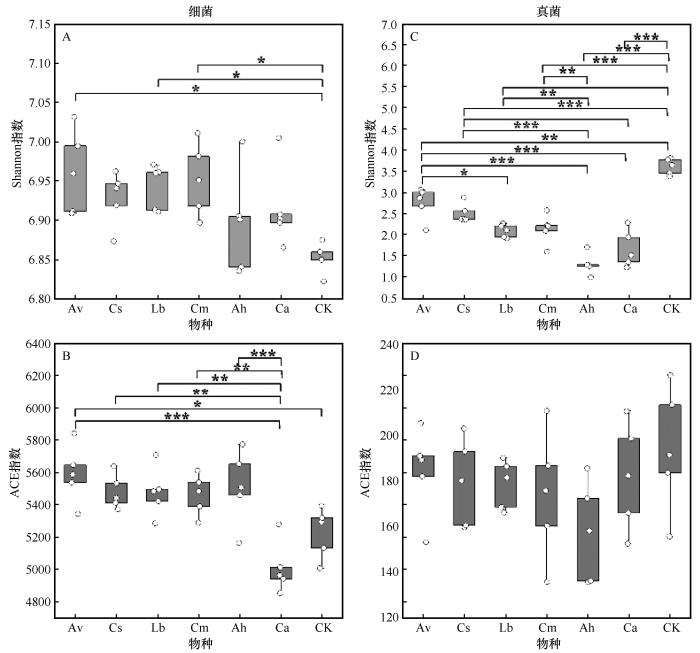
不同物种凋落物分解的微生物群落门水平α多样性比较
Fig.3
Comparison of α-diversity at the phylum level of microbial communities during the decomposition of litter from different species
2.3 凋落物化学组分、分解速率与土壤微生物群落结构的关系
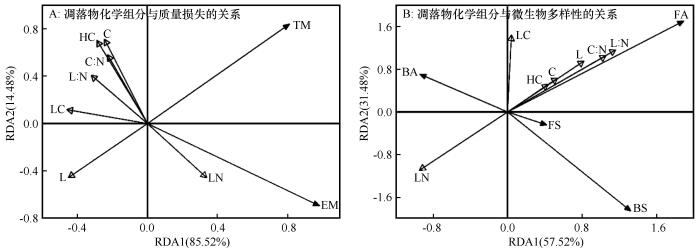
冗余分析结果表明,凋落物化学组分对凋落物质量损失变异性的累积解释率达到99%(图4A)。其中,0~4个月质量损失与凋落物N含量正相关,与凋落物半纤维素含量、C含量、C∶N和木质素∶N负相关。前15个月总质量损失与凋落物木质素含量负相关。说明凋落物N含量、木质素含量、C∶N和木质素∶N是影响凋落物分解快慢的关键因子。凋落物化学组分对微生物多样性变异性的累积解释率为89%,真菌丰富度(ACE指数)与凋落物C∶N、木质素∶N正相关,而与凋落物N含量负相关。这说明与细菌相比,真菌群落结构受凋落物化学组分的影响更大。
图4
图4
凋落物化学组分与凋落物质量损失和微生物多样性的冗余分析
Fig.4
Redundancy analysis of the relationships among litter chemical components, litter mass loss, and microbial diversity
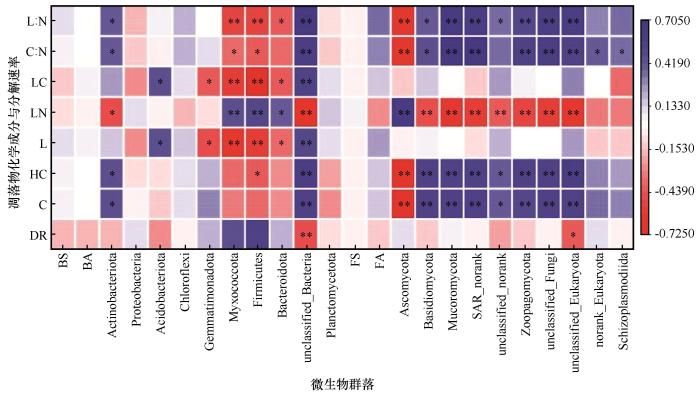
相关性分析结果也表明,凋落物分解15个月后的微生物群落结构受到凋落物化学组分的显著影响(图5)。细菌中的放线菌门、酸杆菌门和一些未被分类的细菌门的相对丰度与凋落物初始纤维素、半纤维素、木质素和C含量,以及C∶N和木质素∶N显著正相关,而与凋落物初始N含量显著负相关(P<0.05)。芽单胞菌门、黏球菌门、厚壁菌门和拟杆菌门的相对丰度与凋落物初始木质素和C含量,以及C∶N和木质素∶N显著负相关,而与凋落物初始N含量显著正相关(P<0.05)。就真菌而言,子囊菌门相对丰度与凋落物初始N含量显著正相关,与纤维素和半纤维素含量,C∶N和木质素∶N显著负相关。担子菌门、毛霉菌门、捕虫酶亚门和一些未被分类的真菌门的相对丰度与凋落物初始N含量显著负相关,与纤维素和半纤维素含量,C∶N和木质素∶N显著正相关(P<0.05)。然而,前15个月的总分解速率与微生物群落结构无显著相关关系(P>0.05)。
图5
图5
凋落物化学成分和分解速率与微生物群落结构的相关性
Fig.5
Correlations between litter chemical compositions, decomposition rates, and microbial community structures
3 讨论
3.1 凋落物分解速率
各物种凋落物的质量损失率和分解速率表现出显著差异。一年生杂类草尖头叶藜的分解速率最高,主要是由于其具有较高的N含量和较低的木质素、纤维素和半纤维素含量,及C∶N和木质素∶N。大量研究表明,凋落物初始N和木质素含量、C∶N和木质素∶N等质量特性显著影响凋落物的分解,具有较高N含量和较低木质素含量、C∶N和木质素∶N的凋落物表现出更快的分解速率[19-20]。优势固沙灌木小叶锦鸡儿由于具有生物固氮能力,凋落物N含量相对较高,进而表现出较高的分解速率。尽管一年生禾草狗尾草的凋落物N含量远低于豆科植物达乌里胡枝子,分解速率却高于达乌里胡枝子凋落物。对各物种凋落物初始化学组分的比较分析结果表明,达乌里胡枝子的凋落物具有较高的C和木质素含量,其直接影响分解后期的质量损失快慢。这些结果意味着凋落物分解各阶段受不同初始化学组分指标的影响,应综合考虑凋落物易分解和难分解物质含量。
3.2 土壤微生物群落结构对凋落物分解的响应
凋落物主要是由纤维素、半纤维素、多糖和木质素等聚合物组成,其分解过程需要源自微生物分解者的多种酶作为团体降解复杂的木质素/纤维素底物[9]。一般认为,真菌是陆地生态系统中占主导地位的顽固性底物的主要分解者,而细菌是易分解底物的快速回收者[21]。本研究发现凋落物分解后15个月的真菌群落对凋落物输入响应较细菌更敏感。这是由于该时期处于凋落物难分解物质阶段,而真菌(尤其是担子菌门和子囊菌门)较细菌具有更低的营养需求和更广泛的细胞胞外酶,使其能分解顽固性化合物[22]。此外,细菌群落以放线菌门、变形菌门、绿弯菌门和酸杆菌门为主,真菌群落以子囊菌门为主导,与已有研究结果一致[23]。研究也表明,细菌中变形菌门、拟杆菌门和放线菌门以及真菌中的担子菌门和子囊菌门通常在土壤C、N循环和凋落物分解中占据重要地位[24-26]。
3.3 凋落物化学组分对土壤微生物群落结构的影响
凋落物化学成分是影响微生物群落结构变化最主要的影响因素,已被大量研究所证实[29-30]。例如,南方红壤丘陵区典型物种的研究发现,凋落物分解过程中细菌相对丰度与凋落物初始C∶N和木质素∶N显著负相关,而真菌则与初始C∶N和木质素∶N显著正相关[31]。本研究中,RDA分析结果表明凋落物初始N含量、C∶N、木质素∶N显著影响真菌丰富度。这是由于真菌(尤其是担子菌门和子囊菌门)具有较低的营养需求和更广泛的细胞胞外酶,使其能分解顽固性化合物[22],因此凋落物中C源输入在该分解阶段优先支持更多样化的真菌群落繁殖[32]。然而,细菌多样性和丰富度与凋落物初始化学组分无显著相关关系,由于细菌与真菌对C、N资源需求比例不同,细菌群落通常是易分解底物的快速回收者[33]。
此外,凋落物初始化学组分对细菌和真菌群落优势种具有显著影响。对黄土高原3种林分凋落物分解的研究发现凋落物初始K、C和Mg含量以及C∶P对腺菌属和成对杆菌属(Dyadobacter)相对丰度影响最大,而P含量对鞘氨醇单胞菌属(Sphingomonas)、薄层杆菌属(Hymenobacter)和甲基杆菌属(Methylobacterium)相对丰度影响最大[34]。本研究中,凋落物初始C含量、木质素含量、C∶N和木质素∶N对真菌群落中的担子菌门、毛霉菌门、捕虫霉亚门和一些未被分类的真菌门的相对丰度呈显著正相关关系,说明在凋落物分解后期主要是以上菌群主导难分解物质木质素的分解。本研究结果表明细菌群落中一些未被分类的细菌门也受凋落物初始C∶N和木质素∶N的显著促进作用。近年来逐渐有学者发现细菌群落对凋落物中纤维素和半纤维素等物质也具有较强的分解能力,其作用甚至大于真菌群落。这些研究结果说明,尽管细菌和真菌群落对底物偏好和营养获取策略可能有所不同,但细菌在凋落物分解中扮演着不可忽视的角色。例如,Zheng等[35]通过微生物网络分析和凋落物分解验证试验发现,林地、农田和荒废农田3种土地利用方式下,细菌中的金杆菌属和真菌中的镰刀菌属、曲霉属和青霉属是凋落物分解的关键类群。
4 结论
本研究分析了科尔沁沙地优势植物凋落物分解特征及其对土壤微生物群落结构的影响。其中,一年生杂类草尖头叶藜和优势固沙灌木小叶锦鸡儿表现出较快的凋落物分解速率,而多年生禾草糙隐子草和多年生半灌木达乌里胡枝子则具有较慢的分解特征。经过15个月的分解过程,本研究结果表明细菌群落的α多样性(物种多样性和丰富度)显著增加,而真菌群落的多样性则呈现下降趋势。进一步分析表明,凋落物初始化学特性(包括N、木质素、纤维素和半纤维素含量)及其化学计量比(C∶N和木质素∶N)对土壤微生物群落结构和优势菌门相对丰度具有显著调控作用。在固沙植被建设中可考虑采用分解特征互补的物种组合,将有利于土壤微生物功能维持和土壤有机质的长期积累。然而,考虑到凋落物分解过程中微生物群落结构会随着凋落物化学组分的改变发生变化,未来研究中有必要进一步探究微生物群落结构在凋落物分解过程中的变异性。
参考文献
The change of global terrestrial ecosystem net primary productivity (NPP) and its response to climate change in CMIP5
[J].
Litter chemistry influences decomposition through activity of specific microbial functional guilds
[J].
Rates of litter decomposition in terrestrial ecosystems:global patterns and controlling factors
[J].
The origin of litter chemical complexity during decomposition
[J].
Nitrogen and lignin control of hardwood leaf litter decomposition dynamics
[J].
Interactions between litter lignin and soil nitrogen availability during leaf litter decomposition in a Hawaiian Montane forest
[J].
The microbial efficiency-matrix stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter?
[J].
Plant species effects on nutrient cycling: revisiting litter feedbacks
[J].
Litter quality versus soil microbial community controls over decomposition: a quantitative analysis
[J].
Stimulation of different functional groups of bacteria by various plant residues as a driver of soil priming effect
[J].
Linking molecular deadwood-inhabiting fungal diversity and community dynamics to ecosystem functions and processes in Central European forests
[J].
Going underground:root traits as drivers of ecosystem processes
[J].
Litter decomposition and organic matter turnover in northern forest soils
[J].
Dynamics of alpine plant litter decomposition in a changing climate
[J].
Formation of soil organic matter via biochemical and physical pathways of litter mass loss
[J].
Mass loss and nutrient release during the decomposition of sixteen types of plant litter with contrasting quality under three precipitation regimes
[J].
Decomposition and nutrient release of Eichhornia crassipes (Mart.) Solms.under different trophic conditions in wetlands of Eastern Himalayan foothills
[J].
Global patterns of the dynamics of soil carbon and nitrogen stocks following afforestation:a meta-analysis
[J].
Labile soil carbon inputs mediate the soil microbial community composition and plant residue decomposition rates
[J].
Living in a fungal world: impact of fungi on soil bacterial niche development
[J].
Fungal community on decomposing leaf litter undergoes rapid successional changes
[J].
Genomic insights into the Acidobacteria reveal strategies for their success in terrestrial environments
[J].
Soil bacterial diversity and composition of different forest types in Greater Xing'an Mountains,China
[J].
Tree species richness and fungi in freshly fallen leaf litter:unique patterns of fungal species composition and their implications for enzymatic decomposition
[J].
Changing characteristics andinfluencing factors of the soil microbial community during litter decompositionin a mixed Quercus acutissima Carruth.and Robinia pseudoacacia L.forest in Northern China
[J].
Soil bacterial commun ity dynamics reflect changes in plant community and soil properties during the secondary succession of abandoned farmland in the Loess Plateau
[J].
Leaf litter diversity alters microbial activity,microbial abundances,and nutrient cycling in a subtropical forest ecosystem
[J].
Correlations between the composition of modular fungal communities and litter decomposition-associated ecosystem functions
[J].
Network analysis and subsequent culturing reveal keystone taxa involved in microbial litter decomposition dynamics
[J].




 甘公网安备 62010202000688号
甘公网安备 62010202000688号