0 引言
干旱地区降水少、蒸发强烈、植物类群相对匮乏,而土壤结皮广泛分布,在一些地区甚至占生物覆盖率的70%以上。土壤结皮是表层土壤在物理、化学或生物作用下形成的一层致密土壤层。传统观点根据结皮中是否含有生物组分,将土壤结皮划分为物理土壤结皮(Physical soil crusts, PSCs)和生物土壤结皮(Biological soil crusts, BSCs)两类。但越来越多的研究表明,物理结皮的形成是雨滴冲溅、降尘堆积等物理作用与土壤微生物活动共同作用的结果,因此,目前倾向于将传统意义上的物理结皮命名为微生物结皮,纳入生物土壤结皮的范畴[1-2]。生物土壤结皮是由微生物、藻类、地衣和苔藓植物与土壤表层颗粒胶结形成的复合生物土壤层[3]。根据优势物种的不同,一般将生物土壤结皮划分为微生物结皮、藻结皮、地衣结皮和苔藓结皮4个发育阶段。生物土壤结皮形成初期颜色较浅,胶结较差,对水蚀和风蚀的防治能力较弱,保水能力较差。随着生物土壤结皮的发育,陆续出现颜色较深的藻类、地衣或苔藓结皮,它们具有较高的生物代谢效率和防护能力[4]。在干旱、半干旱区,生物土壤结皮的形成和发育对稳定土壤表面、提高土壤抵抗风蚀与水蚀能力、增加土壤肥力和促进土壤发育具有重要的生态学意义[5-8]。
细菌在生物土壤结皮的形成和发育过程中扮演着重要角色。在干旱地区,许多耐旱、耐高温(可达70 ℃)的细菌能够生存在沙土表面,通过自身的生理代谢改变沙土表面的物理和化学性质,为生物土壤结皮的形成和发育奠定良好的生物学基础[9]。此外,细菌也是形成土壤团聚体不可缺少的组成部分,如拟杆菌和蓝藻,可以通过分泌胞外多糖或利用菌丝黏结土壤颗粒,维持生物土壤结皮结构[10]。更为重要的是,作为初级生产者,细菌(主要为蓝藻)通过固定大气中的碳和氮来增加土壤肥力[11],为生物土壤结皮的进一步发育提供了有力保障。因此,研究不同发育阶段生物土壤结皮的细菌群落组成、多样性及其变化,对全面解析生物土壤结皮发育机制与生态功能具有重要意义。
国内外学者已开展了大量关于生物土壤结皮内细菌群落的相关研究,研究区包括非洲南部的卡拉哈里沙漠[12]、以色列的内盖夫荒漠[13],以及中国的腾格里沙漠[14]、古尔班通古特沙漠[15]等。部分研究表明,微生物的群落组成在生物土壤结皮的不同发育阶段存在显著差异。藻结皮和地衣结皮中蓝藻门的相对丰度通常较高[16-18],而在苔藓结皮中变形菌门、放线菌门和拟杆菌门的相对丰度高于蓝藻[18-19],但目前对于细菌群落组成随生物土壤结皮发育的变化规律的认识还不够深入。关于细菌多样性随生物土壤结皮发育的变化趋势目前还没有定论,一些研究认为细菌多样性随生物土壤结皮发育逐渐增加[18,20],另一些研究则表明细菌多样性在结皮发育中期最高,之后逐渐降低[2,21]。生物土壤结皮的细菌群落组成通常受到蓝藻丰度、土壤水分、土壤颗粒组成和电导率的影响[22-23],而蓝藻丰度与降水量、土壤酸碱度和土壤颗粒组成等相关[24]。微生物的研究方法也是影响研究结果的重要因素。以往的研究主要采用平板培养、磷脂脂肪酸分析(PLFA)、变形梯度凝胶电泳技术(PCR-DGGE)和16S rRNA基因文库构建技术等传统方法[25],这些方法能够提供的菌群信息十分有限,在很大程度上低估了菌群的物种组成但高估了其相对丰度。近年来,采用高通量测序方法分析细菌群落组成及其变化的研究逐渐增多[18,22,26]。与传统方法相比,高通量测序技术无需构建克隆,耗时少,通量高,能够更加准确全面地反映细菌群落的组成和结构。
毛乌素沙地处于中国半干旱区向半湿润区的过渡地带,是西北地区重要的生态屏障[27]。臭柏(Sabina vulgaris)作为毛乌素沙地天然分布的唯一常绿针叶灌木,在防沙治沙及生物多样性保护等方面发挥着重要作用[28]。生物土壤结皮广泛分布于臭柏沙地中,已有少量研究探讨了生物土壤结皮对土壤理化性质[29]和臭柏生长的影响[30],但未见臭柏群落生物土壤结皮的细菌群落组成及多样性等方面的报道。本研究采用Illumina高通量测序技术,对毛乌素沙地臭柏群落不同发育阶段生物土壤结皮的细菌多样性和群落组成进行分析,旨在揭示细菌群落随生物土壤结皮发育的变化规律,为深入理解半干旱区生物土壤结皮发育机制与生态功能提供科学数据。
1 材料与方法
1.1 研究区概况
研究区位于毛乌素沙地中部,隶属于内蒙古自治区鄂尔多斯市乌审旗。毛乌素沙地总面积约4×104 km2,海拔1 200~1 600 m[31],属半干旱大陆性季风气候,年均气温8.4 ℃,年降水量341 mm,7—9月的降水量约占全年降水量的70%[32]。土壤主要为风沙土,地表物质疏松,沙物质丰富,风沙活动强烈。毛乌素沙地主要由固定、半固定和流动沙地组成,在固定和半固定沙地普遍分布着生物土壤结皮。沙地上主要分布沙生植被,面积最大的沙生植被是以油蒿(Artemisia ordosica)为建群种的油蒿群落,其次是分别以柠条(Caragana korshinskii)、臭柏和沙柳(Salix cheilophila)等为建群种的沙生植物群落。毛乌素沙地臭柏群落总面积约6 600 hm2,主要分布于固定和半固定沙地,多呈团块状分布。臭柏群落盖度70%~95%,平均高度0.85 m,最高可达1.8 m[33]。臭柏匍匐茎贴近地面生长,覆沙后可生不定根,匍匐茎与根系能够在沙丘上形成很致密的网络,因而具有强大的固沙功能。同时,臭柏枝叶稠密且贴近地面,能有效降低风速,减轻土壤风蚀,有利于细颗粒物质积累,为生物土壤结皮的发育创造了有利条件。不同发育阶段的生物土壤结皮在臭柏群落中广泛分布,其基本特征如下: 微生物结皮呈灰白色,覆盖在土壤表层,厚度一般小于3 mm,易破碎;藻类结皮呈黑褐色,表面较粗糙,厚度3~5 mm;地衣结皮是蓝、绿藻和真菌的共生体,其表面往往形成深色的叶状体,厚5~10 mm;苔藓结皮表面长有藓类植物,干旱缺水时呈深褐色,雨后呈鲜绿色,厚10~20 mm。
1.2 样品采集
样品的采集工作于2017年8月中下旬进行。采样地点位于乌审旗臭柏自然保护区内(38°28′N、108°42′E)。在集中连片的臭柏群落内选取3块相对平坦并且生物土壤结皮发育较好、各个发育阶段比较齐全的区域作为样地,每个样地的面积约为60 m×60 m,样地之间由高大沙丘或密集的臭柏群落分隔。在每个样地内,随机采集4种不同发育阶段的生物土壤结皮:微生物结皮、藻结皮、地衣结皮和苔藓结皮,并以裸沙作为生物土壤结皮尚未发育的初始阶段(对照)。为减少空间异质性对样品的影响,在每个样地内对5个发育阶段各采集5个样品并分别进行混合,作为该样地的样品。采样时先用培养皿(直径9.0 cm)确定取样范围,再用无菌铲将结皮层从土壤表面剥离。为防止不同样品间的相互影响,取样用品均在取样间隙用75%酒精消毒。采集好的样品一部分装入已知重量的铝盒,称重后带回用以结皮层含水量的测定;另一部分装入无菌的封口袋,并放入冰盒,尽快运回实验室进行后续分析。封口袋中的样品过2 mm筛,去除植物残体和碎石后分为3部分。第1部分于4 ℃下保存,尽快用于硝态氮、铵态氮以及微生物量碳与微生物量氮的测定。第2部分自然风干,用于结皮层有机碳、总碳、总氮、总磷和结皮层pH的测定。第3部分于-80 ℃下保存,用于结皮层土壤DNA的提取。
1.3 结皮层理化性质和微生物量测定
结皮层含水量的测定采用烘干法,将装有样品的铝盒在110 ℃下烘干至恒重,计算含水量。硝态氮和铵态氮含量用2 mol·L-1氯化钾溶液提取后,在流动分析仪上进行测定(Autoanalyzer II,Technicon,美国)。微生物量碳和微生物量氮的测定采用氯仿熏蒸萃取法。结皮层有机碳的测定采用重铬酸钾氧化-分光光度法,在加热条件下,样品中的有机碳被过量重铬酸钾-硫酸溶液氧化,然后在585 nm波长处测定吸光度,计算有机碳含量。全碳和全氮用元素分析仪进行测定(2400II CHN elemental analyzer; Perkin-Elmer, USA)。全磷的测定采用硫酸-高氯酸消煮法-钼锑抗比色法。将10 g样品溶于50 mL蒸馏水中,用酸度计进行结皮层pH值的测定。
1.4 DNA提取、扩增和测序
样品DNA的提取参照MoBio PowerSoil® DNA isolation kit提取试剂盒(MO BIO Laboratories, Carlsbad, CA,USA)的说明书进行。然后采用NanoDrop-1000分光光度计(NanoDrop Technologies Inc.,DE,美国)检测所提取的DNA溶液在230、260 nm和280 nm 处的吸光值,根据260/280 nm(>1.8)和260/230 nm(>1.7)的比率,评价提取的总DNA的质量。质量合格的样品,使用Quant-IT Pico Green dsDNA试剂盒对最终的DNA浓度进行定量。
DNA样品送至天津诺禾致源生物信息科技有限公司,对细菌16S rRNA 基因V4区进行扩增和测序。扩增引物为515F(5ʹ-GTGCCAGCMGCCGCGGTAA-3ʹ)和 806R(5ʹ-GGACTACHVGGGTWTCTAAT-3ʹ)。测序平台为Illumina Hiseq PE250。
1.5 测序数据分析
测序生成的原始序列数据使用QIIME 1.9.0进行处理[34]。根据标签序列和 PCR 扩增引物序列从下机数据中拆分出各样品数据,去除标签和引物序列后,根据双端读长(PE reads)之间的重叠关系,用FLASH程序将长度足够的成对端读序列与至少30 bp的重叠序列拼接成平均片段长度为253 bp的全长序列。采用Btrim程序过滤质量低于20的碱基,随后用UPARSE软件去除嵌合序列,并根据97%的序列相似度聚类生成不同的操作分类单元(Operational Taxonomic Units,OTUs)。为提高数据质量,去除只在所有样品中出现一次的OTU。并以SILVA(SSU115)16S核糖体RNA数据库为参考,对细菌的代表性OTU序列进行分类比对。各样品的细菌序列读取数位于76 383~81 249,为纠正不同测序深度引起的偏差,将每个样品的序列数据归一化为76 383个。
1.6 数据统计分析
采用单因素方差分析(One-way ANOVA)比较不同发育阶段生物土壤结皮理化性质和微生物量,用最小显著性差异法(Least Significant difference, LSD)检验不同发育阶段的差异显著性,P<0.05时差异具有统计学意义。通过计算各样品的物种丰富度指数(Chao1)和多样性指数(Shannon-Wiener和Simpson)评估各样品Alpha多样性。采用主坐标分析(Principal coordinates analysis,PCoA)对不同发育阶段生物土壤结皮细菌群落组成进行可视化,并采用3种非参数检验方法进一步检验细菌群落差异的显著性,即ANOSIM(Analysis of similarities)、MRPP(Multi-response permutation procedures)和Adonis(Permutational multivariate analysis of variance)。最后,采用Mantel检验测定环境因子与生物土壤结皮细菌群落组成的相关关系。所有统计检验由R软件Vegan包(v.2.5-5)完成,PCoA分析采用R软件WGCNA和stats包完成,绘图采用ggplot2包(v.3.2-0)完成。
2 结果和分析
2.1 结皮层理化性质
随生物土壤结皮发育,结皮层理化性质发生显著变化(表1)。结皮含水量在不同发育阶段差异显著(P<0.05),裸沙含水量最低,为5.27%,随生物土壤结皮发育,结皮含水量逐渐增加,苔藓结皮含水量最高,为22.25%。有机碳、全碳、全氮和全磷含量也随生物土壤结皮的发育逐渐增加(P<0.05),有机碳在生物土壤结皮的发育过程中增长26.15倍,全碳、全氮和全磷也分别增长12.64、3.59倍和1.33倍。硝态氮和结皮层pH值随生物土壤结皮发育逐渐降低(P<0.05),苔藓结皮最低。铵态氮含量随生物土壤结皮发育呈上升趋势,但不同发育阶段之间差异不显著(P>0.05)。
表1 不同发育阶段结皮层理化性质(平均值±标准误差)
Table 1
| 项目 | 裸沙 | 微生物结皮 | 藻结皮 | 地衣结皮 | 苔藓结皮 |
|---|---|---|---|---|---|
| 土壤含水量/% | 5.27±0.11d | 12.67±1.50c | 15.11±0.90c | 18.66±1.78b | 22.25±1.49a |
| 有机碳/(g·kg-1) | 0.80±0.07d | 6.24±0.41c | 11.74±0.83b | 16.47±1.35b | 20.92±0.58a |
| 全碳/(g·kg-1) | 2.27±0.18d | 15.44±1.64c | 20.05±2.01c | 24.22±0.52b | 28.71±3.93a |
| 全氮/(g·kg-1) | 0.37±0.11c | 0.76±0.15b | 0.76±0.09b | 0.79±0.09b | 1.33±0.18a |
| 硝态氮/(mg·kg-1) | 1.61±0.03a | 1.60±0.02a | 1.32±0.07b | 0.87±0.07c | 0.68±0.10c |
| 铵态氮/(mg·kg-1) | 0.48±0.16 | 0.51±0.19 | 0.55±0.09 | 0.53±0.04 | 0.58±0.15 |
| 全磷/(g·kg-1) | 0.51±0.05b | 0.53±0.06b | 0.65±0.06a | 0.66±0.04a | 0.68±0.02a |
| pH | 7.07±0.03a | 7.01±0.01a | 7.02±0.01a | 6.91±0.03b | 6.89±0.01b |
不同字母表示不同发育阶段结皮层理化性质的差异显著性(P<0.05)。
2.2 微生物量、细菌群落多样性和群落结构
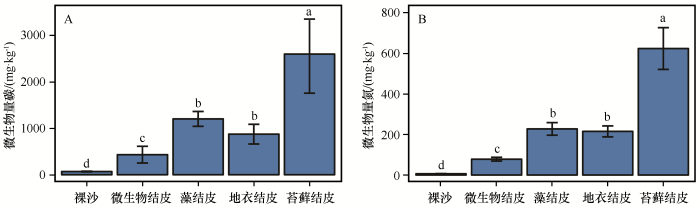
随生物土壤结皮发育,微生物量碳含量显著增加(图1),在苔藓结皮达到最高,为2 596.02 mg·kg-1,是裸沙的38倍。藻结皮和地衣结皮的微生物量碳含量无显著差异(P=0.065)。微生物量氮含量也随生物土壤结皮发育显著增加,苔藓结皮的微生物量氮约是裸沙的84.52倍。藻结皮和地衣结皮的微生物量氮无显著差异(P=0.077)。
图1
图1
不同发育阶段的生物土壤结皮微生物生物量碳和微生物生物量氮
误差线表示标准误差(n=3),不同字母表示差异显著(P<0.05)
Fig.1
Microbial biomass carbon and microbial biomass nitrogen of different developmental stages of biological soil crusts
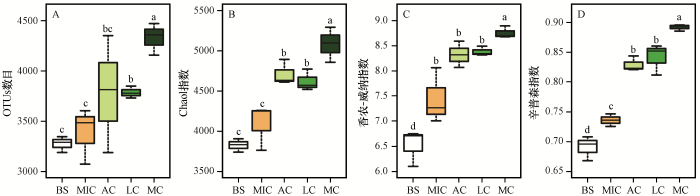
为进一步分析细菌群落组成随生物土壤结皮发育的变化,对各发育阶段细菌群落的Alpha多样性进行了评价。细菌群落的OTU数目随生物土壤结皮发育显著增加(图2),其中,裸沙样品获得3 195~3 355个OTU,微生物结皮获得3 108~3 666个OTU,藻结皮获得3 202~4 366个OTU,地衣结皮获得3 727~3 845个OTU,苔藓结皮获得4 170~4 488个OTU。除直接获得的OTU数目以外,Chao1指数也是生态学中常用来评价物种丰富度的指数。裸沙的Chao1指数显著低于其他发育阶段(P<0.05),且随生物土壤结皮发育Chao1指数显著增加,苔藓结皮最高。香农-威纳指数(Shannon-Wiener Index)和辛普森指数(Simpson Index)常用于反映样品的Alpha多样性,数值越大表示样品的多样性越高。香农-威纳指数和辛普森指数的大小均表现为裸沙<微生物结皮<藻结皮<地衣结皮<苔藓结皮,表明细菌多样性随生物土壤结皮发育显著增加。
图2
图2
不同发育阶段生物土壤结皮细菌多样性指数
BS,裸沙;MIC,微生物结皮;AC,藻结皮;LC,地衣结皮;MC,苔藓结皮。不同字母表示差异显著(P<0.05)
Fig.2
Diversity index of the bacterial communities in different developmental stages of biological soil crusts
图3
图3
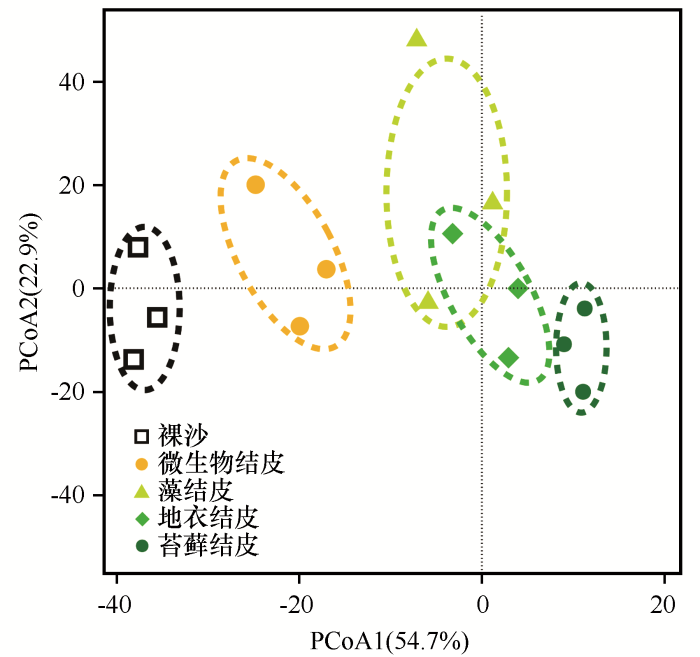
不同发育阶段生物土壤结皮细菌群落主坐标分析(PcoA)
Fig. 3
Principal coordinates analysis (PCoA) of the bacterial communities in different developmental stages of biological soil crusts
表2 不同发育阶段生物土壤结皮细菌群落组成的不相似检验
Table 2
| 样品分组 | ANOSIM | MRPP | Adonis | |||
|---|---|---|---|---|---|---|
| R | P | A | P | R2 | P | |
| 裸沙-微生物结皮 | 0.986 | 0.002 | 0.009 | 0.003 | 0.746 | 0.002 |
| 裸沙-藻结皮 | 0.926 | 0.014 | 0.087 | 0.021 | 0.594 | 0.018 |
| 裸沙-地衣结皮 | 0.996 | 0.008 | 0.051 | 0.004 | 0.684 | 0.006 |
| 裸沙-苔藓结皮 | 0.979 | 0.003 | 0.160 | 0.028 | 0.793 | 0.022 |
| 微生物结皮-藻结皮 | 0.370 | 0.048 | 0.013 | 0.041 | 0.184 | 0.039 |
| 微生物结皮-地衣结皮 | 0.926 | 0.009 | 0.106 | 0.039 | 0.364 | 0.028 |
| 微生物结皮-苔藓结皮 | 0.778 | 0.028 | 0.120 | 0.026 | 0.376 | 0.004 |
| 藻结皮-地衣结皮 | 0.222 | 0.045 | 0.012 | 0.023 | 0.210 | 0.047 |
| 藻结皮-苔藓结皮 | 0.370 | 0.039 | 0.022 | 0.035 | 0.195 | 0.036 |
| 地衣结皮-苔藓结皮 | 0.481 | 0.033 | 0.104 | 0.020 | 0.358 | 0.011 |
P值以粗体表示显著相关(P<0.05)。
2.3 门和属水平的细菌群落组成
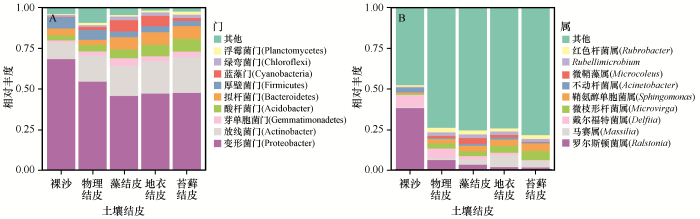
在相似性为97%的水平上,所有检测的OTU可以划分为42个细菌门类。其中,相对丰度大于1%的门类有9个,为变形菌门(Proteobacteria,53.8%±9.1%)、放线菌门(Actinobacteria,17.7%±4.3%)、拟杆菌门(Bacteroidetes,6.0%±2.3%)、酸杆菌门(Acidobacteria,5.6%±1.9%)、厚壁菌门(Firmicutes,4.8%±1.7%)、蓝藻门(Cyanobacteria,3.5%±2.9%)、芽单胞菌门(Gemmatimonadetes,2.8%±1.0%)、绿弯菌门(Chloroflexi,1.8%±0.5%)和浮霉菌门(Planctomycetes,1.2%±0.5%)。这几个门类的细菌相对丰度占各样品细菌总丰度的90% 以上,其他门类的细菌相对丰度占细菌总丰度的不到10%(图4A)。随生物土壤结皮发育,细菌群落发生显著变化,特别是一些富营养类群的相对丰度逐渐增加:从裸沙到苔藓结皮,放线菌门的相对丰度从10.3%显著增加到22.3%(P=0.006);酸杆菌门的相对丰度从3.1%显著增加到8.0%(P=0.001);拟杆菌门的相对丰度从3.3%显著增加到7.9%(P=0.010);绿弯菌门的相对丰度从1.2%显著增加到2.2%(P=0.042;表3)。相反,属于寡营养菌的变形菌门和厚壁菌门的相对丰度逐渐降低:变形菌门从69.3%显著降低到48.1%(P=0.012);厚壁菌门的相对丰度从7.0% 显著降低到3.2%(P=0.027)。此外,蓝藻门在藻结皮中的相对丰度(7.2%)显著高于其他发育阶段(P<0.05);芽单胞菌门和浮霉菌门在不同发育阶段生物土壤结皮中的相对丰度差异不显著(P>0.05)。
图4
图4
不同发育阶段土壤结皮在门水平(A)和属水平(B)细菌群落组成
Fig.4
Bacterial community composition in different developmental stages of soil crusts at (A) phylum and (B) genus level
表3 不同发育阶段生物土壤结皮细菌的相对丰度
Table 3
| 分类水平 | 物种 | 相对丰度/% | ||||
|---|---|---|---|---|---|---|
| 裸沙 | 微生物结皮 | 藻结皮 | 地衣结皮 | 苔藓结皮 | ||
| 门水平 | 放线菌 (Actinobacteria) | 10.3±0.5c | 16.8±2.2b | 19.0±0.3a | 19.9±1.5a | 22.3±1.5a |
| 酸杆菌 (Acidobacteria) | 3.1±0.3c | 4.2±0.8b | 5.6±0.7a | 7.1±0.4a | 8.0±0.3a | |
| 拟杆菌 (Bacteroidetes) | 3.3±0.9b | 3.4±1.0b | 7.7±1.4a | 7.8±0.5a | 7.9±0.4a | |
| 绿弯菌 (Chloroflexi) | 1.2±0.3b | 1.2±0.1b | 2.1±0.2a | 2.2±0.2a | 2.2±0.1a | |
| 蓝藻 (Cyanobacteria) | 0.3±0.1d | 2.0±0.8c | 7.2±0.7a | 6.4±0.4b | 1.8±0.6c | |
| 变形菌 (Proteobacteria) | 69.3±2.3a | 57.2±1.7a | 47.1±8.1b | 47.3±1.8b | 48.1±1.5b | |
| 厚壁菌 (Firmicutes) | 7.0±1.1a | 6.4±0.7a | 3.6±0.3b | 3.7±0.5b | 3.2±1.0c | |
| 芽单胞菌(Gemmatimonadetes) | 1.3±0.7a | 2.6±0.7a | 3.6±0.5a | 3.1±0.6a | 3.4±1.5a | |
| 浮霉菌 (Planctomycetes) | 0.5±0.2a | 1.5±0.5a | 0.9±0.5a | 1.1±0.3a | 1.6±0.2a | |
| 属水平 | 鞘氨醇单胞菌(Sphingomonas) | 0.7±0.3c | 3.0±0.3b | 3.6±1.3ab | 3.9±0.6a | 4.7±0.6a |
| 马赛菌 (Massilia) | 0.6±0.2d | 1.3±0.3c | 3.2±0.3b | 6.9±1.4a | 4.1±1.6a | |
| 微枝形杆菌 (Microvirga) | 0.7±0.2c | 3.4±0.6b | 3.1±0.5b | 4.1±0.5b | 5.7±0.3a | |
| 微鞘藻 (Microcoleus) | 0.1±0.1c | 1.3±0.4b | 3.8±1.0a | 1.5±0.2b | 0.3±0.1c | |
| 罗尔斯顿菌 (Ralstonia) | 38.0±5.5a | 6.6±0.4b | 3.3±0.5c | 1.6±0.8c | 1.5±0.1c | |
| 戴尔福特菌 (Delftia) | 7.4±0.8a | 6.5±0.4a | 2.4±0.3b | 1.7±0.4b | 0.4±0.1c | |
| 不动杆菌 (Acinetobacter) | 3.0±1.4a | 0.7±0.6b | 1.2±1.6ab | 1.3±0.1ab | 0.7±0.4b | |
| Rubellimicrobium | 0.6±0.5a | 2.4±1.1a | 2.4±1.4a | 2.1±0.6a | 1.8±0.7ab | |
| 红色杆菌 (Rubrobacter) | 0.9±0.3b | 3.1±0.5a | 2.6±1.0a | 1.8±0.8ab | 2.3±1.1a | |
不同字母表示差异显著性(P<0.05)。
在属的分类水平上,相对丰度大于1%的细菌包括罗尔斯顿菌属(Ralstonia,10.2±14.8%)、马赛菌属(Massilia,3.2%±2.4%)、戴尔福特菌属(Delftia,3.7%±2.9%)、微枝形杆菌属(Microvirga,3.4%±1.7%)、鞘氨醇单胞菌属(Sphingomonas,3.2%±1.4%)、不动杆菌属(Acinetobacter,1.4%±0.9%)、微鞘藻属(Microcoleus,1.4%±1.4%)、Rubellimicrobium属(1.9%±0.7%)和红色杆菌属(Rubrobacter,2.1%±0.8%;图4)。这些属的相对丰度占各样品总丰度的38%以下,说明在属的分类水平上,结皮样品中含有大量相对丰度较低或未能被分类的细菌。随生物土壤结皮的发育,鞘氨醇单胞菌属、马赛菌属和微枝形杆菌属的相对丰度显著升高(P<0.05);罗尔斯顿菌属和戴尔福特菌属的相对丰度显著降低(P<0.05;表3)。微鞘藻属在藻结皮中的相对丰度(3.8%)显著高于其他发育阶段(P<0.05)。不动杆菌属、Rubellimicrobium属和红色杆菌属的相对丰度在不同发育阶段之间没有显著差异(P>0.05)。
2.4 细菌群落组成与环境因子的关系
为检验不同环境因子对生物土壤结皮细菌群落组成的影响是否显著,采用Mantel检验计算细菌群落组成与环境因子之间的关系。结果如表4所示,土壤含水量(P=0.001)、全碳(P=0.037)、有机碳(P=0.047)、全氮(P=0.044)、硝态氮(P=0.034)和全磷(P=0.029)均与生物土壤结皮的细菌群落组成显著相关,表明它们是影响生物土壤结皮细菌群落组成的主要环境因子。在这些环境因子中,土壤含水量对细菌群落组成的影响最大(R=0.539)。pH 值(P=0.624)和铵态氮(P=0.168)与细菌群落组成均没有显著相关关系。
表4 生物土壤结皮细菌群落与土壤环境因子的相关性
Table 4
| 门 | 含水量 | 全碳 | 有机碳 | 全氮 | 硝态氮 | 铵态氮 | 全磷 | pH |
|---|---|---|---|---|---|---|---|---|
| 细菌群落 | 0.539** | 0.424* | 0.517* | 0.352* | 0.441* | 0.167 | 0.392* | 0.044 |
| 放线菌(Actinobacteria) | 0.521* | 0.329** | 0.550** | 0.525* | 0.332* | 0.045 | 0.368* | 0.394 |
| 酸杆菌(Acidobacteria) | 0.304 | 0.543* | 0.498* | 0.636* | 0.109* | 0.143 | 0.379 | 0.152* |
| 拟杆菌(Bacteroidetes) | 0.646** | 0.536* | 0.800* | 0.304 | 0.115* | 0.177 | 0.386 | -0.211 |
| 绿弯菌(Chloroflexi) | 0.296* | 0.436 | 0.369* | 0.500 | 0.209 | 0.246 | 0.761* | 0.143 |
| 蓝藻(Cyanobacteria) | 0.246 | 0.268 | 0.742 | 0.332 | 0.235* | 0.696* | 0.696 | 0.199 |
| 变形菌(Proteobacteria) | -0.246* | -0.443 | -0.634 | -0.593** | 0.321* | -0.234 | -0.864* | -0.322 |
| 厚壁菌(Firmicutes) | -0.654* | -0.150 | -0.391 | -0.336 | 0.177 | -0.028 | -0.293 | -0.252 |
| 芽单胞菌(Gemmatimonadetes) | 0.271 | 0.239 | 0.284 | 0.429 | 0.273 | 0.314 | 0.511 | 0.442 |
| 浮霉菌(Planctomycetes) | 0.364 | 0.486 | 0.336 | 0.686* | 0.353 | 0.102 | 0.868 | 0.032 |
*显著相关,P<0.05;**极显著相关,P<0.01。
此外,采用Mantel检验分析了单个细菌门和环境变量之间的相关关系。放线菌门与土壤含水量(P=0.043)、全碳(P=0.008)、有机碳(P=0.002)、全氮(P=0.044)、硝态氮(P=016)和全磷(P=0.031)均显著相关。厚壁菌门与土壤含水量显著相关(P=0.027),与其他土壤环境因子均无显著相关关系(P>0.05)。
3 讨论
3.1 细菌群落组成变化对生物土壤结皮发育的生态学意义
微生物Alpha多样性指数的差异,在一定程度上可以反映土壤微生物群落组成差异。基于OTUs的多样性比较,我们发现细菌群落的物种丰富度和多样性均随生物土壤结皮发育显著增加,在苔藓结皮达到最高(图2)。虽然对不同发育阶段结皮的微生物做过类似整体性调查的研究较少,但也有证据表明随生物土壤结皮发育,细菌多样性指数显著增高。Mogul等[38]在莫哈韦沙漠中部的研究结果表明,不同地表覆盖区域早期生物土壤结皮的细菌多样性在结皮的发育过程中不断增长。李靖宇等[39]在腾格里沙漠的研究结果表明,与藻结皮相比,苔藓结皮的细菌群落具有更高的多样性。微生物群落的多样性对维持多种生态系统功能至关重要,多样性越高,维系的生态系统功能也相对较多[40]。因此,随生物土壤结皮发育,更加丰富和多样的细菌群落提供了更多的功能可能性。
在检测到的细菌中,变形菌门、放线菌门、蓝藻门和酸杆菌门是所有生物土壤结皮中的优势门类(图4),这一结果与腾格里沙漠和古尔班通古特沙漠的研究结果一致[22,41]。但本研究中蓝藻门的相对丰度(0.3%~7.2%)显著低于腾格里沙漠(10%~51%)和古尔班通古特沙漠(10%~30%)。Blaire等[42]的研究表明,气温升高和降水量的增加会显著降低蓝藻门的相对丰度。毛乌素沙地年均气温为8.4 ℃,年降水量为341 mm,腾格里沙漠年均气温为8.7 ℃,年降水量为203 mm,古尔班通古特沙漠年均气温5~5.7 ℃,年降水量80~160 mm。因此,较高的年均气温和年降水量导致毛乌素沙地生物土壤结皮中蓝藻门相对丰度低于其他两个沙漠。另一方面,Kuske等[43]在美国科罗拉多高原的研究发现,放牧践踏会导致生物土壤结皮蓝藻门的相对丰度降低,毛乌素沙地属农牧交错区,放牧强度高于其他两个沙漠,放牧践踏可能也是造成生物土壤结皮中蓝藻门相对丰度较低的原因。
随生物土壤结皮发育,细菌群落组成发生了显著变化。由于每种类群所执行的生态功能不同,群落组成的改变同时也可能伴随着生态功能的改变。在生物土壤结皮发育早期,抗逆性较强的寡营养类群,如变形菌门和厚壁菌门相对丰度较高,且随生物土壤结皮发育,这两个门类的相对丰度逐渐降低(表3)。变形菌门中的某些属,如本研究中检测到的鞘氨醇单胞菌属(Sphingomonas),可以分泌胞外多糖黏结土壤颗粒,可以减轻土壤风蚀[20],这对生物土壤结皮的形成非常重要。厚壁菌门因能产生内生孢子而具有耐干燥、防脱水、耐辐射的特性[44],通常在生物土壤结皮形成初期富集。Maier等[45]指出,这些先锋殖民者可以通过稳定土壤基质和输入营养来缓解生物土壤结皮发育早期的环境压力,促进结皮的发育。另外,变形菌门在氮限制条件下具有固氮作用[46],可以在生物土壤结皮形成初期提供必要的营养条件。
与之相反,一些富营养类群,如放线菌门、酸杆菌门、拟杆菌门和绿弯菌门的相对丰度随生物土壤结皮发育逐渐增加。放线菌大多具有发达的菌丝,对于维持生物土壤结皮的结构发挥重要作用[47],另外,放线菌可以降解多糖、酚类化合物等复杂化合物,其相对丰度的增加可能与生物土壤结皮发育后期植物和微生物残体的增加有关。酸杆菌作为嗜酸细菌[48],相对丰度在pH值显著低于其他发育阶段的苔藓结皮(表1)中较高。拟杆菌能分泌大量胞外多糖[20],其相对丰度的增加可能与生物土壤结皮发育后期土壤表层细颗粒含量增加以及植物群落生产力显著提高有关[22,49]。绿弯菌在生物土壤结皮发育过程中的作用还不清楚,但其被证明与无氧条件下的光合作用有关[50],所以绿弯菌在结皮下层土壤中较为常见。
3.2 环境因子影响不同发育阶段生物土壤结皮细菌群落的分布
Mantel检验结果表明,结皮层含水量、全碳、有机碳、全氮、硝态氮和全磷是影响不同发育阶段生物土壤结皮细菌群落结构的主要环境因子,其中结皮层含水量对细菌组成的影响最大(表4),这与腾格里沙漠的研究结果一致[2]。在干旱和半干旱区,水分的有效性和土壤养分含量是影响微生物群落的关键限制因素[55]。生物土壤结皮发育初期,细菌群落受到水分和养分条件的限制,随生物土壤结皮的发育,结皮层的水分和养分条件逐渐改善(表1),细菌群落结构逐渐发生变化。另一方面,结皮发育后期结皮层含水量的增加,使结皮层中的营养元素如硝态氮更容易溶解并被细菌利用,给细菌群落结构带来了显著影响。这些结果也说明细菌群落组成是反映生物土壤结皮不同发育阶段水分和养分状况的敏感指标。此外,不同细菌类群对环境因子的反应不同,可能是由于各类群具有独特的生态位。之前的研究认为,生态位在构建细菌群落结构中起着至关重要的作用[56]。因此,细菌群落组成随生物土壤结皮发育的变化,可能是因为不同发育阶段的生物土壤结皮选择了更适应特定生态位的物种,从而使其在竞争中胜过适应性较差的物种[57]。
4 结论
本研究揭示了分布于毛乌素沙地的臭柏群落的生物土壤结皮中细菌群落随生物土壤结皮发育的变化规律,为深入理解干旱和半干旱区生物土壤结皮的发育机制和生态功能提供了新的信息。研究表明,随生物土壤结皮发育,细菌群落的多样性显著增加,这对维持结皮发育过程中的多种生态功能至关重要。臭柏群落生物土壤结皮中的细菌群落以变形菌门、放线菌门、蓝藻门和酸杆菌门为优势菌群,细菌组成随生物土壤结皮发育发生显著变化。其中,寡营养类群,如厚壁菌门和变形菌门的相对丰度显著降低;富营养类群,如放线菌门、酸杆菌门、拟杆菌门和绿弯菌门的相对丰度显著增加;蓝藻门在藻结皮阶段的相对丰度显著高于其他发育阶段。由于每种类群所执行的生态功能不同,我们的结果也预示着细菌群落的生态功能随生物土壤结皮发育发生了潜在的变化,在结皮发育初期,通过促进土壤颗粒胶结增加土壤表面稳定性,减轻土壤风蚀和水蚀,在结皮发育后期,通过促进碳氮固定和凋落物分解促进生态系统的物质循环。细菌群落是生物土壤结皮发育过程中土壤水分和养分变化的敏感指标,土壤含水量、全碳、有机碳、全氮、硝态氮和全磷含量是促使生物土壤结皮细菌群落组成发生变化的主要环境因子。
参考文献
Development of bacterial communities in biological soil crusts along a revegetation chronosequence in the Tengger Desert, northwest China
[J].
The world at your feet: desert biological soil crusts
[J].
Biological soil crust and disturbance controls on surface hydrology in a semi-arid ecosystem
[J].
Microbial extracellular polymeric substances improve water retention in dryland biological soil crusts
[J].
腾格里沙漠东南缘生物土壤结皮对土壤理化性质的影响
[J].
Microorganism response to stressed terrestrial environments: a raman spectroscopic perspective of extremophilic life strategies
[J].
Extracellular polysaccharides from cyanobacterial soil crusts: a review of their role in dryland soil processes
[J].
Cyanobacteria inoculation enhances carbon sequestration in soil substrates used in dryland restoration
[J].
Niche partitioning of bacterial communities in biological crusts and soils under grasses, shrubs and trees in the Kalahari
[J].
Carbon utilization, microbial biomass, and respiration in biological soil crusts in the Negev Desert
[J].
Recovery of microbial community structure of biological soil crusts in successional stages of Shapotou desert revegetation, northwest China
[J].
Responses of microbial activities and soil physical-chemical properties to the successional process of biological soil crusts in the Gurbantunggut Desert, Xinjiang
[J].
The prokaryotic diversity of biological soil crusts in the Sonoran Desert (Organ Pipe Cactus National Monument, AZ)
[J].
Bacterial diversity, pigments and nitrogen fixation of biological desert crusts from the Sultanate of Oman
[J].
Bacterial diversity and community along the succession of biological soil crusts in the Gurbantunggut Desert, Northern China
[J].
Analyses of dryland biological soil crusts highlight lichens as an important regulator of microbial communities
[J].
The community and phylogenetic diversity of biological soil crusts in the colorado plateau studied by molecular fingerprinting and intensive cultivation
[J].
Comparative diversity and composition of cyanobacteria in three predominant soil crusts of the Colorado Plateau 
[J].
Pyrosequencing reveals significant changes in microbial communities along the ecological succession of biological soil crusts in the Tengger desert of China
[J].
Cyanobacterial populations in biological soil crusts of the northwest Negev Desert, Israel-effects of local conditions and disturbance
[J].fiw228
.
Advance in methods for research on soil microbial community structure
[J].
Soil bacterial and fungal community responses to nitrogen addition across soil depth and microhabitat in an arid shrubland
[J].
Landscape change and desertification development in the Mu Us Sandland, Northern China
[J].
Analysis of 16S rRNA gene amplicon sequences using the QIIME software package
[J].
Responses of microbial activities and soil physical-chemical properties to the successional process of biological soil crusts in the Gurbantunggut Desert, Xinjiang
[J].
A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems
[J].
Microbial community and biochemical dynamics of biological soil crusts across a gradient of surface coverage in the central Mojave Desert
[J].
Fungal-bacterial diversity and microbiome complexity predict ecosystem functioning
[J].
Bacterial diversity and community along the succession of biological soil crusts in the Gurbantunggut Desert, Northern China
[J].
Climate change and physical disturbance manipulations result in distinct biological soil crust communities
[J].
Response and resilience of soil biocrust bacterial communities to chronic physical disturbance in arid shrublands
[J].
Ecology of bacillaceae
[J].
Photoautotrophic organisms control microbial abundance, diversity, and physiology in different types of biological soil crusts
[J].
Non-cyanobacterial diazotrophs mediate dinitrogen fixation in biological soil crusts during early crust formation
[J].
Bacteria and non-lichenized fungi within biological soil crusts Biological soil crusts : an organizing principle in drylands
[M].
Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale
[J].
Microbial ecology of hot desert edaphic systems
[J].
Pyrosequencing reveals highly diverse and species-specific microbial communities in sponges from the Red Sea
[J].
Biological Soil Crusts:Structure, Function, and Management
[M].
Spatial segregation of the biological soil crust microbiome around its foundational cyanobacterium, Microcoleus vaginatus , and the formation of a nitrogen-fixing cyanosphere
[J].
Three distinct clades of cultured heterocystous cyanobacteria constitute the dominant N2-fixing members of biological soil crusts of the Colorado Plateau, USA
[J].
Effects of drought and salt stresses on man-made cyanobacterial crusts
[J].
Spatial and temporal biogeography of soil microbial communities in arid and semiarid regions
[J].
Relative roles of niche and neutral processes in structuring a soil microbial community
[J].
Rate-specific responses of prokaryotic diversity and structure to nitrogen deposition in the Leymus chinensis steppe
[J].




 甘公网安备 62010202000688号
甘公网安备 62010202000688号