Influences of 1.5 ℃ and 2.0 ℃ global warming scenarios on water use efficiency dynamics in the sandy areas of northern China
1
2019
... 全球气候变暖正在威胁着各种类型的生态系统[1],尤其是降水减少、环境温度升高以及频繁的极端天气加剧了典型脆弱区土地退化,其生态治理和修复也愈发困难[2].气候变化深刻影响着生态系统的结构和功能,包括群落物种组成以及系统稳定性[3],气候变暖影响了植物物候,破坏了种间关系平衡,群落结构简单稳定性差的系统物种更难适应快速变化的气候条件,负反馈也加剧了脆弱生态系统的窘境. ...
Global desertification:building a science for dryland development
1
2007
... 全球气候变暖正在威胁着各种类型的生态系统[1],尤其是降水减少、环境温度升高以及频繁的极端天气加剧了典型脆弱区土地退化,其生态治理和修复也愈发困难[2].气候变化深刻影响着生态系统的结构和功能,包括群落物种组成以及系统稳定性[3],气候变暖影响了植物物候,破坏了种间关系平衡,群落结构简单稳定性差的系统物种更难适应快速变化的气候条件,负反馈也加剧了脆弱生态系统的窘境. ...
科尔沁沙地植被恢复系列上群落演替与物种多样性的恢复动态
1
2004
... 全球气候变暖正在威胁着各种类型的生态系统[1],尤其是降水减少、环境温度升高以及频繁的极端天气加剧了典型脆弱区土地退化,其生态治理和修复也愈发困难[2].气候变化深刻影响着生态系统的结构和功能,包括群落物种组成以及系统稳定性[3],气候变暖影响了植物物候,破坏了种间关系平衡,群落结构简单稳定性差的系统物种更难适应快速变化的气候条件,负反馈也加剧了脆弱生态系统的窘境. ...
中国荒漠主要植物群落调查的意义、现状及方案
1
2023
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
Plant cell anatomy
1
1969
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
Rubisco,rubisco activase,and global climate change
1
2008
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
Chloroplast response to low leaf water potentials:III.differing inhibition of electron transport and photophosphorylation
1
1974
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
Temperature extremes:effect on plant growth and development
1
2015
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
科尔沁沙地典型林木蒸腾耗水与水文效应及生态防护功能研究
1
2022
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
Heat tolerance in plants:an overview
1
2007
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
脱落酸信号调控植物干旱胁迫响应的研究进展
1
2023
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
Functional significance of satellite DNAs:insights from Drosophila
1
2020
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
WRKY transcription factor response to high-temperature stress
1
2021
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
The plant heat stress transcription factors (HSFs):structure,regulation,and function in response to abiotic stresses
1
2016
... 了解全球变暖背景下植物的温度适应性对保护生态结构和生态安全都至关重要[4],植物在应对环境温度升高时会有由形态特征到生理特性的适应策略.高温加剧土壤水分蒸发导致植物生物量分配向根部转移[5].植物的光合生理特征也能清楚地反映环境温度变化[6],增温有利于提高寒带或高海拔地区植物的光合作用,但在沙地生态系统中高温伴随着干旱会降低植物光合作用效率,而且温度增幅太大还会对类囊体膜结构造成不可逆的破坏[7].高温胁迫会激活植物响应非生物胁迫信号途径中的激素调节,例如茉莉酸(JA)能激活温度适应性生理调节[8];脱落酸(ABA)能调控抑制生长、促进脱落、促进休眠、引起气孔关闭等生理过程.植物响应高温的生理调节主要通过提高超氧化物歧化酶等降低氧自由基的破坏[9-10],积累渗透调节物质维持渗透压防止水分散失[11].植物响应高温胁迫的基因表达受转录因子(TFs)网络调节[12],如MYB、AP2/ERF、NAC和WRKY[13]参与对非生物胁迫的反应,热休克转录因子(HSF)调节热休克蛋白处理热胁迫反应[14]. ...
1961-2019年东北地区作物生长不同阶段极端干期时空分布特征分析
1
2022
... 近年来,中国北方有明显的升温和干旱化倾向[15].科尔沁沙地位于中国北方农牧交错区,是脆弱敏感的沙地生态系统[16],也是沙漠化研究和防治的关键区域.近60年(1961—2018年)的气象数据显示,科尔沁沙地年均气温明显升高,10年变化速率为0.33 ℃[17].温度升高造成的土地沙漠化问题日益严重,威胁着区域生态安全与可持续发展[18].截至目前,对于科尔沁沙地区域植被的环境适应性已开展了研究,结果不同程度地揭示了增温条件下植物的多层次响应机制,即增温显著增加了沙地优势草本植物的物种丰度、生物量,改变了群落组成[19-20].研究发现优势灌木达乌里胡枝子(Lespedeza davurica)的生理特征更有利于维持温度较高沙地的植被稳定性[20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
Vegetation growth variation in relation to topography in Horqin Sandy Land
1
2020
... 近年来,中国北方有明显的升温和干旱化倾向[15].科尔沁沙地位于中国北方农牧交错区,是脆弱敏感的沙地生态系统[16],也是沙漠化研究和防治的关键区域.近60年(1961—2018年)的气象数据显示,科尔沁沙地年均气温明显升高,10年变化速率为0.33 ℃[17].温度升高造成的土地沙漠化问题日益严重,威胁着区域生态安全与可持续发展[18].截至目前,对于科尔沁沙地区域植被的环境适应性已开展了研究,结果不同程度地揭示了增温条件下植物的多层次响应机制,即增温显著增加了沙地优势草本植物的物种丰度、生物量,改变了群落组成[19-20].研究发现优势灌木达乌里胡枝子(Lespedeza davurica)的生理特征更有利于维持温度较高沙地的植被稳定性[20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
1961-2018年科尔沁沙地气候变化特征
1
2019
... 近年来,中国北方有明显的升温和干旱化倾向[15].科尔沁沙地位于中国北方农牧交错区,是脆弱敏感的沙地生态系统[16],也是沙漠化研究和防治的关键区域.近60年(1961—2018年)的气象数据显示,科尔沁沙地年均气温明显升高,10年变化速率为0.33 ℃[17].温度升高造成的土地沙漠化问题日益严重,威胁着区域生态安全与可持续发展[18].截至目前,对于科尔沁沙地区域植被的环境适应性已开展了研究,结果不同程度地揭示了增温条件下植物的多层次响应机制,即增温显著增加了沙地优势草本植物的物种丰度、生物量,改变了群落组成[19-20].研究发现优势灌木达乌里胡枝子(Lespedeza davurica)的生理特征更有利于维持温度较高沙地的植被稳定性[20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
Probabilistic projections of transient climate change
1
2013
... 近年来,中国北方有明显的升温和干旱化倾向[15].科尔沁沙地位于中国北方农牧交错区,是脆弱敏感的沙地生态系统[16],也是沙漠化研究和防治的关键区域.近60年(1961—2018年)的气象数据显示,科尔沁沙地年均气温明显升高,10年变化速率为0.33 ℃[17].温度升高造成的土地沙漠化问题日益严重,威胁着区域生态安全与可持续发展[18].截至目前,对于科尔沁沙地区域植被的环境适应性已开展了研究,结果不同程度地揭示了增温条件下植物的多层次响应机制,即增温显著增加了沙地优势草本植物的物种丰度、生物量,改变了群落组成[19-20].研究发现优势灌木达乌里胡枝子(Lespedeza davurica)的生理特征更有利于维持温度较高沙地的植被稳定性[20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
科尔沁沙质草地植物群落对增温的响应
1
2024
... 近年来,中国北方有明显的升温和干旱化倾向[15].科尔沁沙地位于中国北方农牧交错区,是脆弱敏感的沙地生态系统[16],也是沙漠化研究和防治的关键区域.近60年(1961—2018年)的气象数据显示,科尔沁沙地年均气温明显升高,10年变化速率为0.33 ℃[17].温度升高造成的土地沙漠化问题日益严重,威胁着区域生态安全与可持续发展[18].截至目前,对于科尔沁沙地区域植被的环境适应性已开展了研究,结果不同程度地揭示了增温条件下植物的多层次响应机制,即增温显著增加了沙地优势草本植物的物种丰度、生物量,改变了群落组成[19-20].研究发现优势灌木达乌里胡枝子(Lespedeza davurica)的生理特征更有利于维持温度较高沙地的植被稳定性[20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
Leaf physiological responses of three psammophytes to combined effects of warming and precipitation reduction in Horqin Sandy Land,Northeast China
2
2022
... 近年来,中国北方有明显的升温和干旱化倾向[15].科尔沁沙地位于中国北方农牧交错区,是脆弱敏感的沙地生态系统[16],也是沙漠化研究和防治的关键区域.近60年(1961—2018年)的气象数据显示,科尔沁沙地年均气温明显升高,10年变化速率为0.33 ℃[17].温度升高造成的土地沙漠化问题日益严重,威胁着区域生态安全与可持续发展[18].截至目前,对于科尔沁沙地区域植被的环境适应性已开展了研究,结果不同程度地揭示了增温条件下植物的多层次响应机制,即增温显著增加了沙地优势草本植物的物种丰度、生物量,改变了群落组成[19-20].研究发现优势灌木达乌里胡枝子(Lespedeza davurica)的生理特征更有利于维持温度较高沙地的植被稳定性[20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
... [20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
浑善达克沙地榆树根系分布特征及生物量研究
1
2002
... 近年来,中国北方有明显的升温和干旱化倾向[15].科尔沁沙地位于中国北方农牧交错区,是脆弱敏感的沙地生态系统[16],也是沙漠化研究和防治的关键区域.近60年(1961—2018年)的气象数据显示,科尔沁沙地年均气温明显升高,10年变化速率为0.33 ℃[17].温度升高造成的土地沙漠化问题日益严重,威胁着区域生态安全与可持续发展[18].截至目前,对于科尔沁沙地区域植被的环境适应性已开展了研究,结果不同程度地揭示了增温条件下植物的多层次响应机制,即增温显著增加了沙地优势草本植物的物种丰度、生物量,改变了群落组成[19-20].研究发现优势灌木达乌里胡枝子(Lespedeza davurica)的生理特征更有利于维持温度较高沙地的植被稳定性[20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
Tolerance of photosynthesis to high temperature in desert plants 1
1
1984
... 近年来,中国北方有明显的升温和干旱化倾向[15].科尔沁沙地位于中国北方农牧交错区,是脆弱敏感的沙地生态系统[16],也是沙漠化研究和防治的关键区域.近60年(1961—2018年)的气象数据显示,科尔沁沙地年均气温明显升高,10年变化速率为0.33 ℃[17].温度升高造成的土地沙漠化问题日益严重,威胁着区域生态安全与可持续发展[18].截至目前,对于科尔沁沙地区域植被的环境适应性已开展了研究,结果不同程度地揭示了增温条件下植物的多层次响应机制,即增温显著增加了沙地优势草本植物的物种丰度、生物量,改变了群落组成[19-20].研究发现优势灌木达乌里胡枝子(Lespedeza davurica)的生理特征更有利于维持温度较高沙地的植被稳定性[20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
A comparative analysis of photosynthetic recovery from thermal stress:a desert plant case study
1
2014
... 近年来,中国北方有明显的升温和干旱化倾向[15].科尔沁沙地位于中国北方农牧交错区,是脆弱敏感的沙地生态系统[16],也是沙漠化研究和防治的关键区域.近60年(1961—2018年)的气象数据显示,科尔沁沙地年均气温明显升高,10年变化速率为0.33 ℃[17].温度升高造成的土地沙漠化问题日益严重,威胁着区域生态安全与可持续发展[18].截至目前,对于科尔沁沙地区域植被的环境适应性已开展了研究,结果不同程度地揭示了增温条件下植物的多层次响应机制,即增温显著增加了沙地优势草本植物的物种丰度、生物量,改变了群落组成[19-20].研究发现优势灌木达乌里胡枝子(Lespedeza davurica)的生理特征更有利于维持温度较高沙地的植被稳定性[20].相较于草本和灌木,科尔沁沙地乔木对增温的响应研究较少.增温时乔木更易受蒸腾加剧引起水分不足导致成活率下降[21],有关新疆杨(Populus alba var. pyramidalis)、樟子松(Pinus sylvestris var. mongholica)、沙柳(Salix cheilophila)和沙木蓼(Atraphaxis bracteata)[22]等的试验表明乔木气孔导度要显著高于灌木树种,且沙地乔木的适应性研究仍以水分胁迫为核心[23]. ...
科尔沁沙地东南部地区主要植物叶片性状及其相互关系
1
2006
... 对此,本研究以科尔沁沙地代表性乔灌草植物沙地榆(Ulmus pumila var. sabulosa)、小叶杨(Populus simonii)、差不嘎蒿(Artemisia halodendron)、小叶锦鸡儿(Caragana microphylla)、狗尾草(Setaria viridis)和猪毛蒿(Artemisia scoparia)[24-26]为对象,结合转录组测序[27-28],目的在于:①明确沙地典型乔灌草植物在适应高温胁迫分子信号中占主导地位的转录因子家族;②揭示沙地代表性植物受增温影响的关键生理过程;③对比分析其重要通路的基因表达情况,探明不同生活型植物的温度适应性. ...
科尔沁沙地天然油松林与榆树疏林群落结构及多样性研究
1
2011
... 对此,本研究以科尔沁沙地代表性乔灌草植物沙地榆(Ulmus pumila var. sabulosa)、小叶杨(Populus simonii)、差不嘎蒿(Artemisia halodendron)、小叶锦鸡儿(Caragana microphylla)、狗尾草(Setaria viridis)和猪毛蒿(Artemisia scoparia)[24-26]为对象,结合转录组测序[27-28],目的在于:①明确沙地典型乔灌草植物在适应高温胁迫分子信号中占主导地位的转录因子家族;②揭示沙地代表性植物受增温影响的关键生理过程;③对比分析其重要通路的基因表达情况,探明不同生活型植物的温度适应性. ...
Plant transcriptomics and responses to environmental stress:an overview
2
2015
... 对此,本研究以科尔沁沙地代表性乔灌草植物沙地榆(Ulmus pumila var. sabulosa)、小叶杨(Populus simonii)、差不嘎蒿(Artemisia halodendron)、小叶锦鸡儿(Caragana microphylla)、狗尾草(Setaria viridis)和猪毛蒿(Artemisia scoparia)[24-26]为对象,结合转录组测序[27-28],目的在于:①明确沙地典型乔灌草植物在适应高温胁迫分子信号中占主导地位的转录因子家族;②揭示沙地代表性植物受增温影响的关键生理过程;③对比分析其重要通路的基因表达情况,探明不同生活型植物的温度适应性. ...
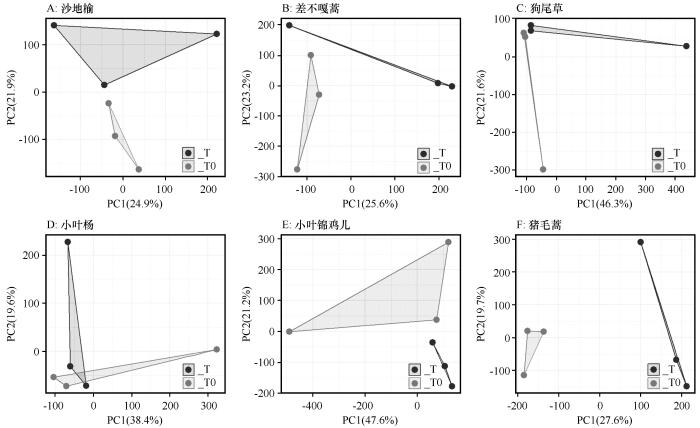
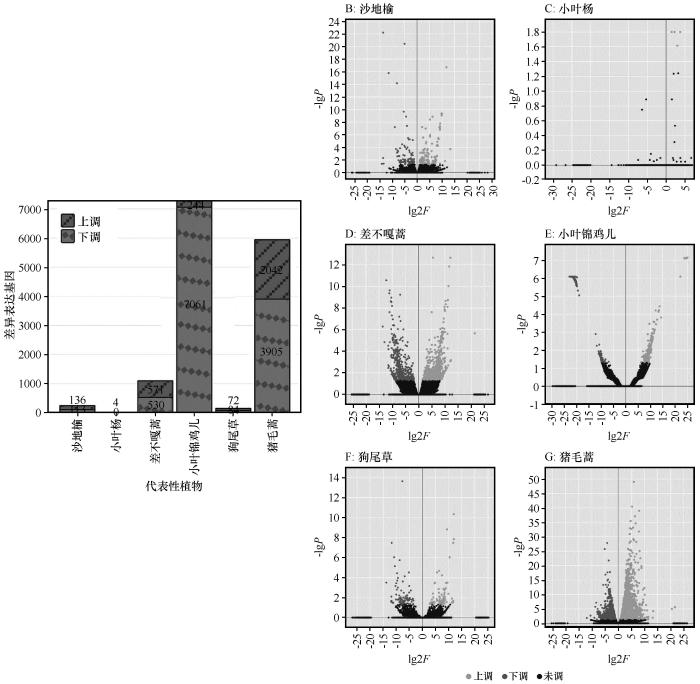
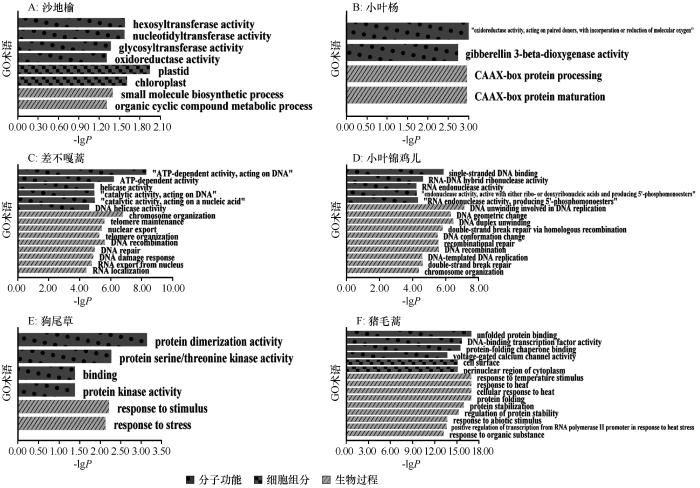
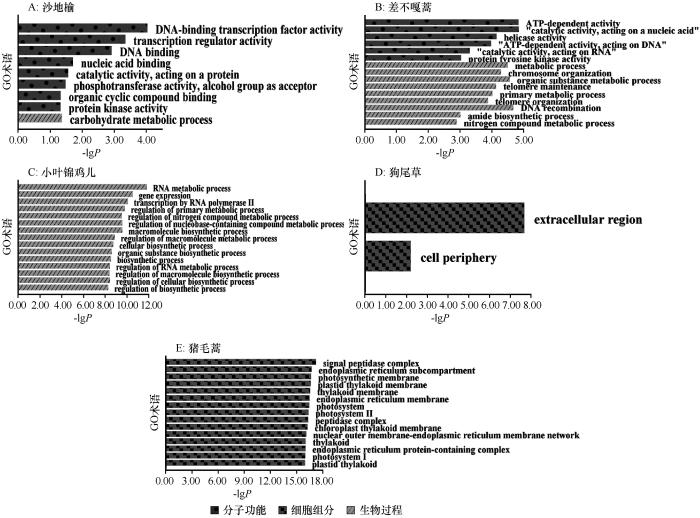
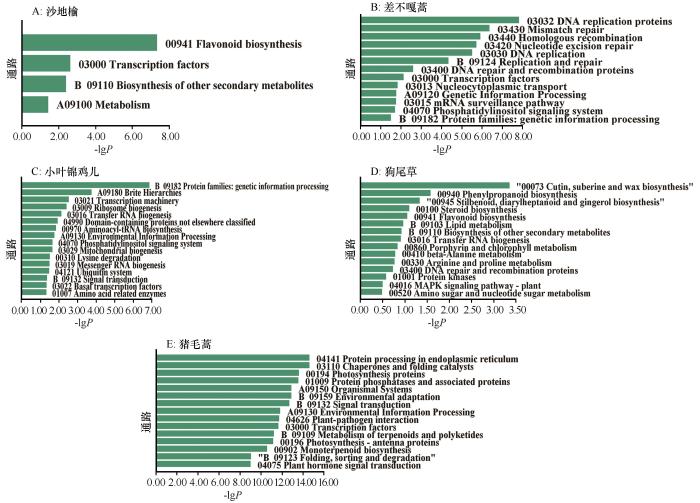
... 差异表达基因最根本地反映了植物逆境适应的方法以及带来的影响.本研究发现增温没有显著影响乔木尤其是小叶杨和狗尾草的基因表达,这可能是因为乔木可以依靠厚实的表皮和器官内丰富的代谢物质来缓冲环境波动的影响,相比之下,狗尾草虽然缺乏如此复杂的结构,但其广泛的适应能力使其能在多变环境中快速调整生长策略,保障其生长与繁殖[38].相对而言,增温时,小叶锦鸡儿与猪毛蒿的基因表达均出现较大波动(图4),这种转录响应模式揭示了两种植物对温度胁迫的敏感程度及适应能力的差异,其基因表达规律不仅为解析植物温度适应机制提供了分子证据,响应模式差异还能指导沙地生态治理.差异表达基因的富集表明植物的适应策略[27].在植物抗逆机制研究中,类黄酮代谢通路被广泛证实参与多种胁迫响应过程[28].本研究发现沙地榆和狗尾草在胁迫条件下均表现出类黄酮代谢通路的富集,这与众多植物抗逆性研究结果一致[39],并且类黄酮一直被认为是植物的抗氧化剂,保护植物免受各种生物和非生物胁迫[40],这种保守型代谢通路的激活,为解析沙生植物抗逆机制提供了代谢层面的证据. ...
Comparative analysis of the physiological and transcriptomic profiles reveals alfalfa drought resistance mechanisms
2
2024
... 对此,本研究以科尔沁沙地代表性乔灌草植物沙地榆(Ulmus pumila var. sabulosa)、小叶杨(Populus simonii)、差不嘎蒿(Artemisia halodendron)、小叶锦鸡儿(Caragana microphylla)、狗尾草(Setaria viridis)和猪毛蒿(Artemisia scoparia)[24-26]为对象,结合转录组测序[27-28],目的在于:①明确沙地典型乔灌草植物在适应高温胁迫分子信号中占主导地位的转录因子家族;②揭示沙地代表性植物受增温影响的关键生理过程;③对比分析其重要通路的基因表达情况,探明不同生活型植物的温度适应性. ...
... 差异表达基因最根本地反映了植物逆境适应的方法以及带来的影响.本研究发现增温没有显著影响乔木尤其是小叶杨和狗尾草的基因表达,这可能是因为乔木可以依靠厚实的表皮和器官内丰富的代谢物质来缓冲环境波动的影响,相比之下,狗尾草虽然缺乏如此复杂的结构,但其广泛的适应能力使其能在多变环境中快速调整生长策略,保障其生长与繁殖[38].相对而言,增温时,小叶锦鸡儿与猪毛蒿的基因表达均出现较大波动(图4),这种转录响应模式揭示了两种植物对温度胁迫的敏感程度及适应能力的差异,其基因表达规律不仅为解析植物温度适应机制提供了分子证据,响应模式差异还能指导沙地生态治理.差异表达基因的富集表明植物的适应策略[27].在植物抗逆机制研究中,类黄酮代谢通路被广泛证实参与多种胁迫响应过程[28].本研究发现沙地榆和狗尾草在胁迫条件下均表现出类黄酮代谢通路的富集,这与众多植物抗逆性研究结果一致[39],并且类黄酮一直被认为是植物的抗氧化剂,保护植物免受各种生物和非生物胁迫[40],这种保守型代谢通路的激活,为解析沙生植物抗逆机制提供了代谢层面的证据. ...
科尔沁沙地奈曼地区降水变化特征分析
1
2011
... 研究区位于内蒙古奈曼旗(42°14′—43°32′N、120°19′—121°35′E,海拔200~360 m),该地区处于中国农牧交错带东段的科尔沁沙地,作为中国北方主要沙尘源区,是开展沙质草地退化及其生态恢复过程研究的关键区域.气候特征为温带大陆性半干旱气候,年降水量350~500 mm[29],集中在6—8月,年蒸发量1 500~2 500 mm,年均气温4~7 ℃,地形地貌以固定沙丘、半固定沙丘、流动沙丘和丘间甸子地交错分布为主,土壤主要类型为风沙质土壤,其次是草甸土和栗钙土.沙地以不同演替阶段的次生植被为优势物种[30],研究区域天然植被以固沙植物为主,包括糙隐子草(Cleistogenes squarrosa)、狗尾草、猪毛菜(Salsola collina)、雾冰藜(Grubovia dasyphylla)、猪毛蒿、达乌里胡枝子、蒙古虫实(Corispermu mmongolicum)和小叶锦鸡儿等[31]. ...
科尔沁地区年降水波动与空间分异特征
1
2017
... 研究区位于内蒙古奈曼旗(42°14′—43°32′N、120°19′—121°35′E,海拔200~360 m),该地区处于中国农牧交错带东段的科尔沁沙地,作为中国北方主要沙尘源区,是开展沙质草地退化及其生态恢复过程研究的关键区域.气候特征为温带大陆性半干旱气候,年降水量350~500 mm[29],集中在6—8月,年蒸发量1 500~2 500 mm,年均气温4~7 ℃,地形地貌以固定沙丘、半固定沙丘、流动沙丘和丘间甸子地交错分布为主,土壤主要类型为风沙质土壤,其次是草甸土和栗钙土.沙地以不同演替阶段的次生植被为优势物种[30],研究区域天然植被以固沙植物为主,包括糙隐子草(Cleistogenes squarrosa)、狗尾草、猪毛菜(Salsola collina)、雾冰藜(Grubovia dasyphylla)、猪毛蒿、达乌里胡枝子、蒙古虫实(Corispermu mmongolicum)和小叶锦鸡儿等[31]. ...
Spatial heterogeneity of soil properties and vegetation-soil relationships following vegetation restoration of mobile dunes in Horqin Sandy Land,Northern China
1
2009
... 研究区位于内蒙古奈曼旗(42°14′—43°32′N、120°19′—121°35′E,海拔200~360 m),该地区处于中国农牧交错带东段的科尔沁沙地,作为中国北方主要沙尘源区,是开展沙质草地退化及其生态恢复过程研究的关键区域.气候特征为温带大陆性半干旱气候,年降水量350~500 mm[29],集中在6—8月,年蒸发量1 500~2 500 mm,年均气温4~7 ℃,地形地貌以固定沙丘、半固定沙丘、流动沙丘和丘间甸子地交错分布为主,土壤主要类型为风沙质土壤,其次是草甸土和栗钙土.沙地以不同演替阶段的次生植被为优势物种[30],研究区域天然植被以固沙植物为主,包括糙隐子草(Cleistogenes squarrosa)、狗尾草、猪毛菜(Salsola collina)、雾冰藜(Grubovia dasyphylla)、猪毛蒿、达乌里胡枝子、蒙古虫实(Corispermu mmongolicum)和小叶锦鸡儿等[31]. ...
Open-top designs for manipulating field temperature in high-latitude ecosystems
1
1997
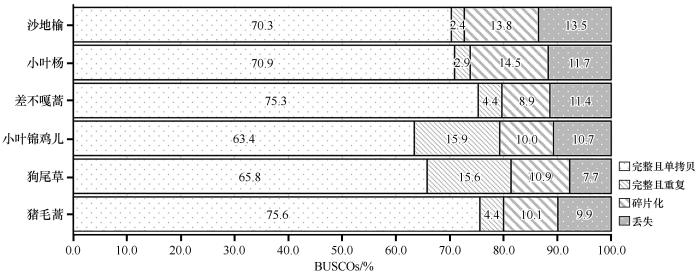
... 本试验所取得的植物材料均来源于中国科学院奈曼沙漠化研究站增温观测场.观测场建于2005年.全年增温样地利用开顶式生长室(OTC)作为增温设施[32],植物生长季设施内平均大气温度上升约2.3 ℃.共计12个试验小区.2017年将沙地代表性乔木(沙地榆和小叶杨)、灌木(小叶锦鸡儿和差不嘎蒿)、草本(狗尾草和猪毛蒿)植物栽植于观测场,于2022年对每个小区的供试物种进行3次重复取样,每次取样为灌木、草本至少5株,乔木至少3株,以生长情况相似的植株叶片作为混合样.取样时间为8月生长盛期.所有新鲜标本均保存在-80 ℃下进行转录组测序. ...
TBtools-II:A “one for all,all for one” bioinformatics platform for biological big-data mining
1
2023
... 使用TBtools-II软件(版本v2.210)[33]进行Gene Ontology Enrichment 和KEGG Enrichment Analyse并进行Enrichment Bar plot 绘制. ...
Gene networks involved in drought stress response and tolerance
1
2006
... 沙地代表性植物转录因子共表达网络中专性响应热胁迫的HSF因子表现不突出,这是因为HSF数量较少,另一重要原因是高温引起的干旱、高盐协同大风、沙埋等外界胁迫共同作用于沙地植物.本研究指出,无论乔木、灌木还是草本植物增温的转录因子基因共表达网络里MYB基因数量都占优且有高GS和MM,在网络中和增温后基因表达调控中有主导作用的影响,这与大多数植物响应非生物胁迫时MYB转录因子家族的优异表现相符合[34].研究发现沙地代表性灌木重要的高温胁迫反应因子GRAS家族的众多亚家族参与了赤霉素(GA)调节植物中的各种生理过程,此外GRAS部分亚家族在JA的生物合成中也起到关键作用,比如DELLA是GA信号传导成分,VaPAT1在冷应激中调节JA生物合成[35-36].乔木和草本中AP2/ERF蛋白家族也是因其庞大的数量与应对逆境胁迫的调控在共表达网络中出彩,除此之外还有许多TF在共表达网络中(图3)与上述基因协同工作[37]. ...
GRAS transcription factors emerging regulator in plants growth,development,and multiple stresses
1
2022
... 沙地代表性植物转录因子共表达网络中专性响应热胁迫的HSF因子表现不突出,这是因为HSF数量较少,另一重要原因是高温引起的干旱、高盐协同大风、沙埋等外界胁迫共同作用于沙地植物.本研究指出,无论乔木、灌木还是草本植物增温的转录因子基因共表达网络里MYB基因数量都占优且有高GS和MM,在网络中和增温后基因表达调控中有主导作用的影响,这与大多数植物响应非生物胁迫时MYB转录因子家族的优异表现相符合[34].研究发现沙地代表性灌木重要的高温胁迫反应因子GRAS家族的众多亚家族参与了赤霉素(GA)调节植物中的各种生理过程,此外GRAS部分亚家族在JA的生物合成中也起到关键作用,比如DELLA是GA信号传导成分,VaPAT1在冷应激中调节JA生物合成[35-36].乔木和草本中AP2/ERF蛋白家族也是因其庞大的数量与应对逆境胁迫的调控在共表达网络中出彩,除此之外还有许多TF在共表达网络中(图3)与上述基因协同工作[37]. ...
GRAS-domain transcription factor PAT1 regulates jasmonic acid biosynthesis in grape cold stress response
1
2021
... 沙地代表性植物转录因子共表达网络中专性响应热胁迫的HSF因子表现不突出,这是因为HSF数量较少,另一重要原因是高温引起的干旱、高盐协同大风、沙埋等外界胁迫共同作用于沙地植物.本研究指出,无论乔木、灌木还是草本植物增温的转录因子基因共表达网络里MYB基因数量都占优且有高GS和MM,在网络中和增温后基因表达调控中有主导作用的影响,这与大多数植物响应非生物胁迫时MYB转录因子家族的优异表现相符合[34].研究发现沙地代表性灌木重要的高温胁迫反应因子GRAS家族的众多亚家族参与了赤霉素(GA)调节植物中的各种生理过程,此外GRAS部分亚家族在JA的生物合成中也起到关键作用,比如DELLA是GA信号传导成分,VaPAT1在冷应激中调节JA生物合成[35-36].乔木和草本中AP2/ERF蛋白家族也是因其庞大的数量与应对逆境胁迫的调控在共表达网络中出彩,除此之外还有许多TF在共表达网络中(图3)与上述基因协同工作[37]. ...
The Arabidopsis ETHYLENE RESPONSE FACTOR1 regulates abiotic stress-responsive gene expression by binding to different cis-acting elements in response to different stress signals
1
2013
... 沙地代表性植物转录因子共表达网络中专性响应热胁迫的HSF因子表现不突出,这是因为HSF数量较少,另一重要原因是高温引起的干旱、高盐协同大风、沙埋等外界胁迫共同作用于沙地植物.本研究指出,无论乔木、灌木还是草本植物增温的转录因子基因共表达网络里MYB基因数量都占优且有高GS和MM,在网络中和增温后基因表达调控中有主导作用的影响,这与大多数植物响应非生物胁迫时MYB转录因子家族的优异表现相符合[34].研究发现沙地代表性灌木重要的高温胁迫反应因子GRAS家族的众多亚家族参与了赤霉素(GA)调节植物中的各种生理过程,此外GRAS部分亚家族在JA的生物合成中也起到关键作用,比如DELLA是GA信号传导成分,VaPAT1在冷应激中调节JA生物合成[35-36].乔木和草本中AP2/ERF蛋白家族也是因其庞大的数量与应对逆境胁迫的调控在共表达网络中出彩,除此之外还有许多TF在共表达网络中(图3)与上述基因协同工作[37]. ...
科尔沁沙地植被演替的抗逆性特征
1
1999
... 差异表达基因最根本地反映了植物逆境适应的方法以及带来的影响.本研究发现增温没有显著影响乔木尤其是小叶杨和狗尾草的基因表达,这可能是因为乔木可以依靠厚实的表皮和器官内丰富的代谢物质来缓冲环境波动的影响,相比之下,狗尾草虽然缺乏如此复杂的结构,但其广泛的适应能力使其能在多变环境中快速调整生长策略,保障其生长与繁殖[38].相对而言,增温时,小叶锦鸡儿与猪毛蒿的基因表达均出现较大波动(图4),这种转录响应模式揭示了两种植物对温度胁迫的敏感程度及适应能力的差异,其基因表达规律不仅为解析植物温度适应机制提供了分子证据,响应模式差异还能指导沙地生态治理.差异表达基因的富集表明植物的适应策略[27].在植物抗逆机制研究中,类黄酮代谢通路被广泛证实参与多种胁迫响应过程[28].本研究发现沙地榆和狗尾草在胁迫条件下均表现出类黄酮代谢通路的富集,这与众多植物抗逆性研究结果一致[39],并且类黄酮一直被认为是植物的抗氧化剂,保护植物免受各种生物和非生物胁迫[40],这种保守型代谢通路的激活,为解析沙生植物抗逆机制提供了代谢层面的证据. ...
Genetic determinants of the network of primary metabolism and their relationships to plant performance in a maize recombinant inbred line population
1
2015
... 差异表达基因最根本地反映了植物逆境适应的方法以及带来的影响.本研究发现增温没有显著影响乔木尤其是小叶杨和狗尾草的基因表达,这可能是因为乔木可以依靠厚实的表皮和器官内丰富的代谢物质来缓冲环境波动的影响,相比之下,狗尾草虽然缺乏如此复杂的结构,但其广泛的适应能力使其能在多变环境中快速调整生长策略,保障其生长与繁殖[38].相对而言,增温时,小叶锦鸡儿与猪毛蒿的基因表达均出现较大波动(图4),这种转录响应模式揭示了两种植物对温度胁迫的敏感程度及适应能力的差异,其基因表达规律不仅为解析植物温度适应机制提供了分子证据,响应模式差异还能指导沙地生态治理.差异表达基因的富集表明植物的适应策略[27].在植物抗逆机制研究中,类黄酮代谢通路被广泛证实参与多种胁迫响应过程[28].本研究发现沙地榆和狗尾草在胁迫条件下均表现出类黄酮代谢通路的富集,这与众多植物抗逆性研究结果一致[39],并且类黄酮一直被认为是植物的抗氧化剂,保护植物免受各种生物和非生物胁迫[40],这种保守型代谢通路的激活,为解析沙生植物抗逆机制提供了代谢层面的证据. ...
Enhancement of oxidative and drought tolerance in Arabidopsis by overaccumulation of antioxidant flavonoids
1
2014
... 差异表达基因最根本地反映了植物逆境适应的方法以及带来的影响.本研究发现增温没有显著影响乔木尤其是小叶杨和狗尾草的基因表达,这可能是因为乔木可以依靠厚实的表皮和器官内丰富的代谢物质来缓冲环境波动的影响,相比之下,狗尾草虽然缺乏如此复杂的结构,但其广泛的适应能力使其能在多变环境中快速调整生长策略,保障其生长与繁殖[38].相对而言,增温时,小叶锦鸡儿与猪毛蒿的基因表达均出现较大波动(图4),这种转录响应模式揭示了两种植物对温度胁迫的敏感程度及适应能力的差异,其基因表达规律不仅为解析植物温度适应机制提供了分子证据,响应模式差异还能指导沙地生态治理.差异表达基因的富集表明植物的适应策略[27].在植物抗逆机制研究中,类黄酮代谢通路被广泛证实参与多种胁迫响应过程[28].本研究发现沙地榆和狗尾草在胁迫条件下均表现出类黄酮代谢通路的富集,这与众多植物抗逆性研究结果一致[39],并且类黄酮一直被认为是植物的抗氧化剂,保护植物免受各种生物和非生物胁迫[40],这种保守型代谢通路的激活,为解析沙生植物抗逆机制提供了代谢层面的证据. ...
Heat stress:an overview of molecular responses in photosynthesis
1
2008
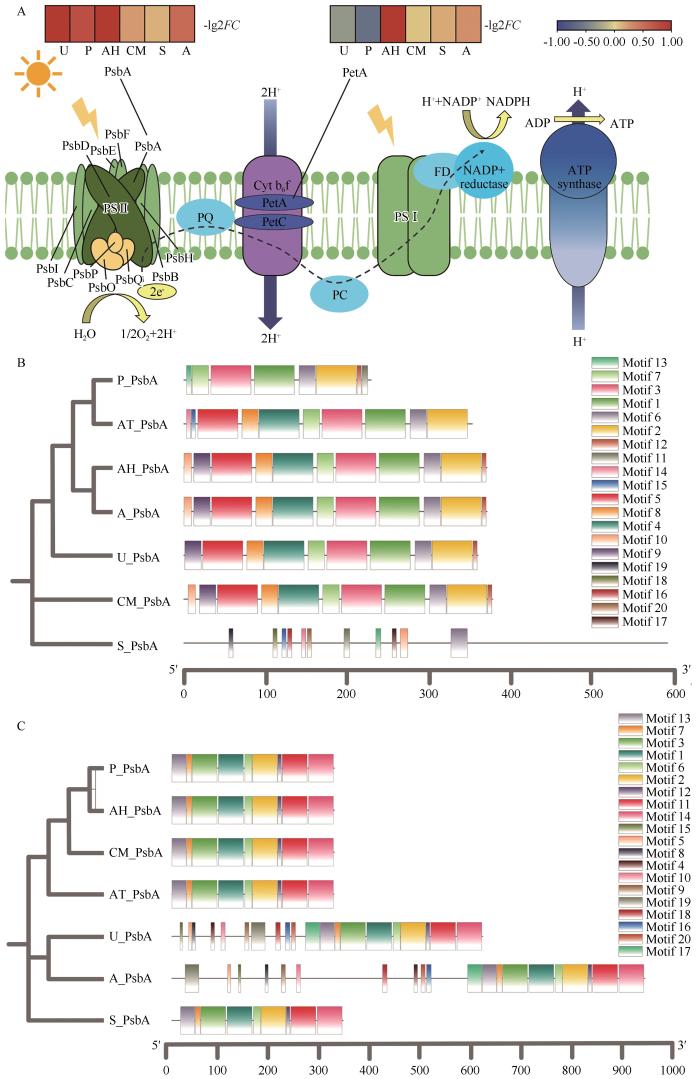
... 光合通路是植物正常生长发育的基础保障,在逆境条件下(如高温)更需要重点维护,因为高温会损伤植物的光系统II(PSII),导致其生理功能受损,进而降低植物的生产力[41].PSII作为光合作用中的热敏脆弱环节,热应激会破坏关键组分D1蛋白(PsbA基因产物)的结构和功能[42],其功能的修复重点就体现在PsbA基因高表达及D1蛋白快速积累.已有研究表明,众多作物(如小麦)[43]的耐热型比热敏型表现出更强的PsbA基因表达能力,因此该基因的表达水平可作为沙地耐高温植株评估和选育的重要指标,PetA基因(编码细胞色素b6/f中的光合电子传递蛋白)的上调通常反映PSI(光系统I)和PSII之间电子转移的调整[44],进一步维持高温下的光合效率.本研究发现沙地代表性灌木与草本植物在增温中光合作用表现出更大的电子传递压力.PsbA和PetA蛋白在多种植物中都具有较保守的结构,但狗尾草(C4植物)的PsbA蛋白特异结构可能与其高光效及耐高温特性直接相关,其独特的基序排列可能通过加速D1蛋白的周转速率来适应复杂环境下的快速修复需求,从而维持光合系统的稳定性[45]. ...
The chlorophyll a fluorescence as an indicator of the temperature stress in the leaves of Prunus persica
1
2012
... 光合通路是植物正常生长发育的基础保障,在逆境条件下(如高温)更需要重点维护,因为高温会损伤植物的光系统II(PSII),导致其生理功能受损,进而降低植物的生产力[41].PSII作为光合作用中的热敏脆弱环节,热应激会破坏关键组分D1蛋白(PsbA基因产物)的结构和功能[42],其功能的修复重点就体现在PsbA基因高表达及D1蛋白快速积累.已有研究表明,众多作物(如小麦)[43]的耐热型比热敏型表现出更强的PsbA基因表达能力,因此该基因的表达水平可作为沙地耐高温植株评估和选育的重要指标,PetA基因(编码细胞色素b6/f中的光合电子传递蛋白)的上调通常反映PSI(光系统I)和PSII之间电子转移的调整[44],进一步维持高温下的光合效率.本研究发现沙地代表性灌木与草本植物在增温中光合作用表现出更大的电子传递压力.PsbA和PetA蛋白在多种植物中都具有较保守的结构,但狗尾草(C4植物)的PsbA蛋白特异结构可能与其高光效及耐高温特性直接相关,其独特的基序排列可能通过加速D1蛋白的周转速率来适应复杂环境下的快速修复需求,从而维持光合系统的稳定性[45]. ...
High temperature effects on D1 protein turnover in three wheat varieties with different heat susceptibility
1
2017
... 光合通路是植物正常生长发育的基础保障,在逆境条件下(如高温)更需要重点维护,因为高温会损伤植物的光系统II(PSII),导致其生理功能受损,进而降低植物的生产力[41].PSII作为光合作用中的热敏脆弱环节,热应激会破坏关键组分D1蛋白(PsbA基因产物)的结构和功能[42],其功能的修复重点就体现在PsbA基因高表达及D1蛋白快速积累.已有研究表明,众多作物(如小麦)[43]的耐热型比热敏型表现出更强的PsbA基因表达能力,因此该基因的表达水平可作为沙地耐高温植株评估和选育的重要指标,PetA基因(编码细胞色素b6/f中的光合电子传递蛋白)的上调通常反映PSI(光系统I)和PSII之间电子转移的调整[44],进一步维持高温下的光合效率.本研究发现沙地代表性灌木与草本植物在增温中光合作用表现出更大的电子传递压力.PsbA和PetA蛋白在多种植物中都具有较保守的结构,但狗尾草(C4植物)的PsbA蛋白特异结构可能与其高光效及耐高温特性直接相关,其独特的基序排列可能通过加速D1蛋白的周转速率来适应复杂环境下的快速修复需求,从而维持光合系统的稳定性[45]. ...
Cyclophilin 37 maintains electron transport via the cytochrome b6/f complex under high light in Arabidopsis
1
2023
... 光合通路是植物正常生长发育的基础保障,在逆境条件下(如高温)更需要重点维护,因为高温会损伤植物的光系统II(PSII),导致其生理功能受损,进而降低植物的生产力[41].PSII作为光合作用中的热敏脆弱环节,热应激会破坏关键组分D1蛋白(PsbA基因产物)的结构和功能[42],其功能的修复重点就体现在PsbA基因高表达及D1蛋白快速积累.已有研究表明,众多作物(如小麦)[43]的耐热型比热敏型表现出更强的PsbA基因表达能力,因此该基因的表达水平可作为沙地耐高温植株评估和选育的重要指标,PetA基因(编码细胞色素b6/f中的光合电子传递蛋白)的上调通常反映PSI(光系统I)和PSII之间电子转移的调整[44],进一步维持高温下的光合效率.本研究发现沙地代表性灌木与草本植物在增温中光合作用表现出更大的电子传递压力.PsbA和PetA蛋白在多种植物中都具有较保守的结构,但狗尾草(C4植物)的PsbA蛋白特异结构可能与其高光效及耐高温特性直接相关,其独特的基序排列可能通过加速D1蛋白的周转速率来适应复杂环境下的快速修复需求,从而维持光合系统的稳定性[45]. ...
水分胁迫对2种科尔沁沙地植物光合和水分利用特性的影响
1
2008
... 光合通路是植物正常生长发育的基础保障,在逆境条件下(如高温)更需要重点维护,因为高温会损伤植物的光系统II(PSII),导致其生理功能受损,进而降低植物的生产力[41].PSII作为光合作用中的热敏脆弱环节,热应激会破坏关键组分D1蛋白(PsbA基因产物)的结构和功能[42],其功能的修复重点就体现在PsbA基因高表达及D1蛋白快速积累.已有研究表明,众多作物(如小麦)[43]的耐热型比热敏型表现出更强的PsbA基因表达能力,因此该基因的表达水平可作为沙地耐高温植株评估和选育的重要指标,PetA基因(编码细胞色素b6/f中的光合电子传递蛋白)的上调通常反映PSI(光系统I)和PSII之间电子转移的调整[44],进一步维持高温下的光合效率.本研究发现沙地代表性灌木与草本植物在增温中光合作用表现出更大的电子传递压力.PsbA和PetA蛋白在多种植物中都具有较保守的结构,但狗尾草(C4植物)的PsbA蛋白特异结构可能与其高光效及耐高温特性直接相关,其独特的基序排列可能通过加速D1蛋白的周转速率来适应复杂环境下的快速修复需求,从而维持光合系统的稳定性[45]. ...
Role of jasmonic acid in plants:the molecular point of view
1
2021
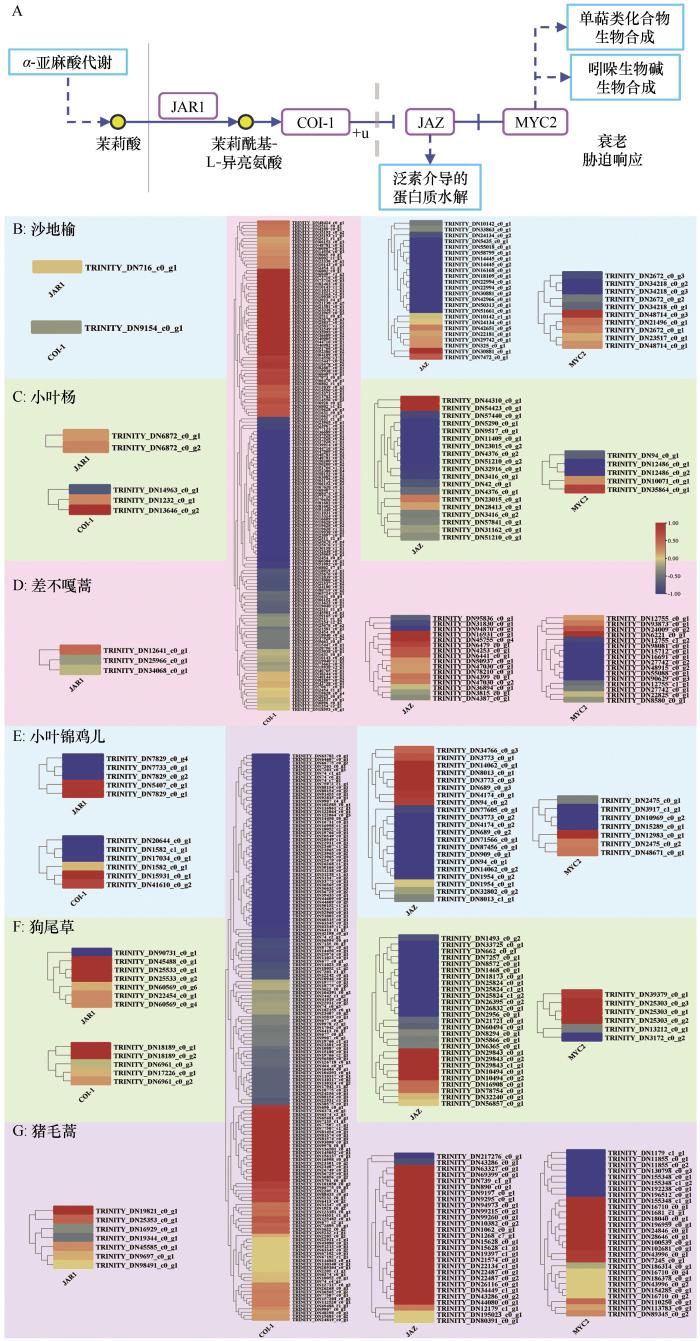
... JA的信号通路主要参与植物应对生物胁迫(如微生物病原体侵染和虫害)和非生物胁迫(如干旱、盐害及温度胁迫)的响应[46],还与其他植物激素协同工作调控植物生长发育.传统研究多关注低温对JA通路的诱导作用,但现有研究报道JA信号也与热胁迫相关:当植物受到高温胁迫时,JA-lle与COI-1和JAZ蛋白结合[47],释放MYBs、WRKYs、MYCs等转录因子,激活下游耐热基因的表达网络[48].本研究发现不同生活型沙地植物对增温的JA信号响应存在差异:蒿属植物表现出丰富的COI-1表达,意味着JA信号通路激活的转录调控网络和涉及的基因表达更为复杂,这可能赋予蒿属植物更强的环境胁迫指示性与适应能力,相比而言,乔木JAR1及下游两激活蛋白的表达都未显著升高,甚至出现负调节模式,而灌木和草本则通过正向激活JA信号通路响应增温.本研究结果表明,沙地代表性蒿属植物对增温的敏感性更高,其JA信号通路的动态变化可作为环境胁迫响应的有效指标. ...
Jasmonate perception by inositol-phosphate-potentiated COI1-JAZ co-receptor
1
2010
... JA的信号通路主要参与植物应对生物胁迫(如微生物病原体侵染和虫害)和非生物胁迫(如干旱、盐害及温度胁迫)的响应[46],还与其他植物激素协同工作调控植物生长发育.传统研究多关注低温对JA通路的诱导作用,但现有研究报道JA信号也与热胁迫相关:当植物受到高温胁迫时,JA-lle与COI-1和JAZ蛋白结合[47],释放MYBs、WRKYs、MYCs等转录因子,激活下游耐热基因的表达网络[48].本研究发现不同生活型沙地植物对增温的JA信号响应存在差异:蒿属植物表现出丰富的COI-1表达,意味着JA信号通路激活的转录调控网络和涉及的基因表达更为复杂,这可能赋予蒿属植物更强的环境胁迫指示性与适应能力,相比而言,乔木JAR1及下游两激活蛋白的表达都未显著升高,甚至出现负调节模式,而灌木和草本则通过正向激活JA信号通路响应增温.本研究结果表明,沙地代表性蒿属植物对增温的敏感性更高,其JA信号通路的动态变化可作为环境胁迫响应的有效指标. ...
Jasmonic ccid signaling pathway in plants
1
2019
... JA的信号通路主要参与植物应对生物胁迫(如微生物病原体侵染和虫害)和非生物胁迫(如干旱、盐害及温度胁迫)的响应[46],还与其他植物激素协同工作调控植物生长发育.传统研究多关注低温对JA通路的诱导作用,但现有研究报道JA信号也与热胁迫相关:当植物受到高温胁迫时,JA-lle与COI-1和JAZ蛋白结合[47],释放MYBs、WRKYs、MYCs等转录因子,激活下游耐热基因的表达网络[48].本研究发现不同生活型沙地植物对增温的JA信号响应存在差异:蒿属植物表现出丰富的COI-1表达,意味着JA信号通路激活的转录调控网络和涉及的基因表达更为复杂,这可能赋予蒿属植物更强的环境胁迫指示性与适应能力,相比而言,乔木JAR1及下游两激活蛋白的表达都未显著升高,甚至出现负调节模式,而灌木和草本则通过正向激活JA信号通路响应增温.本研究结果表明,沙地代表性蒿属植物对增温的敏感性更高,其JA信号通路的动态变化可作为环境胁迫响应的有效指标. ...





 甘公网安备 62010202000688号
甘公网安备 62010202000688号